优先解剖肝实质法在腹腔镜下鞘外肝蒂血流阻断中的应用:附解剖性肝中叶切除1例
肖亮,方统迪,龙果,胡曦,李增博,王栋,王志明,周乐杜
(中南大学湘雅医院 肝脏外科,长沙 410008)
腹腔镜下解剖性肝叶切除术(anatomical laparoscopic hepatolobectomy,ALH)是普通外科难度较大的手术之一,在很多医院尚未常规开展,主要原因在于腔镜下肝蒂解剖血流阻断技术和肝实质离断过程中的止血技术较难掌握。最早的ALH沿袭开放手术“肝蒂优先”[1-3]的思路,即先游离并离阻断待切除肝叶的肝蒂,再沿缺血线和肝静脉离断肝实质。按照具体操作方法,又可分为“鞘内解剖法”和“鞘外解剖法”[4-9]。前者是将肝蒂内肝动脉及门静脉分别游离后再行离断,但这种方法费时费力,稍有不慎就可能损伤门静脉或肝门短静脉[10],导致大出血,从而被迫中转开腹;后者又被称为肝蒂横断式切肝法,最早由Takasaki教授[11-12]提出,它在开放手术中较之”鞘内解剖法”能缩短手术时间短,减少术中出血,减轻肝脏缺血再灌注损伤。但是,由于腔镜下天然的视野局限和操作不便,ALH中行肝蒂横断式切肝鞘外解剖仍有不小难度。近年来,笔者从腹腔镜左肝外叶切除[13]受到启发,采用优先解剖肝实质(liver parenchyma dissecting-first,LPDF),再离断肝蒂的方法,明显简化了ALH鞘外肝蒂血流阻断,具有较好的临床应用前景及推广价值。笔者以2019年10月接受腹腔镜下解剖性肝中叶切除术的肝癌患者为例,初步介绍LPDF的应用经验,以供参考。
1 临床资料
1.1 病例资料
患者 男,32岁。术前肝脏CT平扫增强显示肝脏肿块位于8、5段和4b段(图1)。术前诊断:原发性肝癌,病毒性肝炎慢性乙型。本研究通过了我院伦理委员会批准,患者术前签署知情同 意书。
1.2 麻醉及手术方法
⑴ 体位与麻醉:患者仰卧位,气管插管下全麻,右侧腰背部稍垫高,切肝过程中采用低中心静脉压技术(0~5 cmH2O,1 cmH2O=0.098kPa)[14]。⑵ 手术步骤:5孔法布置Trocar(图2),建立气腹,探查确认肿块位置,排除腹腔内转移。离断肝圆韧带、镰状韧带、左右冠状韧带以显露肝上下腔静脉。切除胆囊。间歇性阻断第一肝门(阻断15 min松开5 min),用超声刀沿镰状韧带右侧(左侧切除线,图3A)向第一、二肝门方向充分解剖肝实质,遇肝内管道予Hamolok夹闭后离断。显露适当长度的右前叶肝蒂后用直角钳在其后方带线并结扎(图3B),腔镜下血管切割闭合器离断右前叶肝蒂(图3C),显示出右肝前、后叶之间的分界线(右侧切除线),用电钩标记(图3D-E)。再沿此线离断肝实质,显露右肝静脉(图3F),沿其向第二肝门方向解剖。途中所遇肝短静脉及肝中静脉(图3G)予Hamolok 夹闭后离断。直至两侧切面汇合,将肝中叶及肿块整块切除 (图3H),标本装入标本袋后,从剑突下纵行小切口(约10 cm)取出。于右膈下及温氏孔分别放置1根腹腔引流管,从右侧Trocar孔引出体外后缝合固定于皮肤。
1.3 术后观察与治疗
术后密切监测患者生命体征及腹部体征,引流液性状及引流量。术后0~3 d每天复查血常规,肝肾功能电解质,凝血功能(之后根据情况复查),如有异常,及时处理。于术后第3天(患者已恢复饮食)和第5天分2次留腹水标本检查总胆红素(大于血清总胆红素3倍为胆汁漏)以排除胆汁漏。常规给予抗病毒、护肝、补充白蛋白及静脉营养支持治疗。

图2 腹腔镜下解剖性肝中叶切除Trocar 位置(脐上沿放置10 mm Trocar,右侧锁骨中线脐上2 cm 放置 12 mm Trocar,右侧腋前线肋缘下放置5 mm Trocar,剑突下放置10 mm Trocar,正中线左侧放置5 mm Trocar)Figure 2 The position of Trocars for laparoscopic anatomical mesohepatectomy (a 10 mm Trocar placed above the umbilicus,a 12 mm Trocar placed on the right clavicle midline 2 cm above the umbilicus,a 5 mm Trocar placed on the anterior axillary line below the costal margin,a 10 mm Trocar placed on the below the xiphoid process,and a 5 mm Trocar placed on the left side of the median line)
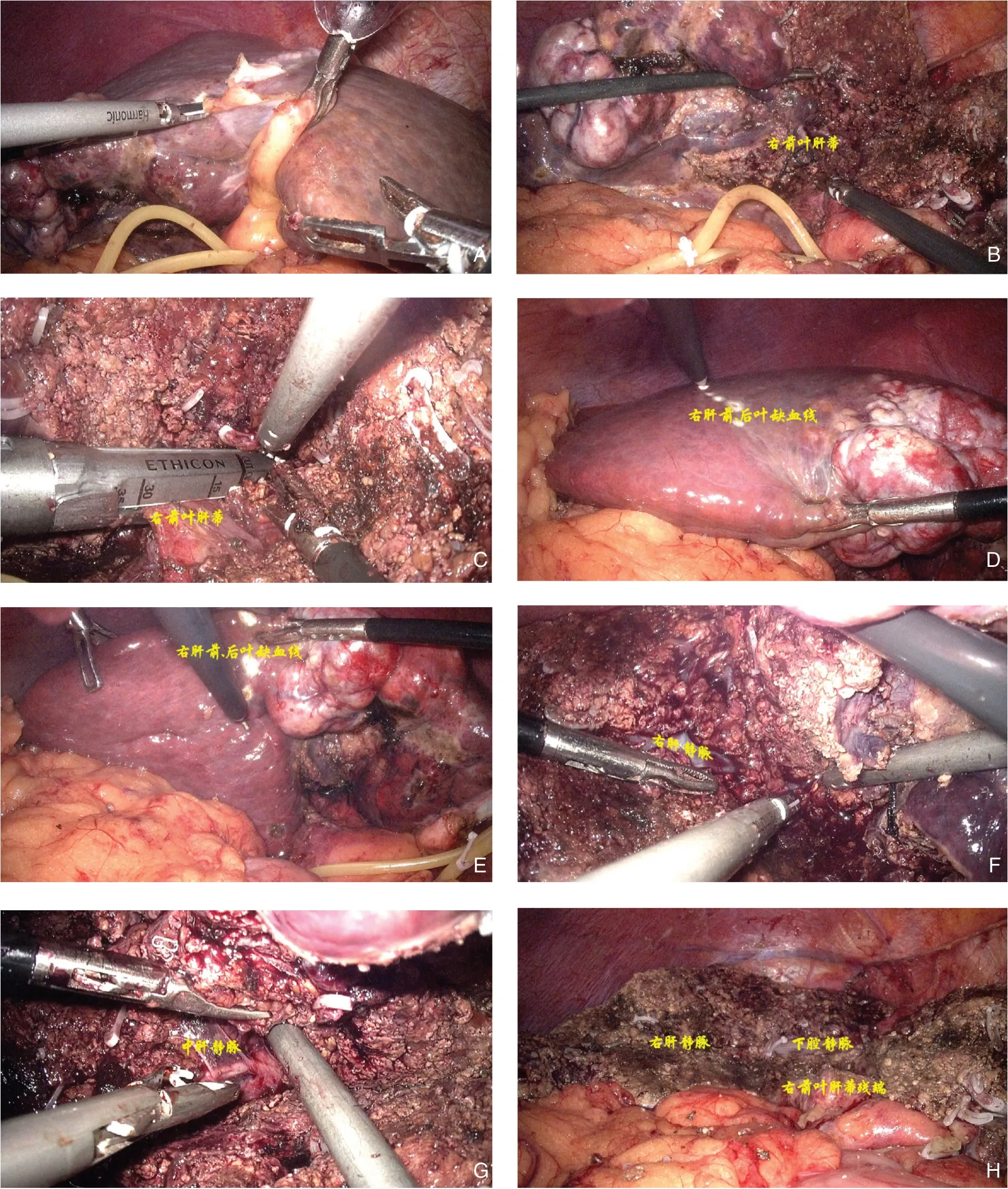
图3 腹腔镜下解剖性肝中叶切除术中照片Figure 3 Intraoperative views of laparoscopic anatomical mesohepatectomy
2 结 果
2.1 术中及术后恢复情况
患者顺利完成手术,手术时间为260 min,术中出血量约为300 mL,未输血。患者术后第2天下床活动,术后第3天肠道功能恢复,开始进食,未发生腹腔内大出血或胆汁漏等并发症。术后第6天拔除腹腔引流管后出院。
2.2 病理结果
中分化肝细胞癌(2个肿块,大小约4.5 cm× 3.5 cm×3 cm,4 cm×3 cm×3 cm),见卫星结节,见微血管侵犯3个(M1),未见神经侵犯,切缘阴性,癌旁组织肝纤维化改变,慢性胆囊炎并胆固醇息肉。
2.3 随访
出院后继续抗乙肝病毒治疗,因考虑有MVI,为肿瘤复发高危因素[15],建议患者使用靶向药物索拉菲尼或仑伐替尼抗肿瘤治疗(后患者因经济原因未使用)。术后1个月门诊复查彩超发现 117 mm×87 mm术区积液,但患者无发热、腹痛症状,WBC 9.2×109/L,中性粒细胞百分比70.4%,Hb146 g/L,41.6 g/L,总胆红素(TBIL)9.6 μmol/L,丙氨酸氨基转移酶(ALT)101.2 U/L,排除腹腔内出血及胆汁漏,考虑为创面渗液,予以继续观察。2019年12月30日复查彩超,积液区缩小至63 mm×44 mm。查WBC 7.7×109/L,中性粒细胞百分比68.2%,Hb152 g/L,Alb 48.7 g/L,TBIL 9.3 μmol/L,ALT 64.5 U/L,AFP由术前>800 ng/mL下降至33.38 ng/mL。患者无特殊不适,一般状况良好。
3 讨 论
ALH,特别是左、右半肝切除,中肝叶切除、右肝前、后叶切除,左肝内叶切除,手术范围较大,操作较复杂,能否顺利完成,是检验腔镜肝脏外科医师是否成熟的标志。妨碍ALH广泛普及的一个主要障碍是止血困难,其主要原因是腹腔镜下视野与操作空间有限,肝实质解剖过程中容易发生难以控制的出血,导致中转开腹。在用血紧张的情况下,外科医师更加不愿意尝试。另外,术中大量输血可增加术后感染等并发症发生率[16-17],也是肿瘤复发的危险因素之一[18]。因此,顺利完成ALH需要较长的学习曲线,而术中对出血的有效控制是ALH成功实施及改善患者预后的关键。
传统的ALH术式是先行“鞘内解剖”,将目标肝蒂内的门静脉、肝动脉,胆管一一离断,待确认缺血线后再解剖肝实质[19],这一方法也被称为“肝蒂优先”的切肝法[20-26]。它符合Makuuchi教授提出的解剖性肝切除理念[1-3],一直为临床所广泛采用。但是,笔者体会这种方法费时(通常花费30 min)费力,稍有不慎就将导致大出血,从而被迫中转开腹,这与吴柯等[27]的报道一致。后来,Takasaki教授[11-12]提出肝蒂横断式切肝法,并将其应用于开放式肝切除(这一方法被称为“鞘外解剖法”)。它能明显缩短手术时间,减少术中出血量,优势明显。Cho等[28-29]将这种方法用于ALH,认为是安全可行的。然而,笔者体会,由于肝蒂一级分支较短,加上腹腔镜下天然的视野局限及操作不便,使得在肝外行肝蒂鞘外解剖时困难较大,特别是在行右前及右后叶肝蒂套带时,很容易损伤肝蒂的后方血管壁或肝门短静脉,造成难以控制的出血。有时,不得不适当解剖目标肝蒂周围肝实质,才能达到松解、游离肝蒂的目的。但这仍然没有跳出“肝蒂优先”的框架。并且,在肝蒂存在变异情况下,有时候辛苦分离出的肝蒂并不是真正的“目标肝蒂”(阻断后肝脏缺血范围并非预计切除范围)。因此,有必要寻找一种更安全、直接、有效的方法达到腹腔镜下鞘外肝蒂血流阻断的目的。
为此,有两种方法可供选择,一是仍然遵循“肝蒂优先”的思路,在术前通过仔细阅读CT、MRI片,充分了解肝蒂的分支及脉管变异情况(可借助电脑软件如XP-LIver,制作肝脏肿块与血管的三维成像图)[22],在解剖肝蒂周围肝实质时,精细操作,最大程度减少副损伤和术中出血;另一个方法是跳出“肝蒂优先”的框架,由于ALH的切除范围较为明确,可以借鉴类似于腹腔镜下左肝外叶切除[23]的方法,先不处理第一肝门,而是沿设定好的切除线(比如缺血线)优先解剖肝实质,待肝实质充分离断后,自然能显露足够长的肝蒂(通常含部分肝内肝蒂),方便上切割闭合器离断。这样,既减少了腔镜下血管打结及缝合操作,降低手术难度,缩短手术时间,也有助于减少术后并发症[30-31]。笔者将这一技术命名为LPDF。目前,已经将其应用于腹腔镜下解剖性左、右半肝切除及右前、右后叶切除,取得了良好的效果。不久前,笔者又采用该技术顺利完成了这1 例解剖性中肝叶切除,该患者术后未发生严重的手术相关并发症,很快恢复进食及下床活动,在排除胆汁漏后拔除引流管,顺利出院。尽管术后复查发现术区积液,根据笔者经验,多为术后创面渗出液引流欠充分所致。因患者无发热腹痛等症状,2次复查血常规显示WBC和Hb均正常,可排除胆汁漏及腹腔出血。而且,随访过程中,彩超发现积液逐渐吸收,不需要穿刺置管引流,说明术后创面渗出有限,并没有造成严重后果,LPDF是安全、有效的。
笔者体会,LPDF与传统的“肝蒂优先”法相比,并没有扩大手术范围,只是调整了手术顺序,它提供了一种直接、快速“接近”3 个肝蒂主要分支(左支、右前支及右后支)的方法,不纠结于先行肝蒂的“鞘内”或“鞘外”解剖,而是在充分离断肝实质后,自然就可以很方便地行肝蒂的鞘外血流阻断,这种方法能明显缩短手术时间并减少术中出血(与笔者过去行腹腔镜下鞘内肝蒂解剖相比)。在间歇性全肝血流阻断的情况下,可减少解剖肝实质过程中的出血,而且,阻断次数也没有显著影响术后肝功能恢复[32]。因此,不必过分担心肝脏缺血再灌注损伤的问题。笔者超声刀的使用方法:带功率、快速、“小口”钳夹肝实质,此时,第一助手很重要,如果他提供了适当的对抗牵拉力和牵拉方向,则手术视野很好,肝实质很容易被钳夹开,也能较容易发现肝内的脉管结构,方便后续上Hamolok夹闭。上述过程中即使肝实质或小血管有少量的出血,也可以用双极电凝甚至是电凝棒很方便的控制住。另外,值得一提的是,在全程显露并沿肝静脉主干向第二肝门和下腔静脉方向解剖过程中,静脉壁上常出现有很多“筛孔”,可能导致较严重的出血,对此笔者的体会是:⑴ 好的低中心静脉压技术可以使这些“筛孔”不出血;⑵ 较多的渗血可以根据情况及术者经验灵活采用双极电凝直接烧灼或钛夹(先用分离钳提起部分静脉壁)夹闭止血。必要时可缝合止血,注意打结时勿撕裂血管壁,力度以出血停止即可;⑶ 较大筛孔,难以控制的出血,不宜盲目干预,以免撕裂静脉壁,扩大筛孔。可以迅速离断周围肝实质,让静脉壁回缩,有助于止血。或者暂停离断肝实质,用适量可吸收止血纱(1962,强生公司)覆盖出血点,它的封堵效应可明显减少出血,待血凝块形成后,出血停止,就可继续操作。也可以考虑缝合止血。
总之,从本例及以往其他患者的治疗经验出发,笔者认为,LPDF简化了ALH鞘外肝蒂血流阻断,是一项安全、有效的技术,具有良好的临床应用前景,值得进一步总结其应用于不同范围ALH的技术特点,并通过临床对照研究以探讨其相对于传统方法如“鞘内解剖”和“鞘外解剖”法的优势,为其临床推广奠定更好的理论和试验基础。

