肉桂油微乳工艺优化及其体外释放
肖小年,刘悦珍,易孜成,章 辉,刘 璟,王 凡,易醒
(南昌大学a.中德联合研究院;b.中德食品工程中心,江西 南昌 330047)
肉桂(Cinnamomumcassia)属于樟科(Lauraceae)植物,是一种常用的药食两用原料。中国是世界上肉桂产量最大的国家,种植历史已经超过2000年,种植区域主要是广东和广西两省[1-3]。肉桂油能够发挥抗氧化、抗菌、抗癌等多种作用,因此在食品、卫生、制剂、包装、化妆品等领域中被广泛地应用[4]。肉桂醛是肉桂油中的主要功效成分,含量高达90%,近些年来被学者们广泛研究[5]。口服肉桂醛可以刺激胰岛素的释放并且改善胰岛素敏感性,从而发挥降血糖的作用[6-9]。肉桂醛也可以通过刺激AMPK活化,促进脂肪酸氧化,阻止细胞分化和脂肪细胞形成[9-10]。此外,大量的研究也已证实,肉桂油对细菌和真菌都有很强的抑制作用[11-15]。肉桂油(Cinnamon Oil,CO)溶解度低、挥发性强,在加工、利用和贮存过程中易在空气、光和加热作用下分解[4],并且肉桂醛很容易在血液中转化为肉桂酸,从而影响肉桂油发挥其药理活性[16]。因此构建一种提高肉桂油水溶性和稳定性的制剂是十分必要的。
微乳是一个由水、油和双亲性物质表面活性剂组成的热力学稳定的各向同性液体[17]。微乳不仅对难溶性及脂溶性的药物具有增溶作用,还能够提高药物的稳定性,因此在中医药中,用微乳作为制剂的应用越来越多[18]。制备肉桂油的O/W型微乳,是一种提高肉桂油的溶解性、稳定性以及保持其功能性的有效的办法。
目前,国内外对肉桂油的研究主要集中在提取、化学成分鉴定以及相关制剂的制备及质量评价[19-23],对于肉桂油微乳在体外释放方面的研究报道相对较少。在本研究中,我们讨论了表面活性剂和助表面活性剂的比例(Km)以及温度对于O/W型肉桂油微乳(Cinnamon Oil Microemulsion,COME)形成的影响。从离心、冷热循环和长期储藏3个方面考察了肉桂油微乳的稳定性。此外,还对肉桂油微乳在不同pH介质中的释放动力学和机理进行了讨论。
1 材料与方法
1.1 材料与试剂
肉桂醛对照品≥99.5%,胃蛋白酶(酶活力1∶3000),胰酶,USP grade,阿拉丁试剂有限公司;肉桂油,吉安国光香料厂;甲醇,乙腈,色谱纯,天津市永大化学试剂有限公司;肉豆蔻酸异丙酯(IPM)、EL-40、Span 80、Tween 80、无水乙醇、丙三醇均为分析纯。
1.2 主要仪器设备
DDS-307型电导率仪,上海精密科学仪器有限公司;WYA-2W型阿贝折射仪,上海精密科学仪器有限公司;PB-10型pH计,赛多利斯科学仪器有限公司;NICOMP380ZL型激光纳米粒度测定仪,美国PSS粒度分析仪公司;JB-3型恒温磁力搅拌器,上海雷磁新泾仪器有限公司;Agilent 1200型高效液相色谱仪,安捷伦科技有限公司。
1.3 方法
1.3.1 肉桂油微乳的制备
把肉桂油和肉豆蔻酸异丙酯(IPM)按1∶1的比例加入烧杯中,搅拌均匀以后再依次加入Tween 80和丙三醇,把蒸馏水逐滴地加入正在磁力搅拌的预混料中。并且在开始加入蒸馏水后,把电导率仪放入烧杯里面,不断观察电导率的变化并记录,当电导率出现最大值时,停止水相的加入,并且记录下蒸馏水的用量。计算出油相、乳化剂和水相三相的质量分数,并以此为基础在伪三元相图标记为点,这些点的覆盖面积就是所形成的微乳区域面积(Microemulsion Area,ME)。在此基础上,根据最大的微乳区域面积来选择合适的组成和工艺条件。
1.3.2 表面活性剂和助表面活性剂的质量(Km)的选择
据1.3.1的实验步骤,在固定温度下,选择不同Km值(1∶1,2∶1,3∶1,4∶1,w/w)制备微乳并绘制伪三元相图,选择出合适的Km值。
1.3.3 温度对肉桂油微乳制备的影响
分别于25℃,40℃,50℃的温度下制备微乳,根据伪三元相图微乳区域的大小来确定最佳温度。
1.3.4 肉桂油微乳配方的优化
CO/IPM(1∶1,w/w)作为混合油相,无水乙醇/丙三醇(1∶1,w/w)作为混合助表面活性剂,选择Span 80和EL-40为表面活性剂分别与Tween 80进行复配,固定Km=4,在40℃下,根据1.3.1节的方法制备O/W型肉桂油微乳。
1.3.5 微乳的判别及类型鉴别
将制备的澄清体系在4 000r·min-1条件下离心20min,通过观察是否出现分层或者沉淀,来判断微乳的形成。在制得的微乳体系中加入红色的油溶性染料苏丹Ⅲ和蓝色的水溶性染料亚甲基蓝,观察两种染料在微乳中的扩散速度,判断微乳的类型[24]。
1.3.6 COME理化参数的测定
利用NICOMP380ZL型激光纳米粒度测定仪、DDS-307电导率仪以及WYA-2W型阿贝折射仪分别对肉桂油微乳的粒径、平均分布、电导率和折光度进行测定。
1.3.7 肉桂油中肉桂醛的检测[25]
液相色谱条件:色谱柱C18,5μm,4.6mm×250mm;流动相乙腈-0.1%磷酸溶液(33∶67);柱温25℃;进样量20μL;流速1.0mL·min-1;检测波长285nm。
工作曲线的制备:精密称量0.020 0g肉桂醛对照品,用甲醇溶解后,转移至25mL容量瓶中并定容,得到800μg·mL-1的肉桂醛储备液。用甲醇将储备液稀释成系列质量浓度为20,40,60,80,100,120,140,160μg·mL-1的对照品溶液,取20 μL进样,按照色谱条件检测肉桂醛含量,每个浓度进样3次,以肉桂醛对照品浓度(x)对峰面积(y)作图,绘制标准曲线。
COME供试品溶液:精密称取4.00g COME,加入一定质量的无水硫酸钠,破乳后取上清液,用甲醇适当稀释,过0.45μm微孔滤膜,得到COME供试品溶液。
1.3.8 肉桂油微乳稳定性考察
分别通过离心试验、加热-冷却循环实验、贮藏试验考察所制备的微乳配方的稳定性。
1.3.9 体外释放实验
人工肠液的配制(SIF)[26-27]:精确称量磷酸氢二钾(KH2PO4)6.8g,加蒸馏水溶解,移至500mL容量瓶并用蒸馏水定容。用浓度为0.1mol·L-1氢氧化钠溶液调节pH值至6.8或者7.4;取胰酶10 g,加适量蒸馏水量溶解,将两液混合均匀,移至1 000mL容量瓶中,用蒸馏水定容至刻度,即得pH 6.8和7.4的人工肠液。
三角瓶里面加入一定体积的SIF,以100 r·min-1的速度震荡并且温度保持在37℃±0.5℃。取20mL肉桂油微乳放入透析袋中,两端用绳子扎紧后放进三角瓶里面。以固定的时间间隔从三角瓶中取样,取样后立刻向三角瓶中加入同体积的相同温度的人工肠液。参照1.3.7的方法对样品进行破乳并稀释,测定肉桂醛含量,计算释放液中肉桂醛含量。空白乳液的释放介质溶液同法处理。累积释放速率用下式计算:
式中:Q为累积释放百分数(%);V0为释放介质溶液总体积(mL);V为取样体积(mL);Ct为在释放时间点测定的释放介质溶液中肉桂醛的浓度(mg·mL-1);C为在前一个释放时间点测定的释放介质溶液中肉桂醛的浓度(mg·mL-1);W为被包封的肉桂醛的总质量(mg)。
1.4 数据分析
数据采用Origin 7.5进行分析。
2 结果与讨论
2.1 微乳配方的筛选
2.1.1 最佳Km值
通过比较伪三元相图微乳区域大小来考察Km值(1∶1,2∶1,3∶1,4∶1,w/w)对微乳液制备的影响(图1)。当Km=1时,只有部分比例可以形成微乳,构成的微乳区域最小。当Km值为2,3和4时,在8∶1~4∶1都可以形成微乳,且微乳面积随着Km值的增加而增大。这有可能是因为助表面活性剂虽然可以降低界面张力,但是当助表面活性剂过量时,也相对地使表面活性剂的量减少了,从而乳化的能力也相应地降低,并且还会使混合膜的强度和稳定性降低,因此不利于微乳的形成[28]。因此确定最佳Km为4。
2.1.2 乳化温度的选择
根据2.1.1的实验结果,固定搅拌速度,考察乳化温度(25℃,40℃,50℃)对肉桂油微乳液制备的影响(图2)。随实验温度的升高,ME先增加后减小。40℃的微乳区域面积最大,为最佳温度。这可能是因为升高温度可以加快分子的运动速度,能够促进水油两相与混合膜的相互作用,从而降低界面表面张力,更有利于形成微乳[29]。但是,当乳化温度为50℃时,微乳制备过程中肉桂油的挥发不利于微乳的形成,因此形成的肉桂油微乳的面积变小。
2.1.3 肉桂油微乳配方的优化
不同种类的表面活性剂的复合使用可以调节其HLB值,并且形成一种更为坚固的复合凝聚膜,从而增加微乳的稳定性[30-31]。因此,选取Span 80或者EL-40分别与Tween 80进行复配,结果如表1。Tween 80/Span 80组合无法形成微乳,而Tween 80/EL-40组合都能够形成澄清透明的体系,且经过4 000r·min-1,20min离心后没有出现相分离。
2.2 肉桂油微乳类型鉴定及理化性质
由2.1得出的最佳微乳制备条件为乳化温度40℃,固定Km=4,所得最佳微乳配方为CO/IPM/Tween 80/EL 40/无水乙醇/丙三醇/水,其中CO/IPM=1∶1(w/w),Tween 80/EL-40=3∶1(w/w),无水乙醇/丙三醇=1∶1(w/w),蒸馏水含量为64.29%,肉桂油的最大含量为3.57%。将所制备的微乳在4 000r·min-1下离心20min,没有出现相分离,初步表明所制备的乳液为微乳。如图3,优化以后的配方制备的乳液平均粒径是14.6nm,多分布指数为0.111,进一步表明形成了微乳。
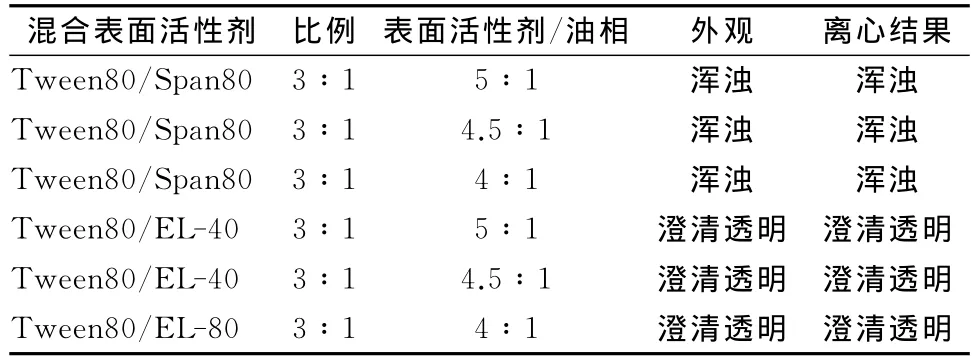
表1 Tween 80与不同种类表面活性剂复配形成的COME
在微乳液中滴加亚甲基蓝和苏丹红染色液,比较扩散速度发现,水溶性亚甲基蓝的扩散速度快,说明制得的样品为O/W型。O/W型、双连续(BC)型和W/O型,这3种微乳可以在形成过程中通过电导率来区分[32]。所制备的微乳液电导率为228μs·cm-1,这是因为COME的连续相是水,电导率相对来说比较高。微乳的折光率(RI)为1.3829,接近水相的折射率,也进一步证明形成了O/W型肉桂油微乳。样品离心后,没有出现沉淀、乳化和相分离的现象,说明样品具有较好的物理稳定性,构建的微乳体系良好。
2.3 肉桂醛标准曲线
在1.3.7节色谱条件下,对肉桂醛对照品溶液和COME供试品溶液进行HPLC检测,结果如图4,肉桂醛保留时间为(16.700±0.200)min,所得线性回归方程为y=162.7x+169,R2=0.998,表明肉桂醛浓度在20μg·mL-1~160μg·mL-1范围内线性良好。经计算,COME中肉桂醛含量为24.05mg·g-1。
2.4 肉桂油微乳的稳定性
2.4.1 离心稳定性
以10 000r·min-1离心30min,微乳外观依然澄清透明,没有出现沉淀、乳化,说明制备的微乳离心稳定性良好。
2.4.2 冷热循环稳定性
将肉桂油微乳在40℃的条件下放置12h,取出后再在4℃温度下放置12h,作为1次加热-冷却循环。肉桂油微乳经过5次加热冷却循环后,没有发生破乳、聚结和相分离,依然保持着良好的稳定性。
2.4.3 贮藏稳定性
将制备的肉桂油装入密闭的容器中,30℃±2℃下放置6个月,期间测定其理化性质、肉桂醛含量并目测微乳形态,结果如图5。0~6个月间,微乳体系pH略有下降,这可能是因为在储藏过程中,微乳体系中的肉桂醛被氧化为肉桂酸,导致pH值变小。微乳体系的电导率呈先增大后减小的趋势,在0~1个月间增加较大,1~6个月间变化较小。在贮藏过程中,微乳体系的折光率变化并不明显。微乳中的肉桂醛含量在贮藏期间只稍微降低,6个月之后,微乳中肉桂醛的保留率高达92.79%。而同等条件下,普通肉桂油的保留率仅有46.52%。实验结果说明,微乳体系可以成功地提高肉桂油的稳定性。
2.5 pH对肉桂油释放速率的影响
从图6可以看出,肉桂油微乳在pH 6.8和pH 7.4的人工肠液中的累计释放率都随着时间而增加。在8h时,肉桂油在pH 6.8的人工肠液中的释放率达到了31.21%,而在pH 7.4中只有18.62%,说明不同的pH值对肉桂油微乳的体外释放行为有影响。从释放总量来看,到8h时,两种介质中的释放总量都不到一半,这说明还有释放的可能,8h后的释放情况还有待进一步研究。
2.6 体外释放动力学模型的建立
绘制累积释放率与时间的关系并用5个经验方程来拟合(图6),分析肉桂油微乳在两种不同释放介质中的释放动力学。在不同的pH条件下,由5个动力学方程分别得到R2(表2,3)。
通过比较R2值表明,在pH 6.8和pH 7.4SIF中,Retger-peppas方程的拟合都优于其他4个动力学方程。这些结果显示Retger-peppas方程适合COME的释放拟合。

表2 COME在pH 6.8人工肠液中的释放动力学模型建立结果

表3 COME在pH 7.4人工肠液中的释放动力学模型建立结果
通过Retger-peppas方程,可以研究肉桂油释放的机理和动力学。方程如下式:Q=k×tn
其中k是系统的动力学常数,n是扩散指数,是分析释放速率机制的重要参数[33]。肉桂油微乳在两种pH的人工肠液中的n值都介于0.45和0.85之间,表明肉桂油的释放属于非Fickian扩散机制,依赖于药物扩散和聚合物松弛的共同作用,药物释放的过程加快,因此高于Fickian释放[33-34]。k值与释放速度动力学有关,k值越高,药物的释放速度越快[35]。
表4总结了肉桂油在pH 6.8和pH 7.4释放的k值和n值。可以看出,在pH 6.8的人工肠液中,释放的k值(8.663 58)大于7.4的人工肠液(3.868 59)。这说明肉桂油微乳在酸性环境中比在碱性环境中释放的更快,这与累计释放百分数Q的结果是一致的。

表4 pH 6.8和pH 7.4人工肠液中COME的扩散指数(n)和扩散常数(k)
3 结论
本研究制备了O/W型肉桂油微乳,确定最佳配方为CO/IPM/Tween 80/EL 40/无水乙醇/丙三醇/水体系,其中 Tween 80/EL-40=3∶1(w/w),无水乙醇/丙三醇=1∶1(w/w),Km=4,最佳制备温度为40℃,肉桂油含量为3.57%,经染色法鉴定为O/W型微乳。结果表明,肉桂油微乳具有良好的离心稳定性,冷热循环稳定性和储藏稳定性,在贮藏6个月以后,肉桂油微乳中肉桂醛的保留率较普通肉桂油提高了1倍,表明将肉桂油制成微乳是解决肉桂油易氧化、易挥发问题的有效方法。
体外释放实验及释放动力学模型拟合方面的的结果表明,肉桂油在pH 6.8人工肠液中的释放速率比pH 7.8人工肠液更快,两种介质中的释放动力学都与Retger-peppas方程拟合度最高,释放机制属于非Fickian释放。全面地考察肉桂油微乳的生物利用度,有待于对肉桂油微乳的肠吸收情况做进一步研究。

