特异性能谱CT评估阿西替尼抗兔VX2肝肿瘤血管生成效果
吕培杰,陈 岩,柴亚如,刘 杰,郭 华,高剑波
(郑州大学第一附属医院放射科,河南 郑州 450052)
相对于灌注CT注射对比剂后可采用多个扫描时间点对病灶行动态监测,能谱CT动脉增强扫描于固定时间点采集[1],易错过病灶峰值强化时间而致漏诊,影响其量化分析的准确性,原因在于根据碘浓度评估肿瘤血供变化受对比剂浓度和动态采集时间的影响[2]。既往文献[3]报道基于肝癌病灶灌注CT时间-强度曲线(time-intensity curve, TIC)可获得CT增强最佳动脉采集时间,但针对该时间条件下碘浓度值与灌注参数间的相关性是否最佳,以及碘浓度对肿瘤血供变化的评估能力是否与灌注参数相当尚无定论。本研究探讨特异性能谱CT增强扫描评估阿西替尼抗兔VX2肝肿瘤血管生成疗效的价值。
1 材料与方法
1.1 实验动物 雄性新西兰大白兔由河南省动物实验中心提供[动物许可证编号SCXK(豫)2015-0005],3~4月龄,平均体质量2.8 kg。
1.2 制作动物模型及分组 采用速眠新Ⅱ(0.2 ml/kg体质量) 麻醉动物,在CT引导下通过经皮穿刺将VX2瘤块置于肝脏左叶内,制成肝肿瘤模型[4]。2周后40只荷瘤兔(肿瘤直径为10~25 mm)纳入研究。
将荷瘤兔随机分为2组。对实验组(n=25)采用胃管灌食法予血管内皮生长因子受体(vascular endothelial growth factor receptor, VEGFR)抑制剂阿西替尼(12 mg/kg体质量,2次/天)[4];对照组(n=15)予等量生理盐水,干预时间均为14天。
1.3 仪器与方法 采用GE Discovery CT590机(引导穿刺)和GE Discovery CT宝石能谱机(CT扫描),先以100 kVp管电压及自动管电流模式行腹部平扫,确定全肿瘤和门静脉扫描范围,而后对实验组采用方案1,对照组依次采用方案2和3进行扫描。
方案1为一站式灌注联合能谱CT扫描,管电压80、140 kVp,电流260 mA,螺距1.375,转速0.6 r/s,于注药同时开始扫描,每2 s扫描1次,共采集25次,全程50 s;容积CT剂量指数(volume CT dose index, CTDIvol)为222.75 mGy,剂量长度乘积(dose length product, DLP)为891.00 mGy·cm。
方案2为能谱CT增强扫描,管电压、电流、螺距和转速同方案1,以基于方案1的时间密度曲线值所获最佳肝肿瘤采集时间进行扫描;CTDIvol为13.83 mGy,DLP为183.21 mGy·cm。
方案3为常规灌注CT,于方案2结束后10 min后开始扫描[3],管电压100 kVp,有效电流150 mAs,其余灌注参数同方案1;CTDIvol为76.54 mGy,DLP为306.16 mGy·cm。
所有方案对比剂均采用碘佛醇(320 mgI/ml),剂量5 ml,流率0.5 ml/s,通过耳缘静脉注射,随后采用相同流率注射10 ml生理盐水冲洗。
所有图像重组层厚、层间距均为1.25 mm,自适应统计迭代重建技术(adaptive statistical iterative reconstruction, ASIR)比例为40%。重建方案1各时相常规140 kVp图像、70 keV图像和碘基(水对)图,方案2的70 keV图像和碘基(水对)图以及方案3各采集时相100 kVp图像。
1.4 图像分析 采用GE HealthCare AW 4.6工作站进行图像分析和相关数据测量。
1.4.1 灌注图像分析 采用Perfusion 4D软件去卷积算法进行分析,以腹主动脉和门静脉主干或分支作为供血动脉和引流静脉。将ROI分别置于常规140 kVp图像全肿瘤和周围正常肝实质,面积分别约为102~458 m2、300~400 m2,获得25个循环采集的TIC,记录肝肿瘤与肝实质CT值,计算比值最大时的采集时间[3]并以之为肝肿瘤最佳采集时间(图1)。测量全肿瘤血流量(blood flow, BF)、血容量(blood volume, BV)、肝动脉分数(hepatic arterial fraction, HAF)、平均通过时间(mean transit time, MTT)和表面通透性(permeability surface, PS),见图2。

图1 ROI时间密度曲线图 A.实验组兔140 kVp图像,于肝肿瘤和周围正常肝实质放置ROI示意图; B.基于实验组兔一站式灌注联合能谱CT扫描中灌注数据的平均TIC图

图2 一站式灌注联合能谱CT扫描图像 A~F依次为BF、BV、HAF、MTT、PS和动脉期能谱增强碘基图
1.4.2 能谱图像分析 测量最佳采集时间条件下碘基图上全肿瘤碘浓度(iodine concentration, IC),计算肿瘤相对同层主动脉的标准化碘浓度值(normalized iodine concentration, NIC),使测量区域和位置与同组灌注图像相匹配。
1.5 VEGFR-2表达检测 完成CT检查后处死动物,取出肝肿瘤组织进行包埋固定,采用免疫组织化学染色法测定VEGFR-2表达,将胞质呈棕黄色或黄褐色判定为VEGFR-2表达阳性。于放大40倍视野中任意选取3个阳性细胞分布较高密度区域作为“热点(hot spot)”,于放大400倍视野下计算阳性细胞数占比并分为4级:1级<25%,2级25%~50%,3级51%~75%,4级>75%[5];取平均值作为最终结果。
1.6 统计学分析 采用SPSS 17.0统计分析软件。对实验组分别采用PearsonR分析每个采集时间兔肝肿瘤灌注参数与NIC的相关性,以Spearman分析观察干预结束时灌注参数及NIC与VEGFR-2的相关性,采用cocor R软件包(1.1-0版本)比较相关系数间的差异[6-7]。以Mann-WhitneyU检验比较干预结束时实验组和对照组间灌注参数、NIC及VEGFR-2之间的差异。P<0.05为差异有统计学意义。
2 结果
2.1 选择与验证实验组肝肿瘤能谱增强最佳时间 开始注射对比剂后,基于实验组灌注数据TIC获得的兔肝肿瘤达峰时间为14~22 s,平均(20±6)s;肝肿瘤与肝实质比值最大时间为14~24 s,平均(18±4)s。对照组以上述时间行能谱动脉期增强扫描,其中73.33%(11/15)荷瘤兔达到肝肿瘤最大对比度,且兔肝肿瘤能谱增强最大CT值[(94±12)HU]占肝灌注最大CT值[(118±18)HU]的比例均大于80%。
2.2 实验组各采集时间灌注参数与NIC的相关性 实验组25个灌注CT采集时间中,MTT、PS与NIC相关性差异无统计学意义;BF、BV及HAF与NIC均呈正相关,且相关系数随时间增加均呈先增大后减小趋势,3个参数最大相关系数所在时间分别为16~26 s[(19±4)s]、24~38 s[(32±6)s]及18~28 s[(22±3)s],平均采集时间(25±7)s。BV与NIC间最大相关系数大于对比度最大时所获得的相关系数,其余差异均无统计学意义。见表1。

表1 实验组各灌注参数、NIC及相关性 (n=25)
2.3 灌注参数及NIC与VEGFR-2的相关性 免疫组织化学染色结果显示,VEGFR-2阳性表达主要位于肿瘤细胞质或细胞膜内,呈簇状分布或大片状分布的棕黄色颗粒,在瘤周及其血管周围密集分布。对照组VEGFR-2阳性表达级别(3.63±0.52)明显高于实验组(1.25±0.46)(Z=3.965,P=0.001),见图3。干预14天结束时,实验组BF及NIC均低于对照组,而PS高于对照组(P均<0.05),见表2。实验组BF(r=0.828、P=0.008)及NIC(r=0.820、P=0.010)与VEGFR-2呈正相关,PS与VEGFR-2呈负相关(r=-0.782、P=0.010),BV、HAF、MTT与VEGFR-2无明显相关(P均>0.05)。

图3 肿瘤组织VEGFR-2免疫组织化学染色图片(×400) A.实验组; B.对照组
表2 实验组和对照组灌注参数及NIC比较(±s)
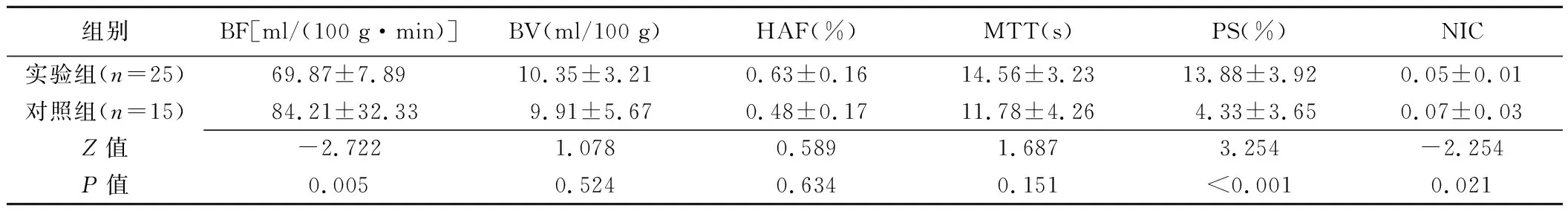
表2 实验组和对照组灌注参数及NIC比较(±s)
组别BF[ml/(100 g·min)]BV(ml/100 g)HAF(%)MTT(s)PS(%)NIC实验组(n=25)69.87±7.8910.35±3.210.63±0.1614.56±3.2313.88±3.920.05±0.01对照组(n=15)84.21±32.339.91±5.670.48±0.1711.78±4.264.33±3.650.07±0.03Z值-2.7221.0780.5891.6873.254-2.254P值0.0050.5240.6340.151<0.0010.021
3 讨论
3.1 肿瘤特异性和个体特异性能谱CT增强扫描的价值 本研究实验组采用一站式灌注联合能谱扫描方案,基于灌注的TIC及肝肿瘤与肝实质的最大比值来确定肝肿瘤最佳动脉采集时间,经对照组灌注CT扫描验证,能谱动脉增强扫描时可于73.33%荷瘤兔显示肿瘤最佳,与GORDIC等[3]采用常规灌注CT获得双能CT验证的效果(70%)相当;而本研究能谱碘含量与灌注参数均来源于同一次扫描[8-10]而非GORDIC等[3]所采用的2次扫描,有利于减少个体差异,更准确地反映能谱与灌注参数间的相关性。
本研究结果显示最佳肿瘤对比度时间条件下灌注参数BF、BV及HAF与肝肿瘤动脉期NIC均呈显著正相关,与既往研究[11-12]结果相符;且各相关系数与所有采集时间中的最大相关系数相当,表明除BV外,该时间条件可以充分反映灌注参数与NIC间的相关性。这是由于BV与NIC间相关系数最大的采集时间为32 s,明显大于肿瘤最佳采集时间(18 s),更偏向于潜在的静脉期采集时间,与MULÉ等[12]关于静脉期碘浓度与BV的相关系数大于动脉期碘浓度与BV的相关系数的研究结果相符。
3.2 特异性能谱CT碘含量和灌注参数对抗肿瘤效果的评估能力比较 阿西替尼是一种小分子酪氨酸激酶抑制剂,通过靶向拮抗VEGFR-1、2、3抑制肿瘤新生血管生成。VEGFR-2是参与肝癌血管生成的主要受体[13]。本研究以VEGFR-2作为评价阿西替尼治疗兔VX2肝肿瘤效果的指标,所制备转移性肝癌兔模型的肝动脉供血和生物学侵袭特性与人肝癌类似[14];实验组BF、PS、NIC均与VEGFR-2相关,提示灌注参数及NIC均可反映肿瘤血供变化,与既往研究[2,12]结果一致。本研究采用靶向药物针对性受体VEGFR-2,而非泛用的微血管密度作为血供变化分析评价指标,发现灌注参数和NIC与VEGFR-2间相关系数无明显差异,提示二者评估肿瘤血供变化能力相当,但NIC评估肿瘤血供更为简捷、辐射剂量更低,有利于临床推广。
本研究的局限性:①动物模型仅代表富血供侵袭性转移性肝癌;②所获结果仅适用于能谱CT机,而非所有双能CT机;③未对荷瘤兔终点生存时间进行评估;④受扫描时间限制,未对静脉期NIC进行评估。
综上所述,基于肿瘤特异性和个体特异性的能谱CT单期动脉期增强扫描可用于评估兔VX2肝肿瘤抗血管生成疗效,且评估能力与灌注参数相当,具有替代灌注参数评估肿瘤血供变化的潜能。

