改进型胶原诱导的小鼠关节炎动物模型的建立
刘家望,王宏伟,许江城,佘锐萍
(1.中国农业大学动物医学院,北京海淀100193 ; 2.北京韩美药品有限公司,北京顺义101312)
胶原诱导的关节炎(Collagen-induced arthritis, CIA)动物模型首先由Trentham等[1]于1977年在大鼠、随后由Courtenay等[2]于1980年在小鼠中成功建立。该模型通过Ⅱ型胶原(Type II collagen, CII)免疫诱导动物产生自身免疫性关节炎。CIA的产生和发展依赖于自身T淋巴细胞和B淋巴细胞的激活[3]。CIA模型与人类风湿关节炎(Rheumatoid arthritis, RA)表现相似,是研究RA的较理想模型。但是该模型也有一些缺点,主要为造模时间长,发病率偏低,发病严重程度较低,动物个体间发病时间和炎症严重程度差异较大等[4-5]。
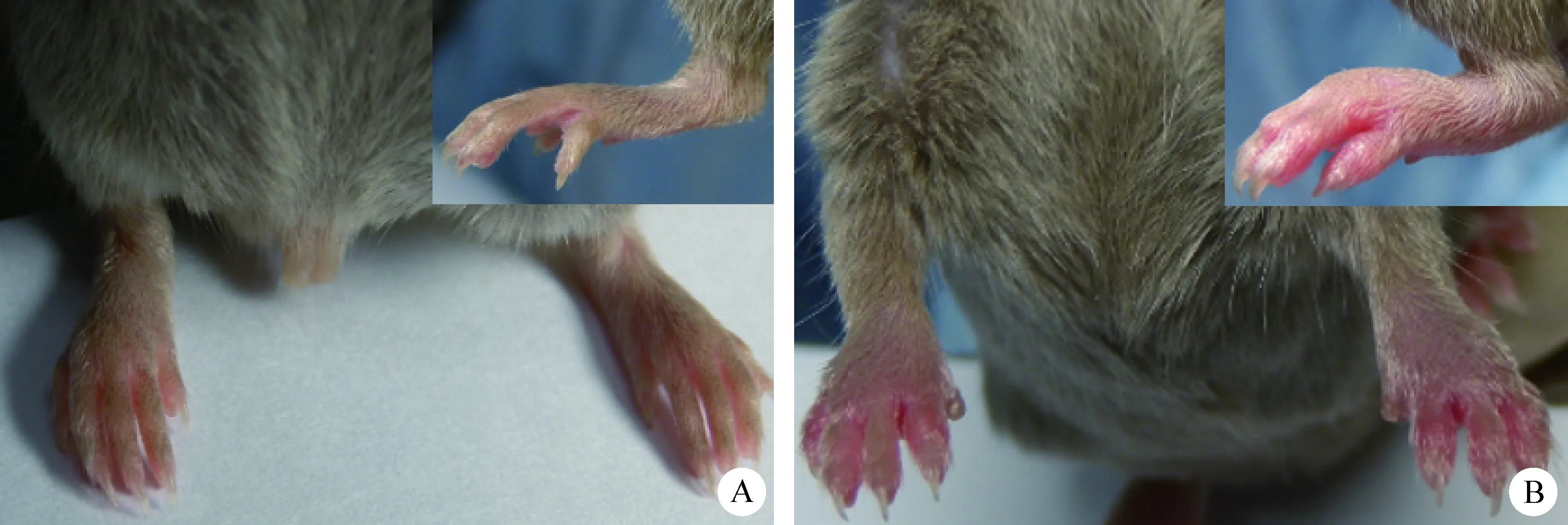
图5 抗CII/CD3双抗处理后小鼠足爪病变
Fig.5 Paw change of the mice after anti-CII/CD3 bispecific antibody treatment
A:正常小鼠; B:抗CII/CD3双抗处理后小鼠
A: Normal mice; B: Anti-CII/CD3 bispecific antibody-treated mice
双特异抗体是近年来肿瘤治疗领域的热点之一,它能同时与肿瘤细胞上的肿瘤相关抗原和免疫细胞表面分子(如T淋巴细胞上的CD3分子)结合,从而将T淋巴细胞募集到肿瘤细胞表面,然后通过靶细胞结合依赖的方式导致静息T淋巴细胞活化、增殖,并且释放促炎性细胞因子,从而更有效地杀伤肿瘤细胞[6-8]。
受此启发,本试验探索采用能同时与关节软骨上的CII分子和T淋巴细胞上的CD3分子结合的抗CII/CD3双特异抗体联合胶原免疫,建立一个发病迅速、发病率高、炎症严重程度较高且动物个体差异小的改进型RA实验动物模型,为RA的发病机制研究和开发新的诊断、治疗方法奠定基础。
1 材料与方法
1. 1 实验动物 DBA/1小鼠,雄性,8周龄, SPF(Specific pathogen free,无特定病原体)级,购自北京维通利华实验动物技术有限公司,饲养在北京韩美药品有限公司动物房屏障环境内[许可证号: SYXK(京) 2015-0013]。
1. 2 仪器和试剂 仪器: 离心机MULTIFUGE X3R (Thermo Fisher),蛋白纯化系统AKTA purifier 100(GE)。试剂: 牛CⅡ,小鼠CII和抗CII单抗(Chondrex)。抗小鼠CD3单抗(克隆145-2C11)由本实验室通过真核表达系统重组表达制备。Traut’s试剂和Sulfo-SMCC(Sigma)。完全弗氏佐剂和不完全弗氏佐剂(Sigma)。重组小鼠CD3-His蛋白(北京义翘神州)。辣根过氧化物酶(Horseradish peroxidase, HRP)标记兔抗6×His标签抗体和HRP标记羊抗小鼠IgG抗体(Abcam)。
1. 3 抗CII/CD3双抗制备[9-10]取20 mg抗小鼠CD3单抗与Traut’s试剂以摩尔比1∶10混合,然后在室温条件下反应1 h。另外取20 mg抗CII单抗与Sulfo-SMCC以摩尔比1∶10混合,然后同样在室温下反应1 h。将反应完后的抗小鼠CD3单抗和抗CII单抗分别浓缩换液后1∶1混合,在4 ℃条件下缓慢混合过夜反应。然后通过分子筛柱Sephadex 200纯化反应产物得到抗CII/CD3双抗。纯化得到的抗CII/CD3双抗经非还原NuPAGE 4-12% Bis-Tris胶进行鉴定和纯度分析。
1. 4 酶联免疫吸附试验(Enzyme-linked immunosorbent assay, ELISA)检测抗CII/CD3双抗与靶分子的结合活性 分别包被小鼠CD3和小鼠CII于ELISA板上,4 ℃孵育过夜。然后用含1%牛血清白蛋白(Bovine serum albumin, BSA)的含0.05%吐温的磷酸盐缓冲液(Phosphate buffered saline with 0.05% TWEEN 20, PBST)封闭,25 ℃孵育1 h。PBST洗涤5次后加入系列稀释在含1% BSA的PBST溶液里的双抗样品以及对照单抗样品,25 ℃孵育1 h。洗涤后加入HRP标记的羊抗小鼠IgG抗体,25 ℃孵育1 h。然后加入底物四甲基联苯胺(Tetramethylbenzidine, TMB)溶液,室温显色10 min。最后加入1 mol/L H2SO4终止显色,并在酶标仪上读取450 nm处的吸光度。另外,包被小鼠CII于ELISA板上,封闭后加入双抗样品以及对照单抗样品,然后再加入小鼠CD3-His, 最后加入HRP标记兔抗6×His标签抗体,并加入底物TMB溶液显色和读取OD450值。
1. 5 改进型CIA模型制备及临床观察 将等体积牛CII溶液和完全弗氏佐剂或不完全弗氏佐剂充分乳化后获得胶原乳剂,然后于第0天注射0.01 mL包含70 μg牛CII和完全弗氏佐剂的乳剂到小鼠尾根部皮内,3周以后注射包含70 μg牛CII和不完全弗氏佐剂的乳剂到小鼠尾部皮内,错开第1次注射位置,从而制备常规CIA模型。在改进型模型制备中,首先在第0天注射包含牛CII和完全弗氏佐剂的乳剂,然后于第21天分别腹腔注射抗CII单抗,抗小鼠CD3单抗,抗CII单抗+抗小鼠CD3单抗,或抗CII/CD3双抗。单抗剂量为30 μg/只,双抗为60 μg/只。每组10只小鼠。每隔2天检查小鼠发病情况、进行关节炎指数评分,并且每4天称重并记录小鼠体重。关节炎指数评分标准如下:0分:正常,无皮肤发红和肿胀;1分:轻度踝关节或部分脚趾红肿;2分:踝关节到跗骨轻度红肿;3分:踝关节到跖骨中度红肿;4分:整个踝关节、足部和全部脚趾严重红肿或关节强直、畸形。小鼠四肢分别观察评分,然后将各肢体得分相加即为该小鼠关节炎总评分。
1. 6 数据统计分析 数据以平均值±标准差表示,使用Graphpad Prism软件进行单因素方差分析(One way ANOVA),比较各组间差异,当P<0.05时认为差异有统计学意义。
2 结果
2. 1 抗CII/CD3双抗制备 先分别将抗小鼠CD3单抗与Traut’s试剂、抗CII单抗与Sulfo-SMCC反应,然后将这2个反应产物混合一起进行反应,最后用分子筛凝胶色谱柱纯化得到抗CII/CD3双抗。通过SDS-PAGE检测发现,最终反应产物在分子量约300 kDa处出现一条条带,与预期二聚体形式双抗分子相符。通过分子筛柱纯化去除未反应的修饰抗体和多聚体后,可获得纯度较高的抗CII/CD3双抗(图1)。
2. 2 抗CII/CD3双抗分别与CII和CD3的结合 ELISA试验结果表明,抗CII/CD3双抗能够有效地与CII结合,结合能力与抗CII单抗相比稍有降低(图2A)。同时,抗CII/CD3双抗能够有效地与小鼠CD3结合,结合能力与抗小鼠CD3单抗相当(图2B)。
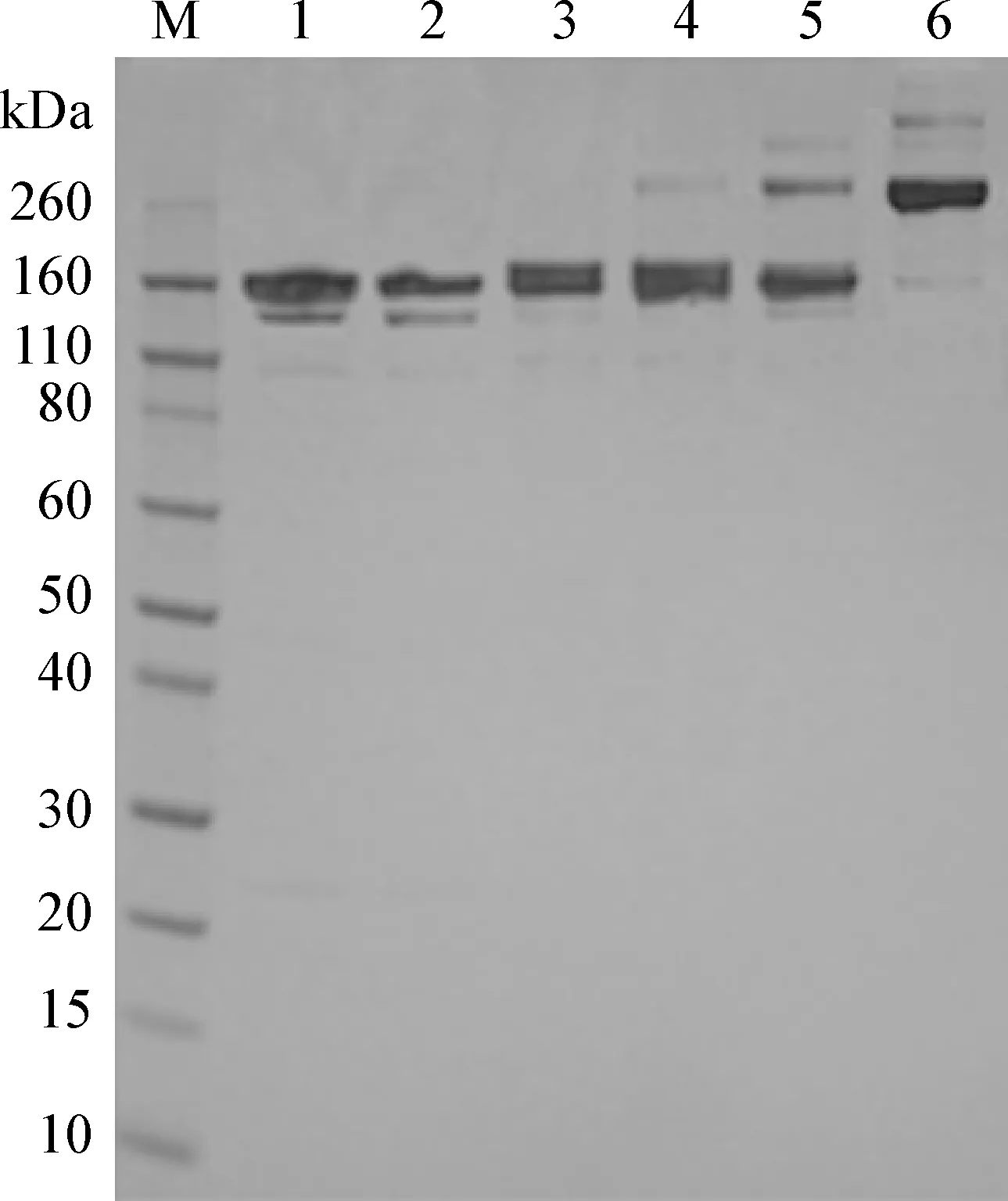
图1 抗CII/CD3双抗的制备和鉴定
Fig.1 Preparation and identification of theanti-CII/CD3 bispecific antibodyM:分子量标准; 1:抗CD3单抗; 2:抗CD3单抗-Traut’s; 3:抗CII单抗; 4:抗CII单抗-Sulfo-SMCC; 5:抗CII/CD3 双抗-纯化前; 6:抗CII/CD3双抗-纯化后
M: Molecular weight markers; 1: Anti-CD3 monoclonal antibody; 2: Anti-CD3 monoclonal antibody-Traut’s; 3: Anti-CII monoclonal antibody; 4: Anti-CII monoclonal antibody-Sulfo-SMCC; 5: Anti-CII/CD3 bispecific antibody-before purification; 6: Anti-CII/CD3 bispecific antibody-after purification
由于一分子抗CII/CD3双抗含两分子单克隆抗体,所以在用羊抗小鼠IgG二抗检测时其信号较抗CII单抗和抗CD3单抗高。
2. 3 抗CII/CD3双抗同时与CII和CD3的结合 先用小鼠CII包被ELISA板,孵育后加入抗CII/CD3双抗样品,然后再加入小鼠CD3-His, 最后加入兔抗6×His标签抗体检测,结果发现,只有抗CII/CD3双抗能同时与CII和CD3结合,而抗CII单抗、抗CD3单抗和抗CII单抗+抗CD3单抗均不能同时结合2个靶分子(见图3)。
2. 4 抗CII/CD3双抗处理后小鼠体重变化 用常规方法进行CIA造模后,小鼠体重从初次胶原免疫后33 d左右开始下降,45 d左右下降到最低,此时与正常小鼠相比体重明显降低,然后体重逐渐略有恢复。而在抗CD3单抗,抗CII单抗+抗CD3单抗和抗CII/CD3双抗处理后小鼠体重即迅速下降,29 d 左右下降到最低程度,此时体重与正常小鼠和常规CIA小鼠相比均显著降低(P<0.001),然后体重稍有恢复。在61 d时抗CII/CD3双抗处理组小鼠体重与常规CIA对照组小鼠相比无显著性差异(P>0.05)(见图4)。
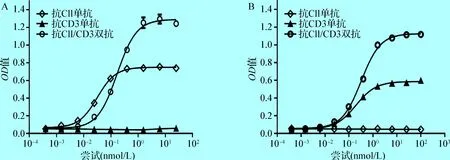
图2 抗CII/CD3双抗与CII和CD3的结合
Fig.2 Binding of anti-CII/CD3 bispecific antibody to CII and CD3A:抗CII/CD3双抗与CII的结合;B:抗CII/CD3双抗与CD3的结合 A:Binding of anti-CII/CD3 bispecific antibody to CII; B:Binding of anti-CII/CD3 bispecific antibody to CD3
2. 5 抗CII/CD3双抗处理后小鼠发病情况及关节炎指数评分 本试验发现常规方法CIA造模小鼠平均发病时间为(33.3±2.4) d,而经抗CII单抗、抗CD3单抗、抗CII单抗+抗CD3单抗和抗CII/CD3双抗处理后小鼠关节炎发病时间分别为(33.3±2.0) d、(29.8±1.0) d、(29.4±0.8) d和(25.4±0.8) d。因此相比常规CIA,抗CII/CD3双抗能导致关节炎发病时间明显提前。本试验还发现常规方法CIA造模小鼠发病率为70%,抗CII单抗处理组发病率为80%,而经抗CD3单抗、抗CII单抗+抗CD3单抗和抗CII/CD3双抗处理后小鼠关节炎发病率均为100%。另外,抗CII/CD3双抗处理后关节炎发病程度较重(见中插彩版图5),关节炎指数评分可以达到并稳定在10分左右的水平,不仅明显高于常规CIA小鼠和抗CII单抗处理组小鼠,也高于抗CD3单抗以及抗CII单抗+抗CD3单抗处理组的小鼠。并且,抗CII/CD3双抗处理组小鼠个体间评分差异较小(见图6)。
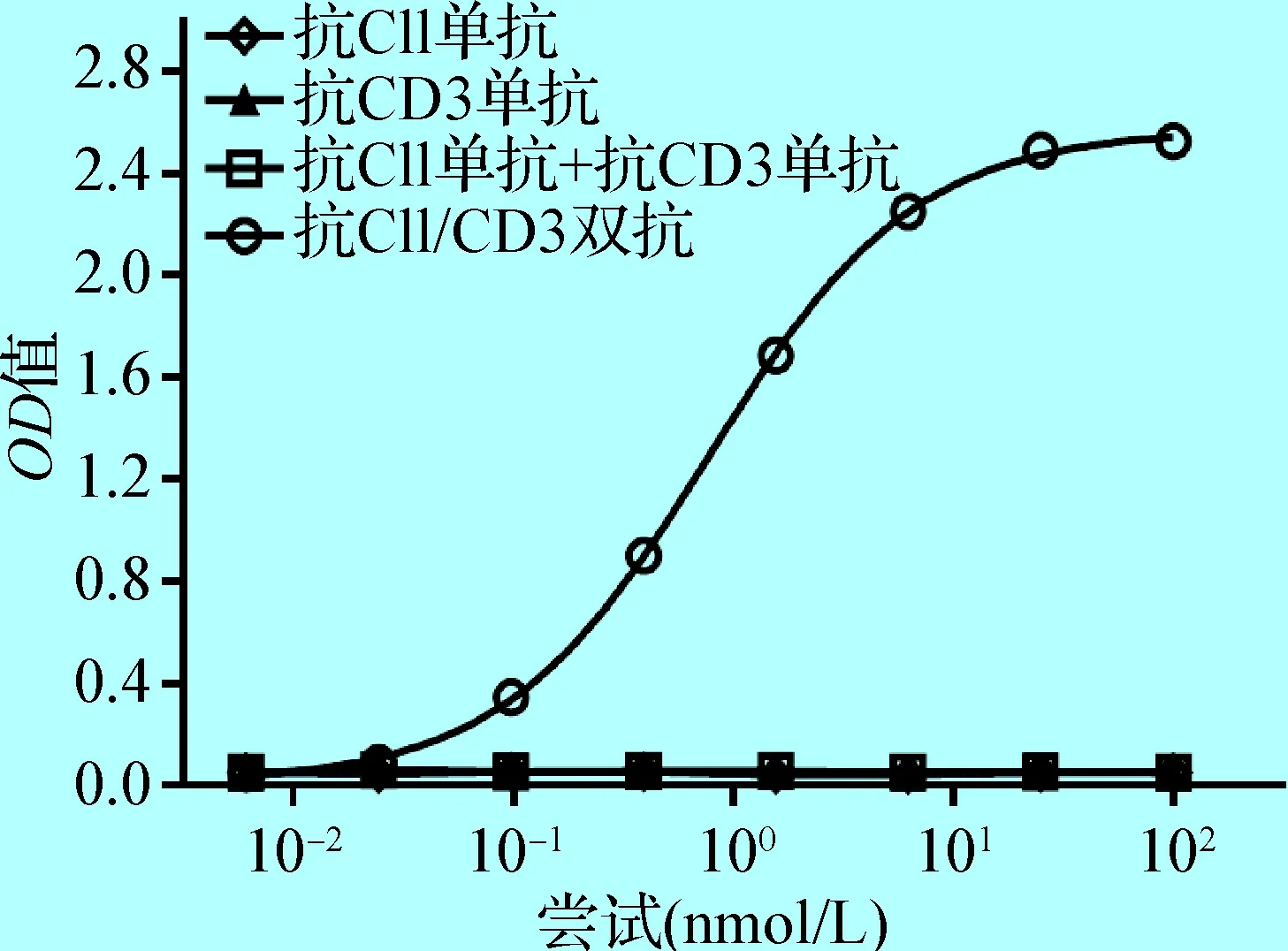
图3 抗CII/CD3双抗与CII和CD3的同时结合
Fig.3 Simultaneous binding of anti-CII/CD3bispecific antibody to both CII and CD3
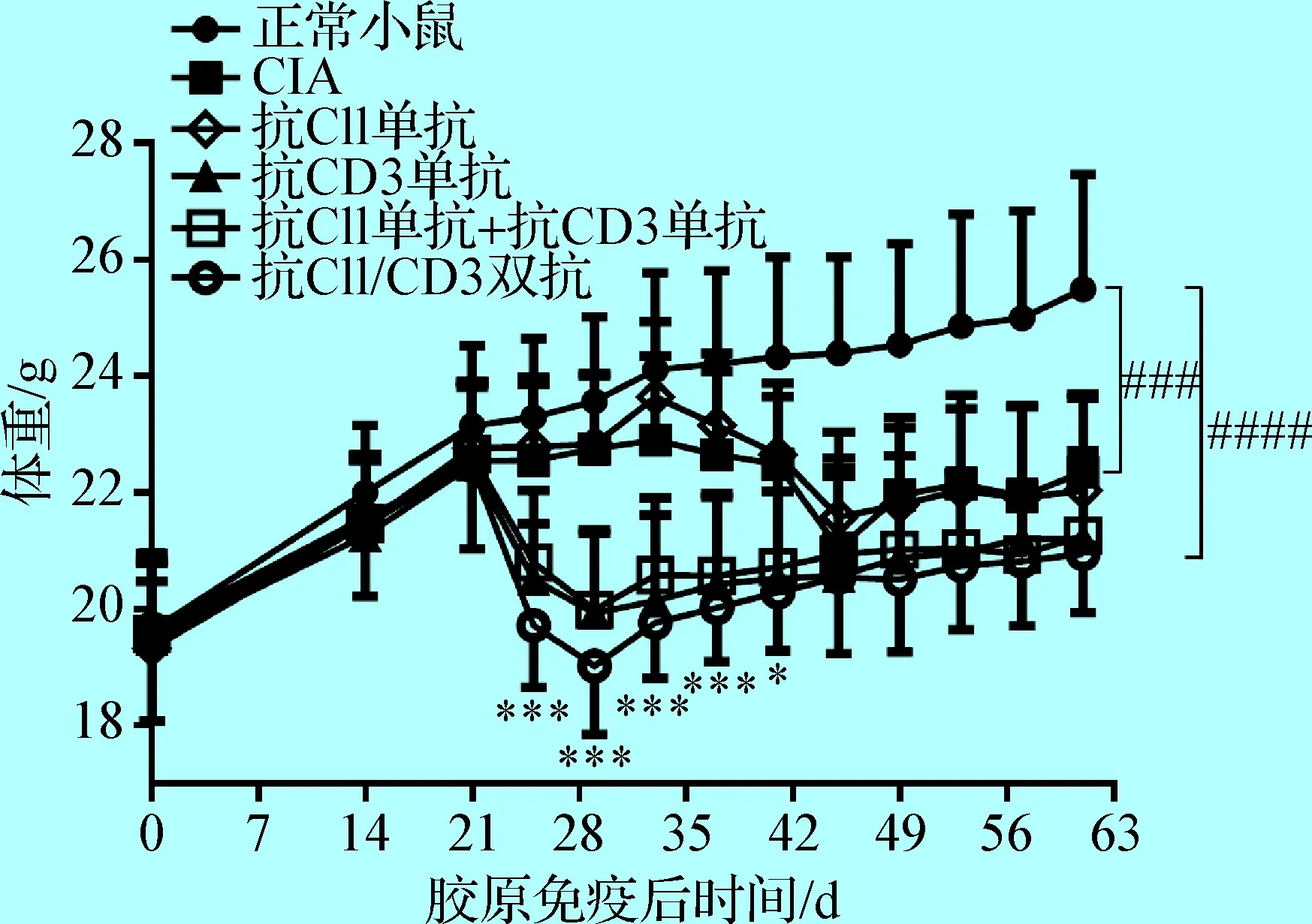
图4 抗CII/CD3双抗处理后小鼠体重变化
Fig.4 Body weight change of the mice afteranti-CII/CD3 bispecific antibody treatment与CIA模型组比较,*:P<0.05,***:P<0.001; 与正常小鼠比较,###:P<0.001,####:P<0.000 1 Compared to CIA control mice, *:P<0.05, ***:P<0.001; Compared to normal mice,###:P<0.001,####:P<0.000 1
3 讨论
动物疾病模型是研究人类疾病的一种十分重要的手段。类风湿关节炎动物模型对于研究该病的病因、发病机制、疾病发生和发展规律、开发新的诊断和治疗方法以及新药研发均具有十分重要的意义。
CIA模型是研究RA的较理想模型,但是该模型也有一些缺点。其主要缺点:一是造模时间长,胶原免疫后约需要1个月才开始发病,这就导致整个实验周期较长、新药研发效率较低;二是发病率偏低,在本实验室SPF设施中饲养的小鼠经诱导后发病率经常只有70%左右;三是发病严重程度较低,有时候会导致治疗组与模型对照组病变程度差距过小,难以判断药物的疗效;四是动物个体间发病时间不一致,个体间疾病严重程度差异大,不同试验间数据差异大等,这也为准确评价和判定抗类风湿关节炎药物的疗效带来了较大的困难。因此,这些缺点大大限制了CIA模型的更广泛应用。
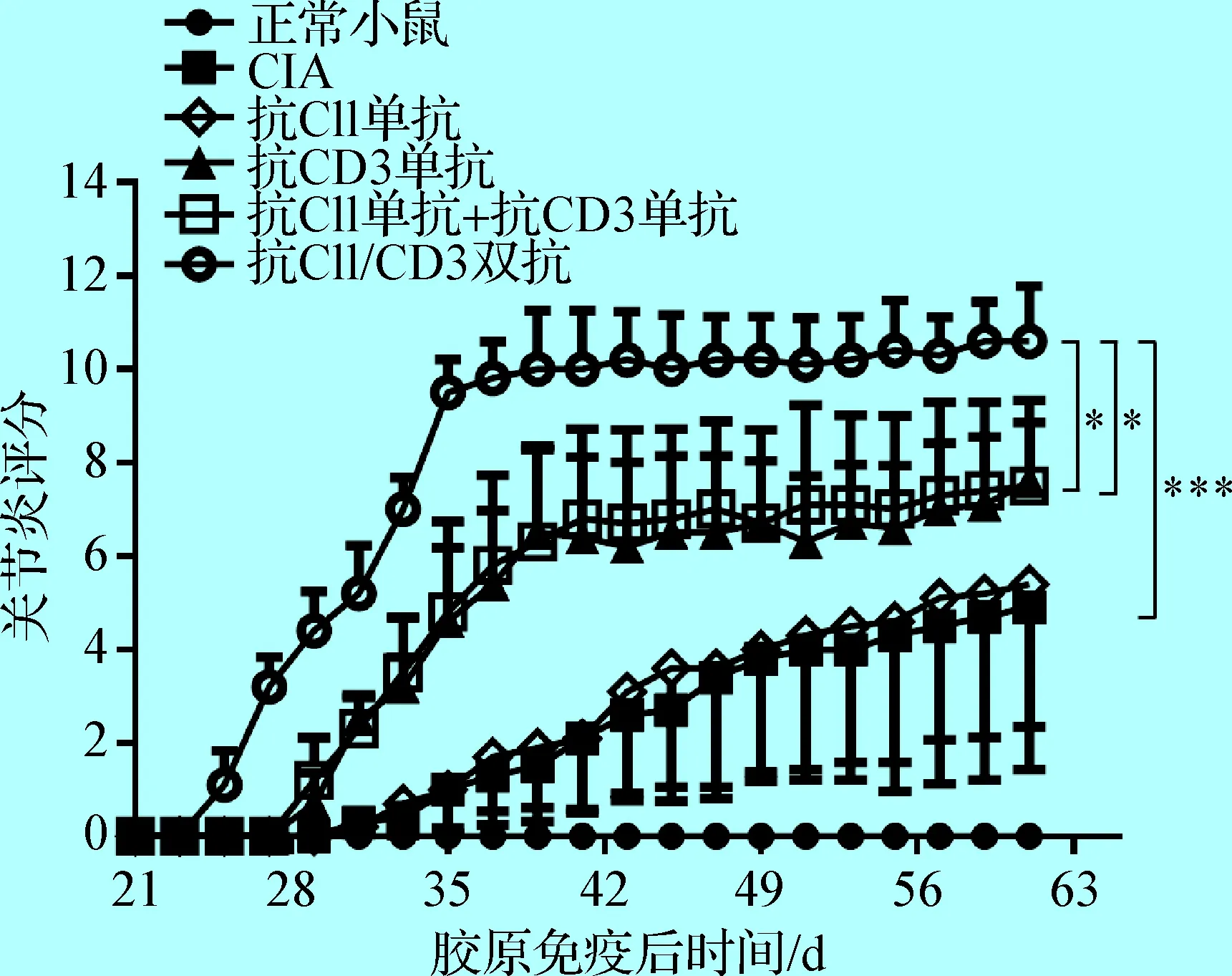
图6 抗CII/CD3双抗处理后小鼠关节炎评分变化
Fig.6 Change of arthritis score of the mice afteranti-CII/CD3 bispecific antibody treatment与抗CD3单抗组和抗CII单抗+抗CD3单抗组比较, *:P<0.05;与CIA模型组比较,***:P<0.001 Compared to the mice treated by anti-CD3 monoclonal antibody and by anti-CII monoclonal antibody + anti-CD3 monoclonal antibody, *:P<0.05; Compared to CIA control mice, ***:P<0.001
目前,抗肿瘤抗原/CD3双抗在肿瘤治疗领域已经得到了较广泛的应用,并显示出了优异的抗肿瘤治疗效果和良好的应用前景[11-12]。但将基于抗CD3的双抗用于关节炎的诱导研究国内外还未见报道。
本试验中我们采用化学连接方法将抗 CII单抗和抗小鼠CD3单抗交联而成功制备了抗CII/CD3双抗。该双抗较好地保持了和CII以及小鼠CD3靶分子的结合能力,更重要的是该双抗能同时有效地结合CII和CD3分子,从而可能将表达CD3分子的T淋巴细胞聚集到表达CII的小鼠关节部位,并通过CII结合依赖的方式导致静息T淋巴细胞活化、增殖,并且在关节局部释放大量促炎性细胞因子如IFN-γ,TNF-α,IL-2,IL-6等[6,13],从而可能能迅速启动并增强小鼠CIA的发生和发展。
常规CIA模型制备一般采用2次CII免疫,但也有文献报道加强免疫不是必需的,CII免疫1次即可成功制备CIA[3]。本实验室前期试验也发现,经单次CII免疫后给予PBS溶媒的小鼠其关节炎发病时间、发病率和关节炎评分变化趋势等与常规CIA小鼠没有明显区别。而本试验发现,在单次CII免疫
的基础上,给予抗CII/CD3双抗后4 d(即CII免疫后25 d)左右小鼠即开始发病,发病率达到100%,然后随时间延长疾病严重程度迅速增加,并在5周左右疾病评分达到最大值,而且该关节炎症状能持续维持3周以上,并且小鼠个体间疾病严重程度差异较小。因此,通过这种方法建立的改进型关节炎模型相对于常规CIA模型具有明显优势。但本试验也发现,如果不经过胶原诱导,单纯给予抗CII/CD3双抗并不能在DBA/1小鼠中诱导出关节炎。这说明抗CII/CD3双抗只能在小鼠体内存在一定程度的抗CII免疫反应的基础上才能迅速启动和增强关节炎的发生。
综上所述,本试验发现通过抗CII/CD3双抗联合胶原免疫可以成功建立一个发病时间短、发病率高、疾病严重程度高、动物个体间疾病严重程度较均一的改进型小鼠关节炎实验动物模型,该模型的成功建立可以更好地为RA的发病机制研究、新的诊断和治疗方法的开发,特别是抗类风湿关节炎药物的筛选和评价服务。

