河北省部分地区屠宰猪肝脏戊型肝炎抗原的检测及组织病理学观察
李睿文,白 云,徐瑞涛,白雪峰
(1.河北农业大学动物医学院,河北保定071000 ; 2.河北省丰宁满族自治县农牧局大阁区域站,河北丰宁068350)
戊型肝炎(Hepatitis E,HE)是由戊型肝炎病毒(Hepatitis E virus,HEV)感染引起的急性病毒性疾病,主要通过粪-口途径传播。戊型肝炎病毒,为肝炎病毒属肝炎病毒科(Genus Hepevirus in the family Hepeviridae),并且是本科中唯一成员[1]。世界上首次记载的戊型肝炎,于1955年12月-1956 年1月暴发流行于印度新德里,暴发的原因由于饮用水被粪便污染而引起的,共计发病97 000例,其中29 000例为黄疸型肝炎[2]。迄今为止,戊型肝炎在全世界范围内均有发病报道,其暴发或流行主要集中在亚洲、非洲的一些发展中国家,特别在一些贫穷落后、卫生习惯较差的地区。
图1 屠宰猪肝脏HEV阳性染色结果(免疫组化,40×)
Fig.1 HEV positive staining of slaughtered pig liver(Immunohistochemistry, 40×)
白色箭头:阳性信号 White arrow: Positive signal
图2 屠宰猪肝脏HEV阴性染色结果(免疫组化,20×)
Fig.2 HEV negative staining of
slaughtered pig liver(Immunohistochemistry, 20×)
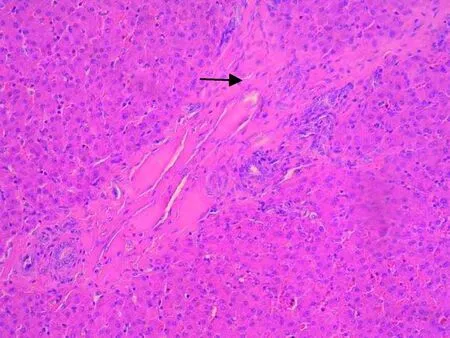
图3 屠宰猪HEV阳性肝脏病理变化(H.E.染色,20×)
Fig.3 Pathological changes of HEV positive liver inslaughtered pigs(H.E. staining, 20 ×)
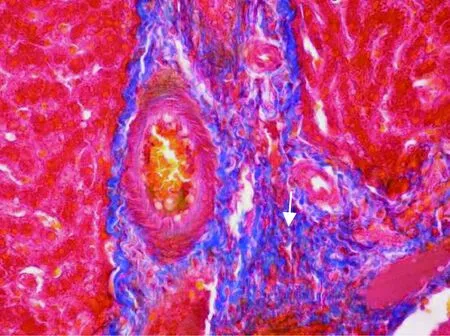
图4 屠宰猪HEV阳性肝脏病理变化(Mallory三色染色,40×)
Fig.4 Pathological changes of HEV positive liver inslaughtered pigs(Mallory staining, 40 ×)
在美国、加拿大、英国、法国、荷兰、德国、意大利及日本、韩国等国家均有戊型肝炎散发病例的报道[3-4]。过去认为主要疫源地为亚非拉等发展中国家,在欧美等发达国家仅有散发病例,主要是由于患者到疫源地旅行感染所致,但有证据表明,在发达国家中也存在没有到过HE疫源地而自发的病例,而且呈逐年递增趋势。
自1997年Meng等发现猪HEV以后,很多研究资料已证实猪是HEV重要的天然动物宿主,而且在HE的传播过程中起着重要的媒介作用[5]。现已证实HEV可在人、猪间进行种间传播。很多国家如日本、韩国、中国、蒙古、阿根廷、加拿大、英国、法国、荷兰、印度尼西亚、意大利、丹麦等均有猪感染HEV的报道,广泛存在HEV自然感染现象,且呈全球性分布。我国为戊型肝炎高流行区,猪群中HEV抗体阳性率较高,而且不断有HEV毒株被鉴定[6]。
我国是传统养猪大国,但养殖规模较小,散养户居多,因此猪养殖环境不易控制。再者,猪肉是我国汉族大多数人比较喜欢的动物性食品之一。因此,猪的健康状况如何直接关系到人类的食品安全,同时猪HEV的感染可能通过猪肉制品传播给人类。因此应加强对猪群中 HEV流行的监测。我国多个地方已报道猪HEV血清学、分子病毒学的调查结果,但河北地区猪戊型肝炎流行状况资料较少。
1 材料与方法
1.1 猪肝脏的来源 从河北部分地区的屠宰场随机采集55份屠宰猪肝脏样品,多聚甲醛-戊二醛混合固定液中固定备用。
1.2 试剂 兔抗人HEV多克隆抗体(一抗)、SP免疫组化染色试剂盒,均购自北京博奥森生物技术有限公司。试剂盒中试剂为3%H2O2去离子水;封闭用正常山羊血清工作液;生物素标记羊抗兔IgG,生物素标记羊抗小鼠IgG;辣根酶标记链霉卵白素工作液。显色剂DAB为美国ZYMED公司产品。
1.3 方法
1.3.1 病理组织切片制作和免疫组织化学染色 按常规石蜡切片制作技术制作连续切片, 分别进行HEV 免疫组织化学染色、苏木素-伊红(H.E.)染色及Mallory三色染色法。H.E.染色和Mallory三色染色法按常规方法进行, 免疫组织化学染色方法按试剂操作说明书进行。阴性染色对照不加一抗。
1.3.2 免疫组织化学染色结果的判定 在光学显微镜下, HEV 免疫组织化学染色阳性反应信号为棕红色或棕黄色团块状或颗粒状。
1.3.3 Mallory三色染色法结果判定方法 在光学显微镜下,胶原组织和网状纤维呈蓝色,淀粉样物质呈淡蓝色,酸性颗粒呈红色,红细胞呈桔红色。
2 结果
2.1 屠宰猪肝脏中HEV抗原(HEV-Ag)免疫组化检测 在被检的55例屠宰猪肝脏中,检出戊肝病毒抗原阳性有52例,占被检样品总数的94.55%;其中阴性3例,占被检测样品的5.45%(见表1)。结果表明,河北省部分地区猪HEV感染比较严重。
2.2 屠宰猪肝脏中HEV-Ag定位 肝被膜附近的肝组织中,HEV-Ag阳性反应信号常散在分布,而且常常仅见肝细胞核呈明显的阳性反应,胞浆多呈阴性反应(见中插彩版图1)。远离被膜的肝组织,阳性反应信号常成片分布,胞浆多呈阳性反应,而胞核却较少呈阳性反应。有时,在一个双核的肝细胞内常可见一个核呈阳性反应,另一个呈阴性反应。在肝小叶的周边区,阳性反应信号常散在分布,且常出现于核内间质淋巴细胞呈阴性反应。汇管区的小叶间动脉和静脉的内皮细胞及小叶间胆管的上皮细胞均呈阳性反应。而HEV-Ag阴性样品不出现棕红色或棕黄色团块状或颗粒状物质(见中插彩版图2)。

表1 屠宰猪肝脏中HEV-Ag免疫组化检测结果Table 1 Results of immunohistochemical detection of HEV-Ag in liver of slanghtered pigs
2.3 免疫组化阳性屠宰猪肝脏的H.E.染色观察 光学显微镜观察发现,HEV阳性肝脏组织均有不同程度的病理变化。其病变主要为肝细胞变性萎缩,散在单个核固缩性坏死,淋巴细胞等炎性细胞浸润、汇管区胆管增生,纤维结缔组织增生等变化(见中插彩版图3)。免疫组化阴性屠宰猪肝脏病理变化不明显。
2.4 免疫组化阳性屠宰猪肝脏的Mallory三色染色观察 Mallory三色染色法染色结果表明,在免疫组化阳性的屠宰猪肝脏中,镜检发现29.1%的肝组织中纤维结缔组织增生(见中插彩版图4)。而免疫组化阴性屠宰猪肝脏中纤维结缔组织增生不明显。
3 讨论
人戊型肝炎是一种对人类危害性较大的疾病。在医学临床上,肝脏中HEV抗原的存在,是诊断戊型肝炎的重要依据[7]。免疫组化染色作为一种广泛应用的技术,在病理诊断上的作用日趋重要。免疫组化染色反应的基本原理是抗原抗体的反应,是通过对针对样品中相应抗原的抗体上标记某种发色剂或酶类,再通过激发发色剂或使用某种显色剂,在显微镜下使标本中抗原抗体反应的部位产生肉眼可观察到的颜色,以确定所要检测的抗原是否存在。通过免疫组织化学染色技术,在光学显微镜下即可检测到所要研究的蛋白类物质的存在与否。免疫组化染色具有阳性率高,敏感性强,背景清晰,试剂商品化,使用方便等特点,也是诊断戊型肝炎常用的方法之一。本试验应用免疫组织化学方法检测屠宰猪肝脏中戊型肝炎病毒抗原,结果发现,55例屠宰猪肝脏中HEV抗原阳性率为94.55%;其中阴性3例,占被检测样品的5.45%;弱阳性20例,占被检测样品的36.36%;阳性27例,占被检测样品的49.09%;强阳性5例,占被检测样品的9.09%。结果表明,在河北部分地区日常生活中食用的屠宰猪群中HEV的感染是非常普遍的,而且感染率也很高。此外,本试验结果还表明,HEV免疫组化阳性屠宰猪肝脏中均表现出较为明显的肝炎病变。主要表现为肝实质损伤病变,即肝细胞变性、坏死,同时伴有炎性细胞浸润;间质出现了结缔组织不同程度增生和炎性细胞浸润。在HEV免疫组化阳性肝脏中,肝脏病变主要为淋巴细胞浸润、肝细胞变性、坏死、汇管区胆管增生、纤维结缔组织增生。从本试验结果中HEV抗原阳性屠宰猪肝脏的组织病理学变化情况来看,其病理变化与人戊型肝炎的病理变化相似[8]。反映了当前河北部分地区屠宰猪戊型肝炎感染方面存在着比较严重的问题。本试验结果表明,目前河北部分地区屠宰猪肝脏存在有戊型肝炎的感染痕迹,并且病变情况与戊型肝炎病毒感染相似,这个结果与以往报道相符合。目前可以证实河北部分地区屠宰猪的肝脏中存在与戊型肝炎病毒相关的抗原。
本试验中检测的免疫组化阳性屠宰猪肝脏样品中,29.1%的肝脏组织学都有不同程度的纤维化,表明戊型肝炎病毒可引起猪慢性肝炎,呈现明显纤维化,为进一步研究戊型肝炎致病机理提供了流行病学资料。

