骨桥蛋白在尿结石绵羊泌尿系统的表达和定位
任 杰,武果桃,卫顺生,孟冬霞,闫益波,赵 娟
(山西省农业科学院畜牧兽医研究所,山西太原030032)
骨桥蛋白(Osteopontin,OPN)是一种带负电荷的多功能非胶原性磷酸化糖蛋白,作为一种可溶性蛋白质存在于大多数体液和组织中,其相对分子质量约为44 kDa[1]。近年来关于OPN的已知功能研究结果如下:(1)通过精氨酸、甘氨酸、天门冬氨酸组成的序列(RGD)结合于细胞表面,介导细胞、基质之间的相互作用;(2)刺激β细胞产生免疫球蛋白[2];(3)促进免疫细胞、骨细胞和瘤细胞迁移[3-5];(4)刺激骨的钙化,改变细胞内钙水平[4];(5)促进骨组织内磷酸钙的吸收。其中OPN 在骨组织中主要是成骨细胞分泌, 在骨矿化中发挥重要作用,能增强细胞粘附的蛋白质对羟基磷灰石结合能力。而尿结石的形成与骨矿化有许多相似之处,OPN含有与细胞外基质的矿物质表面相互作用的酸性结构域,能抑制培养的血管平滑肌细胞的钙化作用,在体外可抑制草酸钙晶体的成核、生长和聚集[6-7], 但在体内能促进草酸钙结石形成。而舍饲绵羊在育肥中后期大量高蛋白饲料的代谢产物极易蓄积。最终造成尿液离子过饱和与pH值升高,形成磷酸盐结石[8]。本试验观察骨桥蛋白在绵羊磷酸盐尿结石发病情况下在泌尿系统表达量的变化,以及在肾脏和膀胱的定位。从蛋白水平验证骨桥蛋白与绵羊磷酸盐尿结石发生的关系。
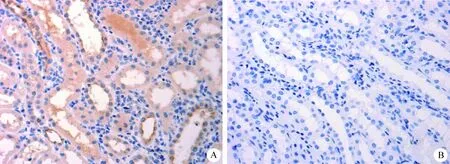
图1 肾脏免疫组化(40×)
Fig.1 Immunohistochemistry of kidney(40×)
A:患病绵羊; B:健康绵羊 A: Sicken sheep; B: Healthy sheep
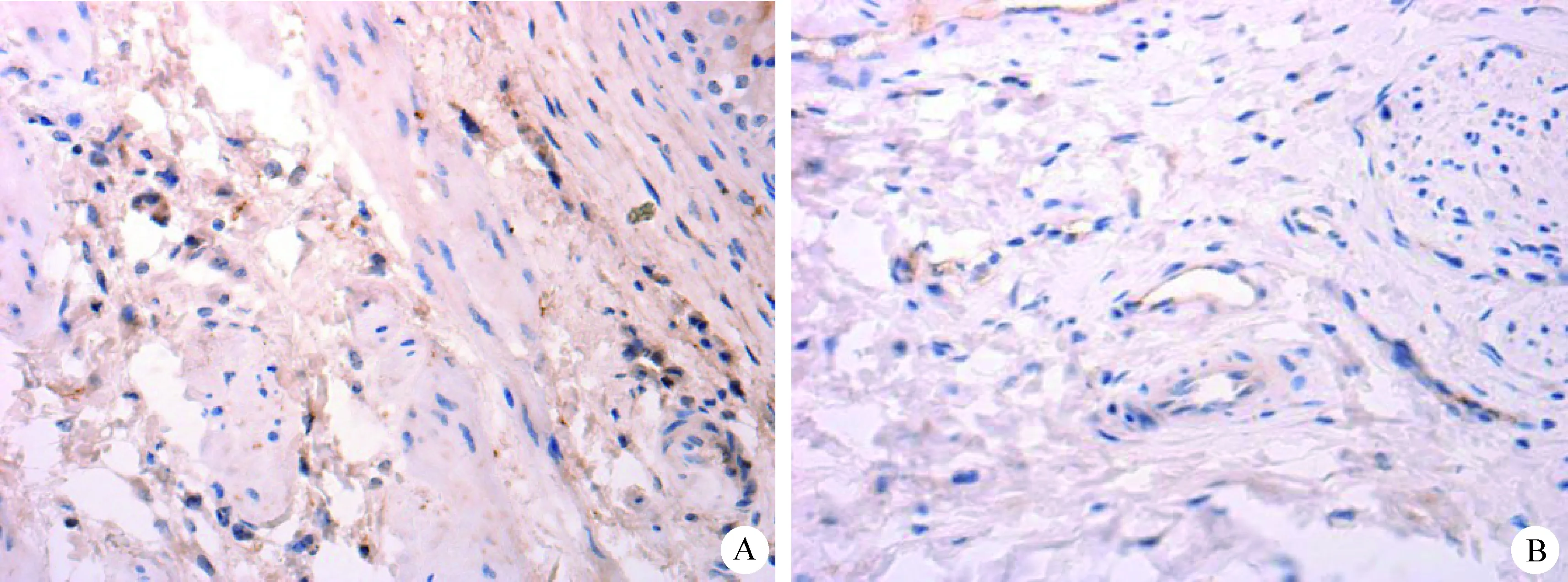
图2 膀胱免疫组化(40×)
Fig.2 Immunohistochemistry of bladder(40×)
A:患病绵羊; B:健康绵羊 A: Sicken sheep; B:Healthy sheep
1 材料与方法
1.1 主要试剂 蛋白提取试剂盒(C510003-0050);蛋白浓度测定BCA试剂盒(SK3021);β-acin抗体 (AB10001); 兔抗OPN多克隆抗体(bs-0019R);HRP conjugated Goat-anti-Rabbit IgG(AB10058);发光试剂盒(SK6668);免疫染色封闭液/一抗稀释液(E674004-0100);DAB免疫组织化学显色试剂盒(E670033-1000);柠檬酸钠抗原修复液(E673001-0250);免疫染色洗涤液(20×,E674003-0500);苏木素染色液(E607317-0100);中性树胶封片剂(E675007-0100)。以上试剂均购自生工生物工程(上海)股份有限公司。
1.2 组织材料 山西晋中健源养殖场患病绵羊和健康绵羊各4只,取肾脏、膀胱组织快速置于液氮冷冻保存,用于总蛋白的提取,1块置于Bouin′s固定液中固定,用于免疫组织化学分析。
1.3 试验方法
1.3.1 蛋白提取 按试剂盒说明书步骤提取蛋白。
1.3.2 蛋白浓度测定 按照每个样本200 μL BCA工作液配制。标准浓度梯度为:0、0.025、0.05、0.1、0.2、0.3、0.4 μg/μL和0.5 μg/μL。酶标仪中震动5 s。60 ℃恒温培养箱中保温30 min。冷却至室温后,测定各孔A492值,制作标准曲线,根据标准曲线计算出样本的蛋白浓度。
1.3.3 Western Blot 取液氮冷冻的肾脏和膀胱组织,用总蛋白提取试剂盒提取肾脏组织总蛋白。上样量20 μg。电泳、转膜、5%脱脂奶粉封闭。加入兔抗OPN多克隆抗体(TBST 1∶500稀释),37 ℃ 1 h,4 ℃过夜。次日洗膜加入HRP conjugated Goat-anti-Rabbit IgG,1∶8 000稀释,37 ℃孵育1 h。ECL曝光。DAB室温显色2~3 min,待出现棕黄色条带时,终止显色。
1.3.4 免疫组织化学 Bouin′s固定液固定的肾、膀胱组织通过梯度酒精脱水、二甲苯透明、浸蜡、包埋、修块、切片,做成5 μm厚的组织切片。将切片置于60 ℃恒温箱中烘烤60 min,清洗,封闭液室温封闭45 min。一抗(Anti-OPN antibody, Bioss, bs-0019R)4 ℃冰箱孵育过夜。次日室温放置60 min,洗涤。滴加二抗(HRP conjugated Goat-anti-Rabbit IgG),室温孵育60 min,洗涤、显色。洗涤加盖玻片中性树胶封片。显微镜拍片。
1.3.5 数据分析 应用Image-pro plus 6.0软件对OPN蛋白在肾、膀胱组织中的免疫组织化学染色结果进行光密度测定,每个组织取4张切片,每张切片取5个视野,得到阳性细胞的光密度值。所得数据用SPSS 18.0 forwindows软件,应用方差分析进行统计学分析。所测数据均符合正态分布。不同样本细胞中光密度(Optical density, OD)用单因子方差分析。应用Image-pro plus 6.0软件对绵羊OPN免疫印迹结果进行分析,测定目的条带面积和灰度值。分析结果用平均值±标准误(Means±SE)表示。
2 结果
2.1 蛋白浓度测定 在绵羊肾脏蛋白浓度,患病绵羊为(11.82±0.44) μg/μL,健康绵羊为(8.68±0.56) μg/μL,差异极显著(P<0.01)。膀胱蛋白浓度,患病绵羊为(14.32±0.82) μg/μL,健康绵羊为(12.43±0.75) μg/μL,差异显著(P<0.05),见表1。

表1 不同部位蛋白浓度测定结果Table 1 Results of different parts protein concentration determination (μg/μL)
2.2 Western Blot结果 绵羊肾脏总蛋白中存在能与兔抗OPN多克隆抗体发生免疫阳性反应的蛋白条带。OPN蛋白在患病与健康绵羊肾脏组织中的平均蛋白浓度为(2.873 2±0.035 6) μg/μL和(2.358 9±0.047 1) μg/μL,差异极显著(P<0.01)。绵羊膀胱总蛋白中同样存在能与兔抗OPN多克隆抗体发生免疫阳性反应的蛋白条带。OPN蛋白在患病与健康绵羊膀胱组织中的平均蛋白浓度为(3.493 2±0.053 7) μg/μL和(3.055 9±0.067 4) μg/μL,差异显著(P<0.05)。
2.3 免疫组化 肾脏OPN免疫组织化学染色结果显示, 光镜下可见肾小管上皮细胞表达OPN,主要定位于胞质,呈棕褐色。患病绵羊表达明显增多,色较深,平均吸光度为0.028 51±0.008 0;健康绵羊肾小管上皮细胞表达较少,色较浅,平均吸光度为0.013 89±0.004 5。患病绵羊与健康绵羊差异极显著(P<0.01)。见中插彩版图1。膀胱OPN免疫组织化学染色结果显示, 光镜下可见膀胱移行上皮细胞表达OPN,以及平滑肌少量表达,主要定位于细胞胞质,呈棕褐色。患病绵羊表达明显增多,色较深,平均吸光度为0.038 4±0.023 0;健康绵羊表达较少,色较浅,平均吸光度为0.029 76±0.012 9。患病绵羊与健康绵羊差异显著(P<0.05)。见中插彩版图2。
3 讨论
作为一种多功能蛋白,OPN在许多系统功能中发挥作用[9],其中在骨形成的研究较多,在骨基质的矿化和吸收过程中对钙介导和钙依赖的某些过程有参与细胞迁移,是一个主动的调控过程[10]。而尿结石的形成也存在类似钙化的过程,许多研究表明,骨桥蛋白在草酸钙晶体的形成过程中存在相关性。Wesson等[11]用乙二醇分别诱导OPN基因敲除的成年小鼠和正常小鼠,形成高草酸尿模型,到第4周后,OPN基因敲除小鼠的肾小管内形成大量草酸钙晶体,而正常小鼠则无晶体形成。吴敬彰等[12]研究OPN在结石患者肾组织中的表达时发现,结石组患者肾组织中的OPN表达量显著高于对照组。赵明等[13]在研究骨桥蛋白对大鼠发生草酸钙肾脏结石的影响时发现, OPN siRNA组OPN蛋白表达水平和草酸钙结石显著低于空载组,显著高于对照组。邓茂放等[14]在研究乌梅提取物对肾结石模型大鼠肾功能的保护作用及机制时发现,模型组和试验组肾组织中OPN蛋白免疫组化评分和OPN蛋白表达量明显高于正常组。以上研究都表明,OPN在草酸钙晶体转化为肾结石过程中起关键作用。另外,膀胱和尿液中OPN通过影响晶体结晶而影响草酸钙结石形成。Thurgood等[15]研究表明,OPN抑制草酸钙晶体生长,并且抑制作用呈剂量依赖性。王炎等[16]在研究加味健脾益肾方对肾结石术后尿骨桥蛋白的影响时发现,治疗组尿OPN含量比治疗前明显升高。而Konya等[17]研究草酸钙晶体聚集和生长的抑制活性过程中发现,尿液中OPN能增加草酸钙晶体的粘附和聚集,并且可以増加新形成的晶体的粘附力,OPN被草酸钙包裹成为结晶形成的始发部位,从而促进草酸钙结石的形成。
本试验对4只发生尿结石绵羊剖检确定都为磷酸盐结石,并随机抽取4只健康绵羊进行取样。在肾脏OPN蛋白表达,发病组极显著高于健康组,而膀胱上OPN的表达,发病组显著高于健康组,与吴敬彰等[12]的研究结果相同。但膀胱上OPN的表达量均高于肾脏,说明OPN在膀胱上表达高于肾脏。另外,免疫组化试验结果也验证了这一观点。
4 小结
尿结石是一种由多因素影响、形成过程非常复杂的疾病,目前其发病机制还有待研究。OPN在尿结石结晶形成中扮演着重要的角色。虽然已经对OPN与尿结石的关系做了许多研究,但目前仍不能明确其在尿结石形成过程中的具体作用。本试验在确定绵羊磷酸盐结石情况下,对患有尿结石绵羊和健康绵羊进行肾脏与膀胱OPN蛋白的表达和定位,结果显示,骨桥蛋白在尿结石绵羊和健康绵羊肾、膀胱组织中定位以及表达存在一定差异,表明骨桥蛋白与绵羊磷酸盐尿结石形成有关。

