碳酸乙烯酯与乙醇酯交换同时合成碳酸二乙酯和乙二醇的反应过程分析
何娇,陈雪莹,张发涛,王丽苹
(曲靖师范学院化学与环境科学学院,云南 曲靖 655011)
碳酸二乙酯(DEC)是一种低毒、环保的有机合成中间体,可用于合成聚碳酸酯二醇(PCDL)[1]、碳酸二苯酯(DPC)[2]、碳酸甲乙酯(EMC)[3]、N-乙基咔唑[4]和乙基化-β-环糊精[5]等多种化学品。DEC也是一种性能优良的绿色溶剂,可用作CO2的吸收剂[6]。此外,凭借DEC分子结构中的高氧含量(40.6%),DEC还可替代甲基叔丁基醚作为燃油含氧添加剂[7]。非光气合成DEC工艺主要有乙醇氧化羰基化法[8]、碳酸二甲酯(DMC)与乙醇酯交换法[9]、尿素乙醇醇解法[10]和碳酸乙烯酯(EC)与乙醇酯交换法[11]。其中,乙醇氧化羰基化法的转化率低,且副反应多,故DEC的选择性较差;DMC与乙醇酯交换合成DEC具有原料无毒、反应条件温和等特点,但副产物甲醇会与DMC形成共沸物,导致后续的分离纯化难度大;尿素与乙醇醇解法因原料易得、成本低、环保等而备受关注,但DEC收率低;EC与乙醇酯交换法可同时合成DEC和乙二醇(EG)两种化学品,EG是合成聚对苯二甲酸乙二醇酯(PET)的重要原料。PET是世界五大工程塑料之一,可用于生产纤维、薄膜以及各种塑料瓶[12]。因此,EC与乙醇酯交换同时合成DEC和EG工艺路线可实现原子利用率100%,符合绿色化工的要求,具有极高的经济价值和良好的发展前景。
目前,有关EC与乙醇酯交换同时合成DEC和EG工艺路线的研究工作主要集中在催化剂的开发方面,而对该酯交换反应过程的热力学计算与分析鲜见报道。因此,本工作采用基团贡献法对EC与乙醇酯交换体系中可能涉及到的反应的焓变、熵变、吉布斯自由能变、平衡常数等热力学数据进行了计算,并从热力学角度对各步反应的可行性进行了讨论,以期为该工艺路线的实验研究和可能的工业化应用提供一定的理论指导。
1 反应原理
EC与乙醇酯交换同时合成DEC和EG工艺路线中可能存在以下反应:如反应(1)所示,EC发生酰氧键断裂,与乙醇反应生成中间体2-羟乙基乙基碳酸酯(EHC),中间体EHC再按照反应(2)与乙醇反应生成DEC和EG,也可能按照反应(3)直接歧化反应生成DEC和双(2-羟乙基)碳酸酯(BHC)。反应(4)为EC与乙醇酯交换同时合成DEC和EG反应的化学计量方程式。

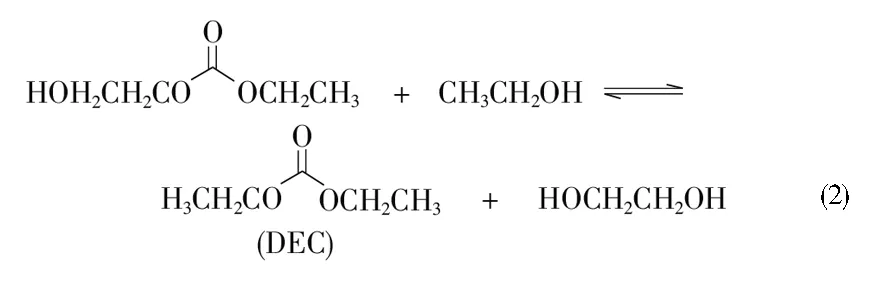
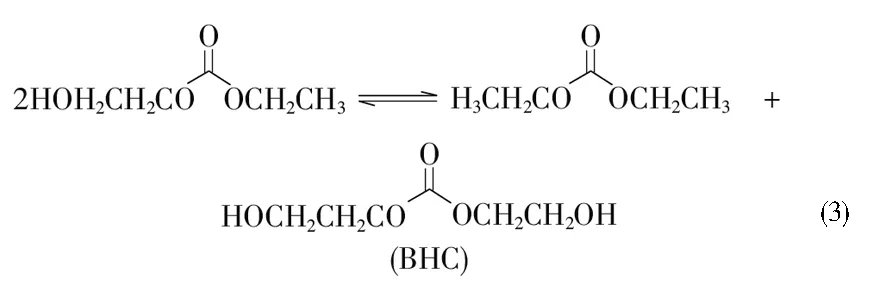
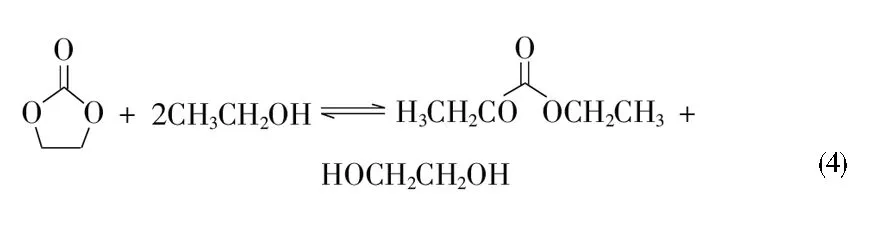
需要注意的是,酯类化合物中的酯基还会发生烷氧键断裂[13-14]。如反应(5)所示,EC与乙醇反应生成2-乙氧基乙醇(EEO)和CO2。

2 热力学计算
2.1 各物质在298 K下理想气体标准摩尔生产焓的估算

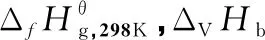
表1 各物质的和
(1)
2.2 各物质沸点及临界性质的估算
Lydersen法是上世纪80年代业界公认的估算沸点(Tb)和临界性质的最好方法,Joback对该法进行了修正,新增了若干个基团,且确定了这些基团的贡献值。本文采用Joback法估算反应体系中各物质的Tb、临界温度(Tc)和临界压力(pc),计算式如式(2)、式(3)和式(4)所示,式中,ni表示第i种基团的个数,ΔTbi、ΔTci、Δpci分别表示第i种基团对临界性质的贡献值,nA表示分子中原子的个数,计算结果见表2。

(4)
Tb=198+∑niΔTbi
(2)
(3)
2.3 323~373 K下各物质汽化热的估算
除EC、乙醇、DEC和EG之外,其他各物质沸点下汽化热(ΔVHb)采用Joback和Reid基团贡献法计算,计算式如式(5)所示,式中,ni表示第i种基团的个数,Δi表示第i种基团的贡献值,计算结果见表1。
ΔVHb=15.30+∑niΔi
(5)
各物质在不同温度下的汽化热(ΔVHT)用Waston公式进行估算,计算式如式(6)所示,式中,Tr为温度T与Tc的比值,n的取值与物质的性质有关。当Tbr<0.57,n=0.3;当0.57

(6) 表3 323~373 K范围内各物质的ΔVHT kJ/mol
2.4 323~373 K下各物质液体生成焓的估算

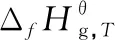
表5 323~373 K范围内各物质的与

表4 各化合物的等压比热容
(7)
(8)
2.5 323~373 K下各物质液体标准熵的估算

表6 323~373 K范围内各物质的与
(9)
(10)
3 结果与讨论
EC与乙醇酯交换反应是液相反应,各反应的焓变(ΔrHθ)、熵变(ΔrSθ)、吉布斯自由能变(ΔrGθ)和平衡常数(Kp)按式(11)~式(14)计算,计算结果见表7和表8。

表8 不同温度下各反应的ΔrGθ(kJ/mol)和Kp
(11)
(12)
ΔrGθ=ΔrHθ-TΔrSθ
(13)
(14)
从表7可以看出,在323~373 K范围内,反应(1)和歧化反应(3)的焓变ΔrHθ为正值,而反应(2)和反应(4)的ΔrHθ为负值,这表明反应(1)和歧化反应(3)为吸热反应,反应(2)和反应(4)为放热反应。随着反应温度的升高,反应(1) 的ΔrHθ明显下降,反应(2)和歧化反应(3)的ΔrHθ变化不大,反应(4)的ΔrHθ明显增加。由表8可以看出,反应(1)和歧化反应(3)的吉布斯自由能变ΔrGθ为正值,且平衡常数较小,说明在323~373 K范围内反应(1)和歧化反应(3)是非自发过程;而反应(2)和反应(4)的ΔrGθ为负值,且平衡常数较大,说明在323~373 K范围内这两个反应是自发过程。随着温度的升高,反应(1)的ΔrGθ明显减小,反应(2)和歧化反应(3)的ΔrGθ基本保持不变,反应(4)的ΔrGθ明显增加,与其ΔrHθ的变化趋势一致。由此可见,反应(1)可能是EC与乙醇酯交换同时合成DEC与EG反应的速率控制步骤,适当升高温度有利于DEC的生成;DEC不是通过中间体EHC歧化反应生成,而是主要通过EHC与乙醇反应得到。EC与乙醇酯交换同时合成DEC和EG反应的机理可能是乙醇分子上的羟基氧进攻EC分子上的羰基碳,生成中间体EHC,EHC再与乙醇反应生成DEC和EG。值得注意的是,副反应(5)的ΔrGθ为负值,且平衡常数较反应(4)的大,需开发高选择性的催化剂抑制反应(5)的发生。因此,开发的高选择性催化剂应能提高乙醇分子中羟基氧的亲核性和EC分子中羰基碳的亲电性,使得反应(1)更易发生。
4 结 论
EC与乙醇酯交换同时合成DEC和EG的第一步反应为吸热反应,在323~373 K范围内为非自发过程,且平衡常数较小;其余各步反应为放热反应,为非自发过程,且平衡常数明显较第一步反应的大,适当提高温度有利于DEC和EG的生成。副反应的吉布斯自由能能变ΔrGθ为负值,且平衡常数较大。

