没食子酸对D-半乳糖致雄性小鼠肝脏损伤的保护作用
翟晓瑞,霍明洋,周 旋,马一芯,史海燕,马洪波,郗艳丽
(吉林医药学院公共卫生学院,吉林吉林132013)
D-半乳糖目前被广泛用于衰老、脑老化、肝损伤、糖尿病性视网膜病等疾病的模型复制[1]。D-半乳糖可特异性地作用于肝脏半乳糖代谢途径,使肝细胞功能蛋白和膜蛋白合成受阻,从而造成细胞膜破裂,肝脏特异性酶丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)释放,肝细胞坏死[2-4]。D-半乳糖能损伤细胞器,耗竭磷酸尿苷,使依赖其生物合成的核糖蛋白、脂蛋白减少,限制细胞器及酶的生成和补充,使细胞器受损。D-半乳糖能产生氧化应激反应产生氧自由基,脂质过氧化反应加剧,活性氧水平上升,还原性保护酶GSH-Px、SOD、CAT等活性下降,过氧化物通过相应的信号转导途径诱导肝细胞凋亡,使肝细胞的损伤进一步加剧[1]。D-半乳糖常用来构建肝损伤实验动物模型,进而研究治疗肝组织损伤的药物或探讨作用机理。
没食子酸(Gallic acid)广泛存在于五倍花、茶叶、葡萄、刺云实豆荚等植物中[5-6],具有多种生物活性,没食子酸不良反应小,能通过结合自由基而清除自由基,故而显示出抗氧化性[7],这表明了没食子酸在拮抗D-半乳糖引起的肝损伤方面可能有一定的作用。本试验利用D-半乳糖构建肝损伤小鼠模型,给予没食子酸,观察其对肝组织损伤的影响。
图1 各组小鼠肝组织切片图(H.E.染色,200×)
Fig.1 liver section of mice in each group(H.E. staining, 200 ×)
a:对照组; b:模型组; c:阳性对照组; d:没食子酸低剂量组; e:没食子酸中剂量组; f:没食子酸高剂量组
a: Control group; b: Model group; c: Positive control group; d: Low-dose gallic acid group;
e: Medium-dose gallic acid group; f: High-dose gallic acid group
1 材料与方法
1.1 动物 60只SPF级健康ICR雄性小鼠,体质量18~22 g,购自长春亿斯实验动物技术有限责任公司,许可证号:SCXK(吉)-2016-0003,饲养于吉林医药学院实验动物中心,合格证号:SYXK(吉)2012-0004,温度18~22 ℃,相对湿度45%~65%,明暗交替。普通饲料喂养,自由饮水。普通饲料购自长春亿斯实验动物技术有限责任公司,许可证号:SCXK(吉)-2015-0005。
1.2 试剂与仪器 Synergy H1M酶标仪(美国BioTek),BS224S-CW电子分析天平(德国赛多利斯科技仪器),NIU普通光学显微镜(日本尼康)。过氧化氢(Hydrogen Peroxide,H2O2)、丙二醛(Malondialdehyde,MDA)、谷胱甘肽过氧化物酶(Glutathione Peroxidase,GSH-Px)、超氧化物歧化酶(Superoxide Dismutase,SOD)、总抗氧化能力(Total antioxidant capacity,T-AOC)和过氧化氢酶(Catalase,CAT)试剂盒(南京建成生物工程研究所),D-半乳糖(上海生物工程有限公司),维生素E[生工生物工程(上海)股份有限公司],没食子酸(美国Sigma),SYBR Green qPCR Mix和BCA蛋白定量试剂盒(上海碧云天生物技术有限公司),逆转录试剂盒(南京诺维赞生物科技有限公司)。
1.3 动物分组与模型构建 60只小鼠随机分为空白对照组、模型组、阳性对照组、没食子酸低剂量组、中剂量组和高剂量组,每组10只,正常饮水摄食。空白对照组皮下注射生理盐水15 mL/(kg·bw·d),其余各组给予颈部皮下注射D-半乳糖120 mg/(kg·bw·d)构建损伤模型,连续注射42 d,模型组和空白对照组各随机选取3只小鼠,断尾取血,测定MDA含量,若模型组小鼠血液中MDA含量明显高于空白对照组,表明造模成功。从第43天开始,以没食子酸为抗损伤药物进行干预,空白对照组和模型组灌胃生理盐水15 mL/(kg·bw·d),阳性对照组灌胃维生素E 60 mg/(kg·bw·d),没食子酸低、中和高剂量组分别灌胃50、100 mg/(kg·bw·d)和200 mg/(kg·bw·d)没食子酸,连续灌胃30 d[8]。
1.4 样品采集及检测 摘取小鼠肝脏并用生理盐水洗去血污,滤纸蘸干水分后精确称重。按公式[肝体比(%)=脏器质量/体质量×100%]计算肝体比。切取相同部位的小鼠肝组织,按1∶9(W/V)的比例加入生理盐水进行匀浆,4 ℃、3 000 r/min离心10 min,取上清液,BCA蛋白定量试剂盒检测蛋白浓度,按照试剂盒说明书的方法检测肝组织中的SOD、MDA、GSH-Px、T-AOC、CAT和H2O2水平。剩余肝组织冻于液氮中,用于后续检测。
1.5 肝脏的病理学观察 切取相同部位的小鼠肝脏组织,固定于4%多聚甲醛溶液,梯度精酒脱水,石蜡包埋,制作切片,苏木精-伊红(H.E.)染色,光镜下观察肝脏病理改变并拍照。
1.6Nrf2和HO-1 mRNA水平的检测 切取30~50 mg肝组织,TRIzol法提取RNA[9],通过反转录试剂盒获得肝组织基因组cDNA[10],并以此为模板,采用qPCR法检测相关基因mRNA的表达水平[11]。在检测过程中,以GAPDH作为内参照,并将基因在空白对照组的表达水平设为“1”,通过等比例比较基因在各剂量组中的表达水平。qPCR法所用引物序列:Nrf2上游引物为5′-CCCAGCAGGACATGGATTTGA-3′,下游引物为5′-AGCTCATAGTCCTTCTGTCGC-3′;HO-1上游引物为5′-CGACAGCATGTCCCAGGATT-3′,下游引物为5′-TCGCTCTATCTCCTCTTCCAGG-3′;GAPDH上游引物为5′-GCACCGTCAAGGCTGAGAAC-3′,下游引物为5′-ATGGTGGTGAAGACGCCAGT-3′。
1.7 统计分析 试验数据结果均采用SPSS 16.0软件进行分析,结果以平均值±标准差表示,多组计量资料采用方差分析(ANOVA)中的LSD法进行样本之间的两两比较,P<0.05表示差异有统计学意义。
2 结果
2.1 各剂量组肝体比的变化 给予D-半乳糖、维生素E和没食子酸后,各组小鼠摄食和饮水均正常,尿量正常,小鼠被毛顺滑有光泽,精神活泼,对外界反应灵敏,姿态和步态均无异常。试验结束时,各剂量组终末体质量、肝脏质量和肝体比的变化均无明显差异(P>0.05)(见表1)。
2.2 各剂量组SOD、GSH-Px、T-AOC、CAT、MDA和H2O2含量变化 由表2可知,与空白对照组比较,模型组小鼠肝组织SOD、GSH-Px、T-AOC和CAT含量显著降低,MDA和H2O2含量显著升高(P<0.05)。与模型组比较,阳性对照组小鼠肝组织SOD、GSH-Px和CAT含量显著升高,MDA和H2O2含量显著降低(P<0.05);没食子酸低剂量组小鼠肝组织GSH-Px和T-AOC含量显著升高,MDA和H2O2含量显著降低(P<0.05);没食子酸中、高剂量组小鼠肝组织SOD、GSH-Px、T-AOC和CAT含量显著升高,MDA和H2O2含量显著降低(P<0.05)。与没食子酸低剂量组比较,没食子酸中剂量组小鼠肝组织SOD含量显著升高(P<0.05);没食子酸高剂量组肝组织SOD、GSH-Px、T-AOC和CAT含量显著升高,MDA和H2O2含量显著降低(P<0.05)。与没食子酸中剂量组比较,没食子酸高剂量组肝组织GSH-Px和T-AOC含量显著升高,MDA和H2O2含量显著降低(P<0.05)。与阳性对照组比较,没食子酸高剂量组SOD、T-AOC和T-AOC含量均略高于阳性对照组(P<0.05),MDA和H2O2含量均显著低于阳性对照组(P<0.05)。
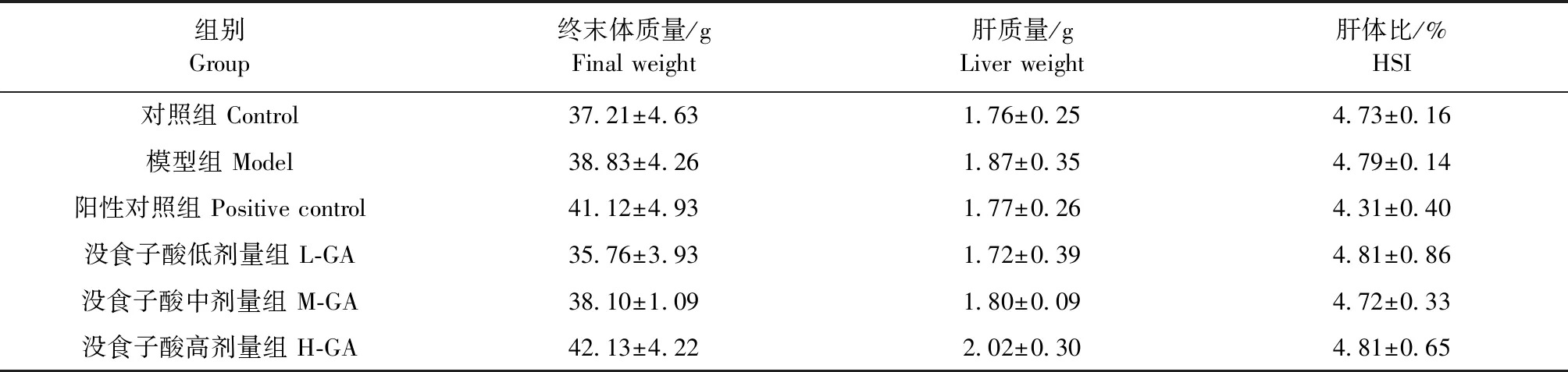
表1 没食子酸对D-半乳糖诱导的肝损伤小鼠肝体比的影响Table 1 Effect of gallic acid on hepatosmatic index of liver injury induced by D-galactose in mice
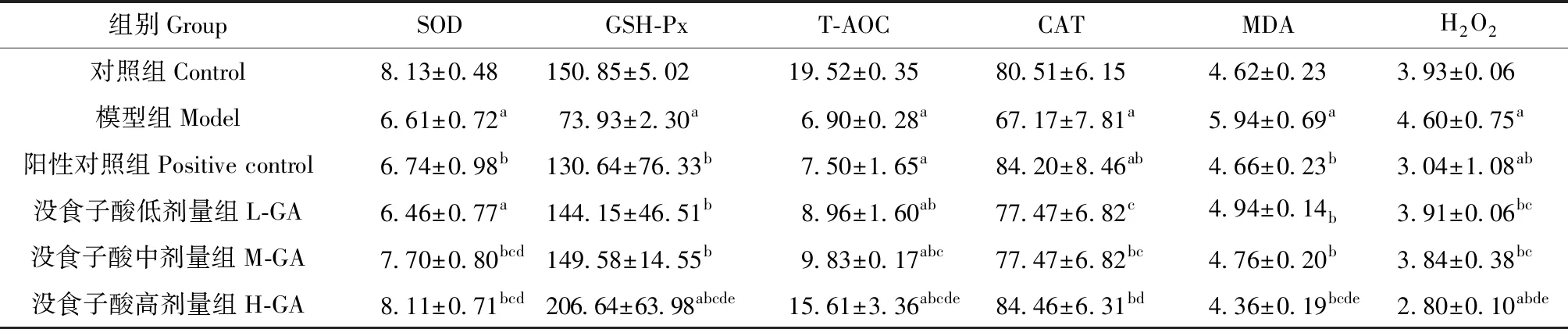
表2 没食子酸对D-半乳糖诱导的肝损伤小鼠SOD、GSH-Px、T-AOC、CAT、MDA和H2O2含量的影响Table 2 Effect of gallic acid on SOD, GSH-Px, T-AOC, CAT, MDA and H2O2 activities of liver injury induced by D-galactose in mice (n=10,U/mg)
2.3 各组小鼠肝脏组织病理学变化 由封三彩版图1可知,空白对照组肝细胞周围无炎症细胞浸润,肝细胞索以中央静脉为中心向四周呈放射状排列,且排列整齐,肝小叶的轮廓清晰,细胞分界清楚,细胞核位于细胞中央,细胞质丰富。模型组可见肝细胞呈现气球样变性,细胞胞体增大,胞浆清亮呈空泡状,且数量较多,小叶内炎性细胞浸润明显。给予没食子酸后,肝细胞气球样变性显著得到改善,细胞水肿得到改善。随着没食子酸给药剂量的增加,肝细胞气球样变性改善的越显著,肝细胞中未见肝细胞坏死,肝小叶内炎性细胞浸润减少,呈少量散在。阳性对照组改变类似没食子酸组。
2.4 各组小鼠肝组织Nrf2和HO-1 mRNA的表达水平 由图2可知,模型组的Nrf2和HO-1 mRNA水平高于空白对照组,但比较差异无统计学意义(P>0.05)。阳性对照组的Nrf2 mRNA水平显著高于空白对照组和模型组(P<0.05),HO-1的mRNA水平虽高于空白对照组和模型组,但比较差异无统计学意义(P>0.05)。没食子酸低和中剂量组Nrf2和HO-1 mRNA水平虽高于模型组,但比较差异无统计学意义(P>0.05),没食子酸高剂量组HO-1 mRNA水平显著高于空白对照组、模型组、阳性对照组、没食子酸低和中剂量组(P<0.05),没食子酸高剂量组Nrf2 mRNA水平虽高于模型组、没食子酸低和中剂量组,但比较差异无统计学意义(P>0.05)。
3 讨论
在国内,通常利用D-半乳糖诱导的肝损伤检验药物对肝脏的保护作用[12-14]。本试验采用大剂量D-半乳糖颈部皮下注射的方法,成功制作了亚急性损伤小鼠模型,通过对氧化损伤特异性指标MDA的检测,确定构建的模型准确可靠。通过试验发现,模型组MDA含量显著高于空白对照组,表明D-半乳糖能够引起受试动物出现氧化损伤,而这种氧化损伤正是机体细胞衰老的重要机制之一。试验过程中还发现,各剂量组受试动物体质量稳步上升,这表明给予的受试药物对动物体质量未产生显著影响。维生素E是细胞外液主要的抗氧化剂,发挥抗氧化、抗衰老的作用。本试验在制作亚急性损伤模型的同时,利用大量维生素E治疗D-半乳糖引起的损伤,以维生素E作为阳性药物,进一步考察没食子酸对D-半乳糖诱导肝脏损伤的保护作用。
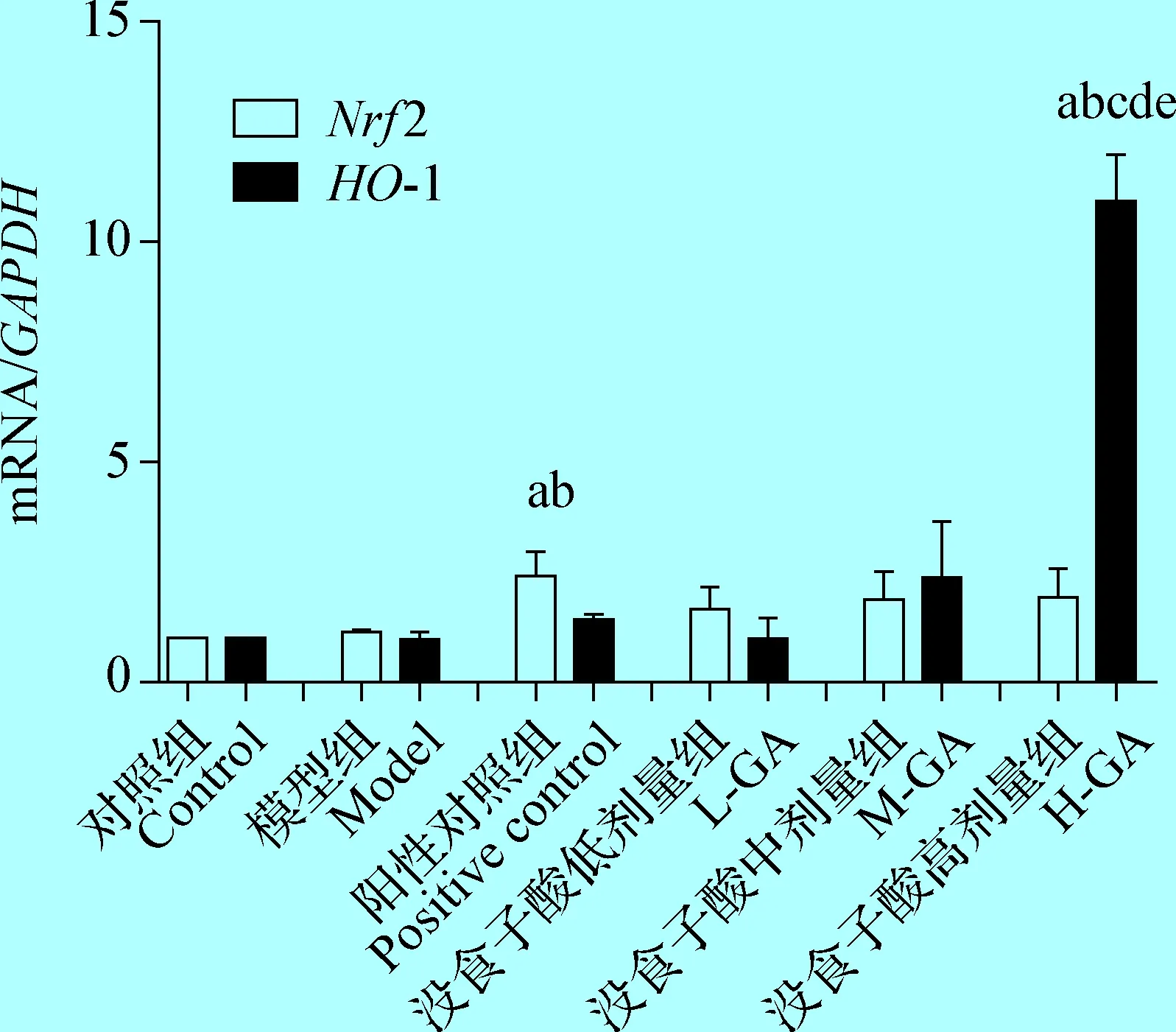
图2 各组小鼠肝组织Nrf2和HO-1mRNA表达水平
Fig.2 Expression level ofNrf2 andHO-1mRNA inliver tissue of mice in each group
SOD能清除机体产生的超氧阴离子,防止超氧离子的氧化作用[15]。MDA是自由基不饱和脂肪酸引发的脂质过氧化作用的产物,能与膜蛋白或磷脂的游离氨基交联,使膜的结构破坏,功能减退,最终导致细胞衰亡,其含量的多少反应组织细胞的脂质过氧化速率或强度,故MDA含量可直接反映机体的损伤程度[16]。本试验的结果表明,D-半乳糖诱导的损伤模型小鼠肝组织细胞的SOD含量显著低于空白对照组,MDA含量显著升高。没食子酸能显著升高肝细胞的SOD含量,降低MDA含量,且具有较好的量效关系。
内源性抗氧化酶T-AOC、GSH-Px和CAT是组织抗氧化应激的敏感指标,作为机体重要的抗氧化系统,这些内源性的酶决定了机体对抗氧化损伤的能力。因此在D-半乳糖诱导肝组织损伤的过程中,通过检测T-AOC、GSH-Px和CAT含量可以反映机体肝组织损伤的程度。本试验结果显示,模型组肝组织T-AOC、GSH-Px和CAT含量显著低于空白对照组,没食子酸治疗后,T-AOC、GSH-Px和CAT含量显著升高。CAT是能够使H2O2分解为分子氧和水的一种酶,从而使机体免受H2O2的损害。本试验结果显示,模型组CAT含量降低的同时,H2O2含量显著升高。给予没食子酸后,H2O2含量显著降低。
肝脏组织病理检测结果显示,模型组肝组织出现了气球样变性,D-半乳糖成功诱导肝组织出现损伤。给予没食子酸后,肝组织的病理改变得到显著改善,表明没食子酸能有效改善D-半乳糖引起的肝组织损伤。
Nrf2信号通路时集体细胞最重要的抗氧化防御机制之一。此信号通路的上调可诱导多种抗氧化酶及解毒酶,加速酶促反应,提高SOD等抗氧化物质的表达水平,清除自由基,维持细胞内的氧化还原状态,进而发挥保护细胞的作用。HO-1是非常重要的Ⅱ相解毒酶,其诱导表达是细胞氧化应激时的重要保护机制之一。HO-1的保护作用与其能减轻脂质过氧化反应有关。本试验发现,D-半乳糖干预后,升高了Nrf2和HO-1的mRNA水平,给予没食子酸治疗后,Nrf2和HO-1的mRNA水平升高显著[17]。这一结果表明,没食子酸能提高机体的抗氧化能力,进而发挥保护机体的作用。
综上,利用D-半乳糖成功诱导肝组织氧化损伤,导致MDA含量升高,SOD、CAT、GSH-Px等抗氧化酶含量降低,Nrf2和HO-1的mRNA水平升高。给予没食子酸后能有效改善这种损伤,起到保护肝组织的作用。

