猪繁殖与呼吸综合征病毒诱导的缺失第3外显子的肿瘤坏死因子受体介导细胞凋亡能力的探究
许嘉宇,李 忍,田志军,陈洪岩,王玉娥
(中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室 黑龙江省实验动物与比较医学重点实验室,黑龙江哈尔滨150069)
细胞凋亡包括内源性凋亡和外源性凋亡2种方式,内源性凋亡是细胞器释放的凋亡蛋白促发的,外源性凋亡主要由肿瘤坏死因子(Tumor necrosis facter,TNF)超家族相关分子与肿瘤坏死因子受体(Tumer necrosis factor receptor,TNFR)相结合诱导产生的[1]。凋亡在许多病毒感染过程中发挥重要的作用,病毒感染的细胞可通过启动凋亡而抑制病毒的感染。有研究表明,猪繁殖与呼吸综合征病毒(PRRSV)在感染的早期可通过下调p53的表达发挥抗凋亡的作用,进而有助于病毒的感染[2]。而在感染的晚期,PRRSV可通过抑制PI3K依赖的AKT通路促进细胞凋亡[3]。本实验室前期研究发现,PRRSV感染可刺激猪肺泡巨噬细胞(PAM)分泌TNF-α,分泌型的TNF-α可抑制PRRSV的感染[4]。TNF-α是通过与TNFR结合后募集细胞内的凋亡相关蛋白,激活凋亡信号通路发挥功能[5]。因此TNFR1可能参与PRRSV引起的凋亡,但目前尚无TNFR1在PRRSV感染过程中的功能的报道。本研究发现,在PRRSV感染的PAM细胞中TNFR1以2种分子量不同的形式TNFR1和TNFR1-d3存在,其中,TNFR1-d3有129 bp碱基的缺失突变。与野生型TNFR1相比,突变型TNFR1-d3不具有促进TNF-α介导的细胞凋亡功能,说明该129 bp碱基参与调控细胞凋亡。本研究揭示了PRRSV感染和细胞凋亡的新机制。
1 材料与方法
1.1 主要材料 猪肺泡巨噬细胞(PAM)、人胚肾细胞(HEK293)、PRRSV HuN4株,均由本实验室保存; 大肠杆菌DH5α感受态由本实验室制备;pcDNA3.1(+)真核表达载体,购自Invitrogen公司;RIPA裂解液、MLV反转录酶,均购自海基生物科技有限公司;DEPC水,购自BIOSHARP公司;RNA提取试剂盒RNeasy Plus Mini Kit,购自QIAGEN公司;放线菌酮、Flag单克隆抗体和β-actin单克隆抗体,均购自Sigma-Aldrich公司;猪源重组蛋白TNF-α,购自R&D公司;Annexin V-FITC细胞凋亡检测试剂盒(Annexin V-FITC Apoptosis Detection Kit),购自碧云天生物技术有限公司。
1.2 引物设计 根据GenBank中已登录的猪源TNFR1的基因序列(NM.213969.1),用Primer 5软件设计引物,见表1,由吉林库美生物科技有限公司合成。

表1 PCR扩增引物Table 1 Primers used in amplification
1.3TNFR1和TNFR1-d3真核载体的构建及鉴定 PRRSV HuN4株感染PAM细胞24 h后, 提取RNA,将其反转录获得的cDNA为模板,利用表1的上下游引物(退火温度:60 ℃),按传统方法进行PCR反应扩增目的片段。将扩增的目的基因(TNFR1和TNFR1-d3)片段纯化后经KpnI /EcoR I双酶切,并分别克隆至真核表达载体pcDNA3.1 (+)中获得重组质粒pcDNA3.1-TNFR1 和pcDNA3.1-TNFR1-d3,送至吉林库美生物科技有限公司测序鉴定。
1.4TNFR1和TNFR1-d3真核载体表达及鉴定 将构建好的真核表达质粒pcDNA3.1-TNFR1 和pcDNA3.1-TNFR1-d3分别转染至HEK293细胞中,转染24 h后,裂解细胞收集蛋白样品,进行SDS-PAGE电泳;将蛋白转印到PVDF 膜上, 于5%脱脂乳中室温封闭2 h;然后用 PBST 漂洗 3 次,每次 10 min; 4 ℃条件下,与相应一抗(anti-Flag: 1∶1 000,anti-β-actin: 1∶10 000)于水平摇床孵育过夜;PBST漂洗3次,每次漂洗10 min; 然后用相应标记的二抗室温条件下避光反应45 min,PBST洗涤3次,每次洗涤10 min;用近红外荧光扫描仪扫描PVDF膜保存并分析试验结果。
1.5 TNFR1和TNFR1-d3对细胞凋亡的影响 将构建好的真核表达质粒pcDNA3.1-TNFR1 和pcDNA3.1-TNFR1-d3分别转染至HEK293细胞中,转染24 h后,加入TNF-α(10ng/mL)+放线菌酮(2 μg/mL) 处理细胞4 h诱导细胞凋亡,利用流式细胞术检测TNFR1和TNFR1-d3对细胞凋亡的影响。弃掉处理细胞培养液,用PBS洗涤贴壁细胞1次,加入适量胰酶细胞消化液消化细胞。室温孵育至轻轻吹打可以使贴壁细胞吹打下来,转移到离心管内,1 000 g离心5 min,弃上清,收集细胞,PBS洗细胞1次。取约100万个重悬的细胞,1 000 g离心5 min,弃上清,加入195 μL Annexin V-FITC结合液轻轻重悬细胞,然后加入5 μL Annexin V-FITC,轻轻混匀。室温避光孵育20 min,使用贝克曼CytomicsTMFC 500流式细胞仪进行检测。
2 结果
2.1 PRRSV感染PAM细胞产生2种分子大小不同的TNFR1 分别以接种PRRSV HuN4株24 h和没有任何做处理的PAM细胞提取的总RNA反转录产物cDNA为模板,利用表1中的上下游引物进行PCR反应扩增目的片段,PCR产物进行琼脂糖电泳结果如图1所示, 从PRRSV HuN4株感染的PAM细胞中扩增产生2条大小不同的DNA条带,而从阴性对照PAM细胞中扩增只产生1条带。
2.2TNFR1和TNFR1-d3测序结果及分析 从PRRSV HuN4株感染的PAM细胞中扩增产生2条大小不同的DNA条带 (TNFR1和TNFR1-d3),胶回收后,用KpnI和EcoR I双酶切连接到pcDNA3.1(+)中,重组质粒测序比对后得到图2结果,发现较小的目的条带TNFR1-d3和较大的目的条带TNFR1相比,缺失129 bp碱基。进一步分析测序结果发现,缺失的129 bp是TNFR1的第3外显子上,如图3。
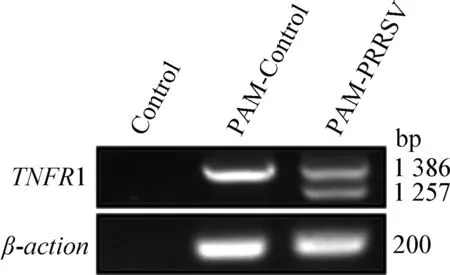
图1 PRRSV感染PAM细胞产生2种分子 大小不同的TNFR1Fig.1 Two different sizes of TNFR1 in PAMs infected with PRRSV

图2TNFR1和TNFR1-d3测序结果比对
Fig.2 Sequence alignment of theTNFR1 andTNFR1-d3
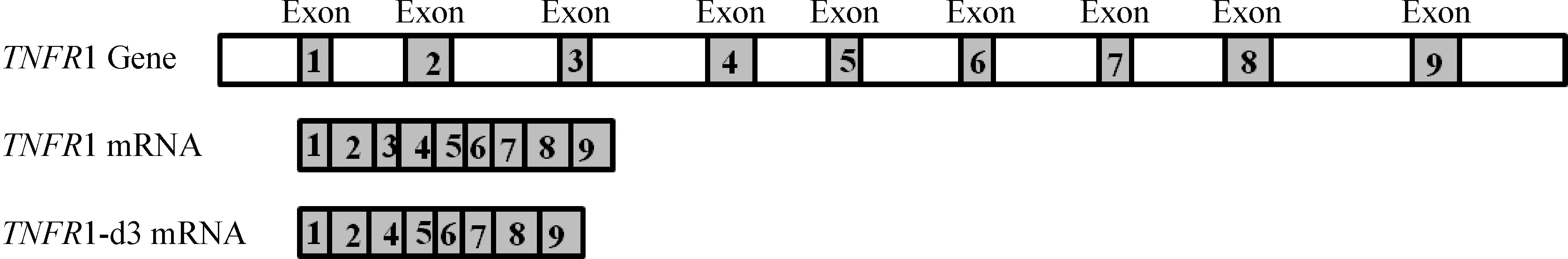
图3TNFR1-d3缺失位置
Fig.3 Deletion of theTNFR1-d3
2.3 pcDNA3.1-TNFR1 和pcDNA3.1-TNFR1-d3转染细胞后表达情况 将构建好的真核表达质粒pcDNA3.1-TNFR1 和pcDNA3.1-TNFR1-d3分别转染至HEK293细胞中,于转染后24 h,裂解细胞收集蛋白样品,进行SDS-PAGE电泳,然后将蛋白转印到PVDF膜上, Western Blot检测结果显示,pcDNA3.1-TNFR1 和pcDNA3.1-TNFR1-d3都能正常表达(图4)。
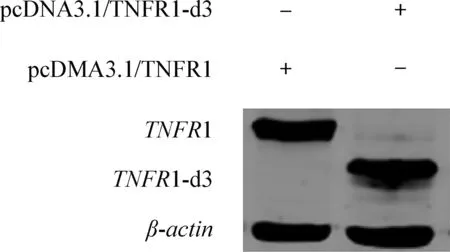
图4 pcDNA3.1-TNFR1 和pcDNA3.1-TNFR1-d3重组质粒的表达
Fig.4 Expression of recombinant plasmidspcDNA3.1-TNFR1 and pcDNA3.1-TNFR1-d3
2.4 TNFR1和TNFR1-d3在TNFα诱导细胞凋亡中的作用 将构建好的真核表达质粒pcDNA3.1-TNFR1 和pcDNA3.1-TNFR1-d3分别转染至HEK293细胞中,于转染后24 h用TNF-α结合放线菌酮处理细胞,诱导细胞凋亡。用FITC标记的Annexin V作为探针,标记磷脂酰丝氨酸(Phosphotidylserine,PS)来检测细胞早期凋亡的发生。流式细胞术检测结果显示,与对照组(Untreat)相比,过表达TNFR1细胞的凋亡比例明显升高,而过表达TNFR1-d3细胞的凋亡比例与对照组(Untreat)相比几乎没有变化(图5)。结果表明,TNFR1具有明显的促凋亡功能,而当TNFR1缺失第3外显子后其促凋亡能力消失。
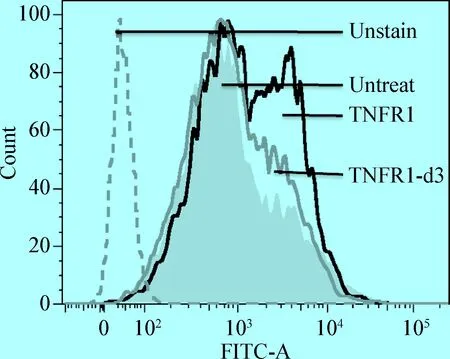
图5 流式细胞检测TNFR1和TNFR1-d3 在细胞凋亡中的作用Fig.5 Flow cytometry detects the function of TNFR1 and TNFR1-d3 in apoptosis
3 讨论
病毒会在感染的早期通过不同的机制抑制宿主细胞的凋亡,促进自身的复制;在感染的晚期促进细胞的凋亡,有助于病毒粒子的释放。已报道的研究指出,PRRSV在感染的过程中也有类似的现象存在[6-7]。TNFR1是介导细胞凋亡的主要受体分子之一。本研究发现在PRRSV感染后,可以引起PAM细胞TNFR1出现2种不同剪接体:野生型TNRF1和缺失型TNFR1-d3。这2种剪接体的差异在于TNFR1-d3较野生型TNRF1在第3外显子(129 bp)处缺失,这种缺乏第3外显子的剪切体TNFR1-d3是第一次被发现。已有文献报道TNFR1存在缺乏第2外显子的剪切突变体TNFR1-d2,其存在具有组织特异性[8]。另有研究指出,TNFR1存在缺失第6外显子的替代转录本TNFR1-d6,该种转录本不能引起NF-κB介导的细胞凋亡[9]。TNFR1是I型跨膜蛋白,由N端胞外结构域(与TNF结合的部位),α螺旋跨膜结构域、近膜区和C端胞内死亡结构域组成。C端胞内区可以与细胞内的接头蛋白TRADD或FADD/MORT1结合形成凋亡复合物引发细胞凋亡[10]。由于TNFR1的第3外显子位于N端胞外区,是与TNF结合的部位,因此我们推测缺失129 bp 的TNFR1-d3可能会影响由TNFR1介导的细胞凋亡的功能。结果显示,过表达TNFR1会引起TNFα诱导的细胞凋亡,而过表达TNFR1-d3几乎失去了由TNF-α处理诱导细胞凋亡的能力。这就说明PRRSV感染可能启动某种机制,使得TNFR1缺失第3外显子转录本产生,降低细胞凋亡的产生,进而促进病毒的感染复制。本研究阐明了PRRSV在早期抑制细胞凋亡的一种机制。

