猪Delta冠状病毒和猪流行性腹泻病毒双重RT-PCR诊断方法的建立
刘 莹,贾敬亮,刘 涛,袁广富,陈少杰,王 晶,范京惠,左玉柱
(1.河北农业大学动物医学院,河北保定071001 ; 2.衡水市畜牧技术推广站,河北衡水053000 ; 3.石家庄市动物卫生监督所,河北石家庄050000)
猪Delta冠状病毒(Porcine deltacoronavirus,PDCoV)和猪流行性腹泻病毒(Porcire epidemic diarrhea virus, PEDV)均是引起仔猪腹泻病的重要病原,二者临床症状极为相似,且常常混合感染,仅根据临床上的方法较难进行鉴别与诊断,传统检测方法最大的缺点就是检测周期长,工作繁琐并配备专业人员进行检测,特异性与灵敏度也较差,因此,建立一种同时检测PDCoV和PEDV的快速检测方法具有重要意义。
1 材料与方法
1.1 病毒来源 猪流行性腹泻病毒、猪Delta冠状病毒、猪传染性胃肠炎病毒(TGEV)、猪伪狂犬病病毒(PRV)、猪博卡病毒(PBoV)和猪繁殖与呼吸综合征病毒(PRRSV)阳性病料,均由河北农业大学动物医学院预防兽医实验室鉴定、保存。
1.2 仪器与试剂 DL-2 000 DNA Marker(MD114)、RT-PCR反转录试剂盒,均为宝日医生物技术(北京)有限公司产品;DNA提取试剂盒为北京全式金生物技术有限公司产品;2×TaqPCR Mix为中科瑞泰生物科技有限公司产品;Protein simple凝胶成像系统为普诺森生物科技(上海)有限公司产品。
1.3 引物设计与合成 利用 Primer 5.0 引物设计的软件,根据GenBank中收录的PEDVM基因和PDCoVM基因中获得的保守区域分别设计2对引物,预计扩增PEDV的M基因部分片段520 bp,扩增PDCoV的M基因部分片段340 bp,引物由北京三博远志生物技术有限责任公司合成(见表1)。
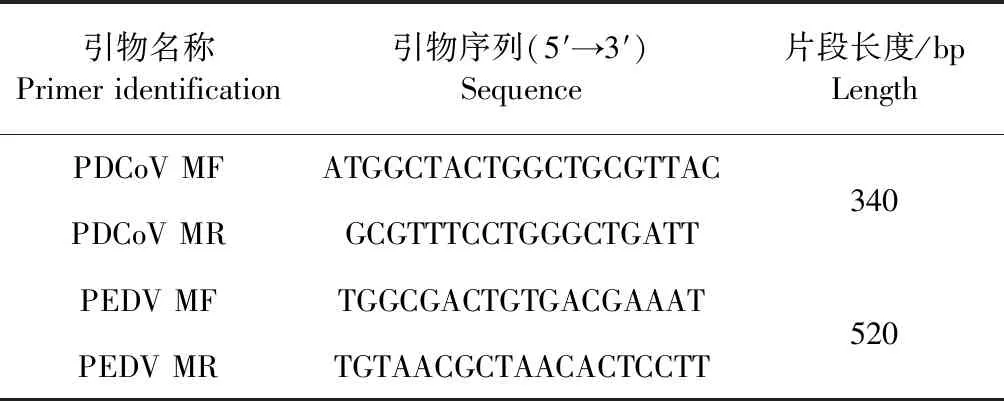
表1 PEDV与PDCoV引物信息Table 1 Primer used for amplification and sequencing of PEDV and PDCoV
1.4 病毒核酸的提取及cDNA的获取 由河北农业大学动物医学院预防兽医实验室鉴定保存的病毒阳性病料,参照RNA提取试剂盒说明书进行病毒核酸的提取,并使用RT-PCR反转录试剂盒获得cDNA。
1.5 PDCoV和PEDV单一PCR扩增 用1.4中所得到的PEDV和PDCoV的cDNA作为模板进行单一RT-PCR扩增的体系为:2×TaqPCR Mix 10 μL,ddH2O 6 μL,上下游引物各1 μL,cDNA模板2 μL。PCR反应扩增程序为94 ℃预变性5 min;94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸40 s,35个循环;72 ℃再延伸10 min,扩增好的PCR产物经琼脂糖凝胶电泳,得到目的条带并进行回收,将回收的目的片段连接至pMD19-T载体并转化至大肠杆菌感受态细胞DH5α,用质粒提取试剂盒进行提取后,放于-20 ℃保存备用。
1.6 PDCoV与PEDV的双重RT-PCR扩增 根据1.5中单一RT-PCR的扩增反应条件,以PDCoV和PEDV的重组质粒为模板,通过对退火温度、引物终浓度、反应体积进行优化,并按上述方法进行凝胶电泳鉴定。
1.7 双重RT-PCR特异性试验 分别对PRV、PBoV、TGEV和PRRSV的核酸进行PCR扩增,利用本试验PDCoV和PEDV的反应体系进行PCR扩增,并在凝胶电泳中进行扩增特异性的验证。
1.8 PDCoV和PEDV单一和双重RT-PCR敏感性试验 将PDCoV和PEDV的单一质粒,测定浓度后,进行10倍倍比稀释,分别作为模板,验证单一及双重RT-PCR检测方法的敏感性。
1.9 临床样品检测 2018年以来,本实验室收集到的232份河北各地市养猪场仔猪腹泻部分样品进行检测,用此双重RT-PCR的检测方法从仔猪腹泻病料中进行特异性的检测,并将双重RT-PCR和单一RT-PCR进行结果对比。
2 结果
2.1 PDCoV和PEDV的RT-PCR特异性扩增 以PDCoV和PEDV的重组质粒和单一质粒分别作为模板,再分别以TGEV、PRRSV、PBoV和PRV为模板,利用本试验PDCoV和PEDV的反应体系进行PCR扩增,结果仅PDCoV和PEDV能扩增出特异性条带,而其他病毒均无特异性条带(见图1)。
2.2 单一和双重 RT-PCR 敏感性试验 以PDCoV和PEDV的重组质粒进行倍比稀释后作为模板,用此双重RT-PCR检测方法进行检测,结果显示,单一PCR对PDCoV和PEDV最低检测量分别为3.27×103拷贝/μL,3.63×104拷贝/μL(见图2)。
2.3 多重PCR的临床检测 2018年以来,本实验室收集到的232份河北各地市养猪场仔猪腹泻样品进行检测,临床样品的检测结果显示(见表2),在232份未知样品中,PDCoV的阳性样品41份,阳性率为17.67%;PEDV的阳性样品62份,阳性率为26.72%;PDCoV和PEDV的阳性样品28份,阳性率为12.07%,所建立双重RT-PCR的检测方法可以从仔猪腹泻病料中特异性的检测出PDCoV和PEDV,并将双重RT-PCR和单一RT-PCR进行结果对比,检测结果相一致,符合率100%。
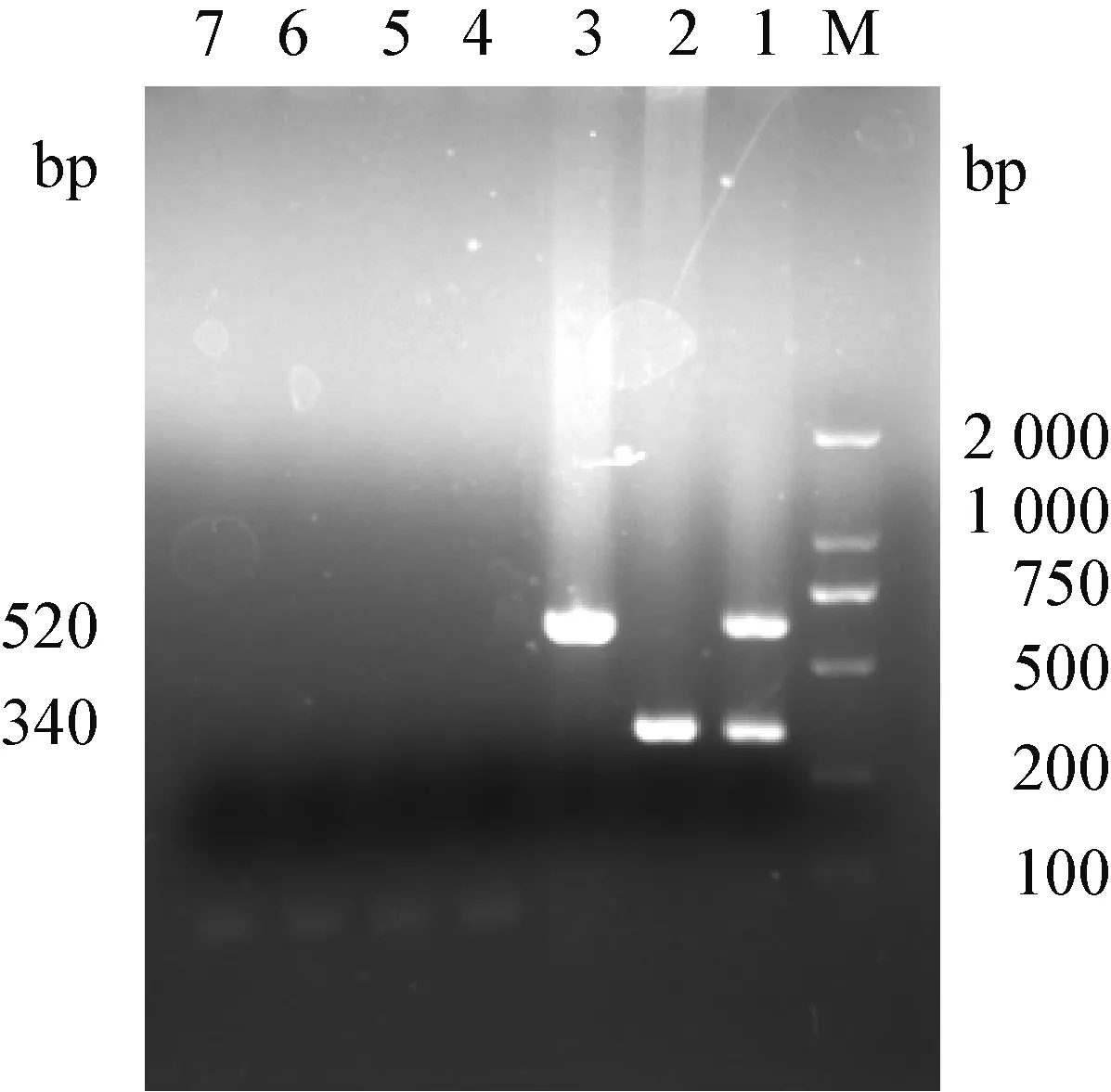
图1 双重RT-PCR的特异性试验
Fig.1 Specificity of the duplex RT-PCR products ofPDCoV and PEDV detectionM:DNA分子质量标准; 1: PEDV和PDCoV的双重PCR扩增产物; 2:PDCoV的PCR扩增产物; 3: PEDV的PCR扩增产物; 4~7:分别为TGEV、PRRSV、PBOV、PRV的PCR扩增产物
M: DL-2 000 DNA Marker; 1: The duplex PCR products of PDCoV and PEDV; 2: The PCR products of PDCoV; 3: The PCR products of PEDV; 4~7: The PCR products of TGEV, PRRSV, PBoV, PRV
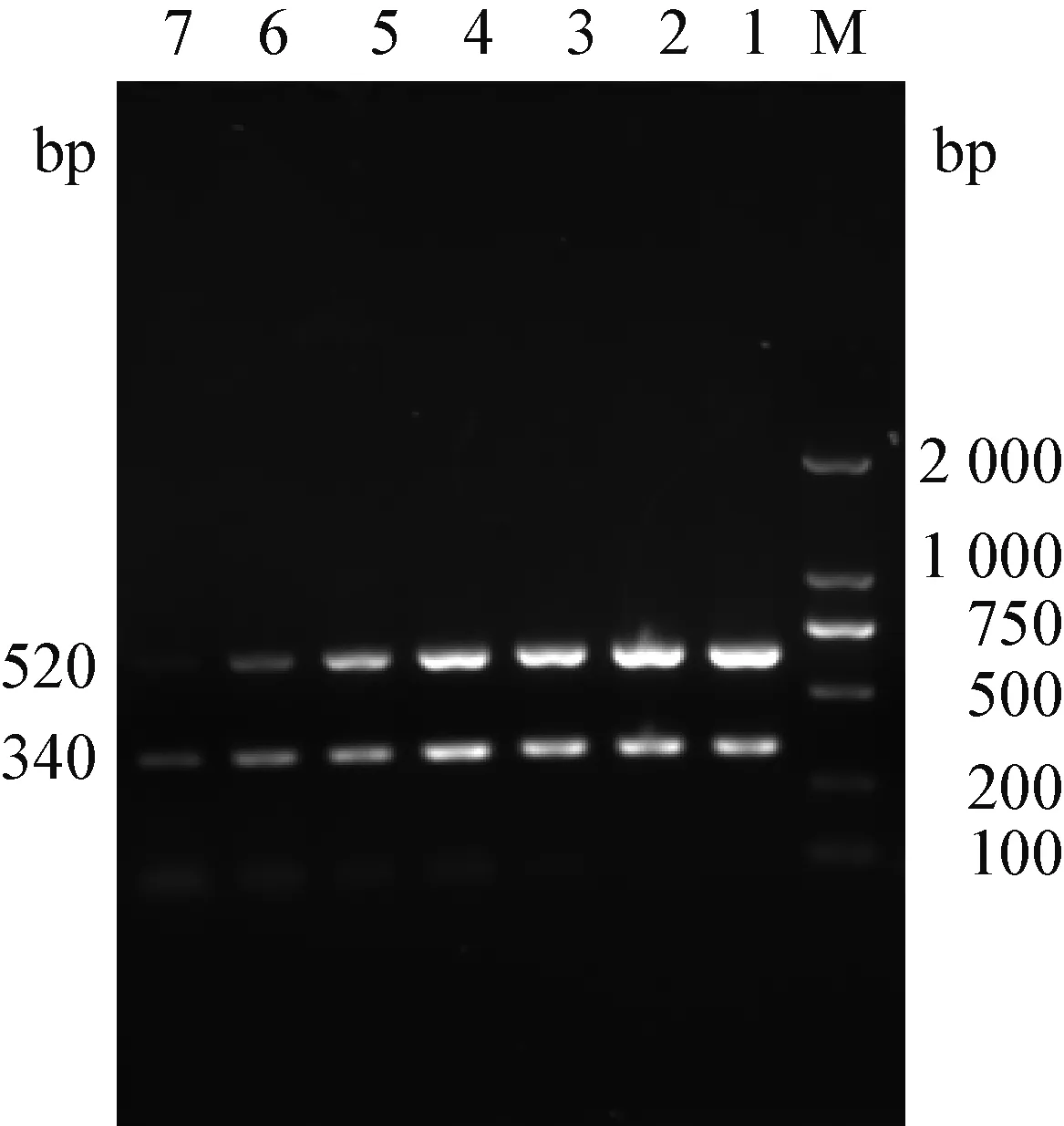
图2 双重RT-PCR的敏感性试验
Fig.2 Sensitivity test of duplex RT-PCR
M: DNA分子质量标准; 1~7:1×10-1~1×10-7拷贝/μL
M: DL-2000 DNA Marker; 1~7: 1×10-1~1×10-7copies/μL
3 讨论
猪Delta冠状病毒是一种新发现的冠状病毒, 在临床上主要影响仔猪出现呕吐、腹泻和脱水等症状,与PEDV症状极为相似。2012年Woo等[1]在香港首次检测出了PDCoV,美国于2014年在腹泻的仔猪和母猪中首次发现了PDCoV[2],此后PDCoV在韩国和加拿大也相继发现和报道了PDCoV[3]。随后Dong等[4]对2004-2014年安微、广西、湖北、江苏4个地区病料的检测中发现,2004年的病料中就存在PDCoV,并且在国内外均有比较高的检出率,给散养户或规模性养猪业造成了巨大危害。猪流行性腹泻病毒在欧洲和亚洲等规模化养猪行业较发达的地区都有过相关报道[5-9]。1971年在英国首次报道了PEDV,我国从20世纪80年代初开始陆续有 PEDV 的发生。1991年国际病毒分类委员会(ICTV)第5次报告将PEDV列为冠状病毒属的可能成员,1991年第6次报告将其列为冠状病毒属的正式成员[10]。

表2 临床样品检测结果Table 2 Clinical sample test results
猪Delta冠状病毒与猪流行性腹泻病毒感染极为类似,且混合感染时有发生,单靠临床诊断很难区分2种疾病, 给散养户或规模性养猪业造成了巨大危害。因此,建立同时检测且区分PDCoV和PEDV的检测方法具有重要的临床意义。根据GenBank 中 PDCoV和PEDV的基因序列保守区,分别对于PDCoVM基因和PEDVM基因设计了2对引物,并对PDCoV和PEDV保守性极高的M基因片段进行扩增,并通过对反应条件的优化,建立了同时检测PDCoV和PEDV的双重PCR检测方法,该方法对于PDCoV和PEDV的最低检测量分别是3.27×103拷贝/μL和3.63×104拷贝/μL,并且具有良好的特异性和敏感性,进一步在实践中验证此方法的可靠性,为兽医临床诊断及监测、流行病学的调查提供了理论基础。很多专家学者对各种腹泻病已经有了相关研究,任玉鹏等[11]建立了PDCoV、TGEV和PEDV多重RT-PCR方法。刘玲玲等[12]也建立了PDCoV和TGEV的双重RT-PCR检测方法。
本试验是根据近年来河北各地市及其周边地市养猪场仔猪腹泻病毒病的流行病学的调查,选取了在目前仔猪腹泻病中感染率比较高的2种腹泻病毒病-
猪Delta冠状病毒(PDCoV)和猪流行性腹泻(PEDV)进行研究,从而建立2种病毒的双重RT-PCR检测方法。

