J亚型禽白血病病毒水平传播的试验
张桂枝,龙瑞艳,徐明国,靳双星
(1.河南牧业经济学院动物科技学院,河南郑州450046 ; 2.河南省家禽疾病防控工程技术研究中心,河南郑州450046 ; 3.石河子大学动物科技学院,新疆石河子832003)
禽白血病(Avian leukosis,AL)是重要的种源性疾病和免疫抑制性疾病,全国兽医卫生事业发展规划(2016-2020年)将AL列为重点净化的家禽疫病。按照国家中长期动物疫病防治规划(2012-2020年)要求,到2020年国内全部种鸡场AL达到净化标准。尽管国内许多种鸡场开展了AL的净化工作,但目前该病在我国鸡群中感染仍比较复杂,特别是地方品种鸡经常出现2种或2种以上亚型混合感染[1-9],以及禽白血病病毒(ALV)和网状内皮组织增生症病毒(REV)混合感染[10-14]。张倩在2011-2016年间对我国19个省60个祖代场ALV的感染情况进行调查,结果发现,ALV- p27抗原场阳性率为18.75%~66.67%,ALV-J抗体场阳性率为26.3%~64.71%,ALV-AB抗体场阳性率为36.84%~88.24%[14]。马美哥等从2018年以来进口的某品种肉种鸡体内分离出了J亚群禽白血病病毒[15]。垂直传播为ALV的主要传播方式,其决定了感染的延续性和持续性;水平传播保证了ALV得以维持。为了探讨阴性鸡与先天感染ALV-J的阳性鸡接触一定时间后,ALV-J的水平传播情况,特开展本试验,旨在为种鸡场制定禽白血病净化方案和更好地开展本病净化提供理论依据和技术参考。
1 材料与方法
1.1 材料
1.1.1 试验动物 阳性鸡来源于河南省某地方品种鸡场;阴性鸡由SPF种蛋(购自北京勃林格殷格翰维通生物科技有限公司)在河南牧业经济学院家禽生产实验室孵化机内孵化而成。
1.1.2 主要试剂 超纯RNA提取试剂盒、HiFiScript cDNA Synthesis Kit试剂盒、2×EsTaqMaster Mix,均购自康为世纪生物科技有限公司; ALV-J 抗体检测试剂盒、ALV- p27抗原检测试剂盒,均购自美国IDEXX公司; 抗ALV- J单克隆抗体JE9由扬州大学秦爱建教授惠赠;FITC标记羊抗鼠IgG荧光抗体(bs-0310G-FITC),购自北京博奥森生物技术有限公司;DMEM培养液、新生牛血清,均购自GIBCO公司。
1.1.3 细胞 DF-1细胞由河南牧业经济学院中心实验室保存。
1.1.4 主要仪器 ELISA酶标仪、二氧化碳培养箱,均购自Thermo公司;PCR仪,购自美国ABI公司;凝胶成像系统,购自DNR公司;核酸凝胶电泳仪,购自Bio-RAD公司;倒置荧光显微镜,购自日本尼康公司。
1.2 方法
1.2.1 试验动物的选择 阳性鸡的选择:0日龄采集胎粪,利用ELISA方法检测其ALV-p27,并于7日龄采集血浆接种DF-1细胞,取细胞培养液利用RT-PCR检测ALV-J抗原,二者均为阳性的20只鸡作为阳性鸡。阳性鸡和60只阴性鸡在同一笼内饲养,按照种鸡的饲养管理标准正常饲养和接种免疫。
1.2.2 胎粪和泄殖腔棉拭子ALV-p27抗原检测 按照IDEXX ALV- p27抗原检测试剂盒说明书进行检测。
1.2.3 血清ALV-J抗体检测 采集试验鸡促凝血,离心分离血清,然后按照IDEXX ALV-J抗体检测试剂盒说明书检测相应抗体。
1.2.4 外源性ALV的分离 将DF-1细胞传至6孔细胞培养板,细胞长成 60%~70%单层时,取200 μL试验鸡血浆接种于DF-1细胞,37 ℃ 继续孵育2 h,弃上清液,更换为含1%胎牛血清的DMEM培养液,在37 ℃ 5%CO2条件下继续培养9 d后,用ALV-p27抗原ELISA检测试剂盒逐孔检测p27抗原,并通过RT-PCR检测ALV-p27。
1.2.5 引物设计与合成 针对ALV相对保守的p27基因序列和ALV-J的特异性gp85基因序列设计合成鉴定引物,引物由生工生物工程(上海)股份有限公司合成。引物名称、序列以及目的片段大小见表1。
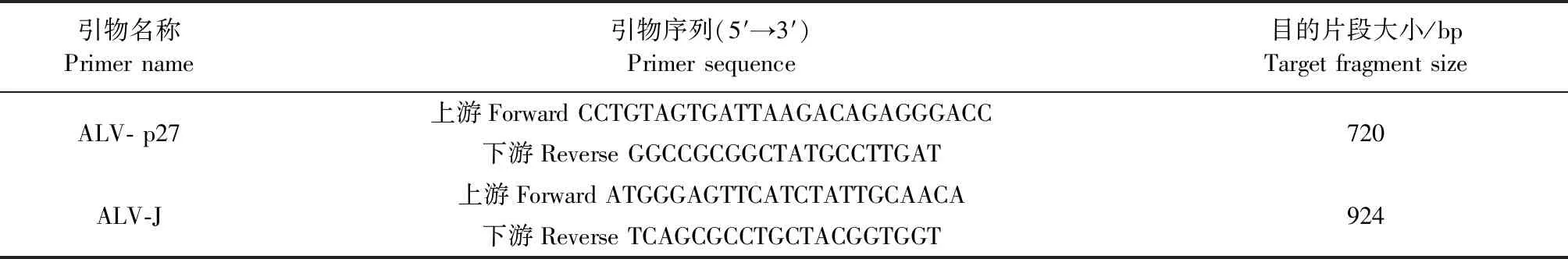
表1 ALV-p27、ALV-J 鉴定引物Table 1 The identification primer of ALV-p27、ALV-J
1.2.6 RT-PCR检测ALV-p27及ALV-J亚群鉴定 收集接种试验鸡血浆培养9 d后的细胞培养上清液,高速离心除去细胞碎片后,使用超纯RNA提取试剂盒提取总RNA,以此为模板,利用反转录试剂盒获得病毒基因组cDNA。并以此cDNA为模板,分别用 ALV- p27的鉴定引物和ALV-J 特异性引物进行PCR 扩增。ALV- p27 的反应程序为:95 ℃预变性5 min;94 ℃变性40 s,62 ℃退火30 s,72 ℃延伸45 s,30个循环;72 ℃再延伸10 min,4 ℃保存。ALV-J反应程序为:95 ℃预变性5 min;94 ℃ 40 s,64 ℃ 30 s,72 ℃延伸1 min,30个循环;72 ℃再延伸10 min。用 1%琼脂糖凝胶电泳鉴定PCR产物。
1.2.7 ALV-J的间接免疫荧光鉴定(IFA) 接种试验鸡血浆的DF-1细胞培养9 d后用PBS 洗细胞3 次,每次5 min;然后用4%多聚甲醛常温固定20 min; 弃去固定液,自然干燥,再用PBS 漂洗3 次,每次5 min;加入抗ALV- J单克隆抗体JE9,37 ℃孵育1 h后用PBS漂洗3次,每次5 min;再加入FITC标记羊抗鼠IgG荧光抗体,37 ℃ 孵育1 h,用PBS漂洗3次,使用倒置荧光显微镜观察结果。
2 结果
2.1 泄殖腔ALV-p27检测结果 阴性鸡与阳性鸡直接接触7、15、25、35、45、55、65、75 d和90 d后,泄殖腔ALV-p27阳性率变化动态曲线见图1。由图1可知,阴性鸡与阳性鸡接触15 d,有3.33%鸡只泄殖腔中可检测到ALV-p27抗原。从15~45 d泄殖腔ALV-p27阳性率逐渐增高,55 d略有降低,65 d阳性率达高峰为50.00%,65~90 d泄殖腔ALV-p27抗原阳性率逐渐降低。
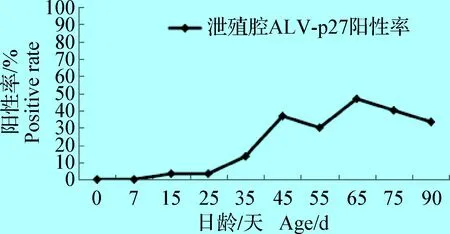
图1 阴性鸡与阳性鸡接触一定时间后泄殖腔带毒排毒动态
Fig.1 After mixing antigen-negative and antigen-positivechickens for a period of time,the intoxication anddetoxification in cloaca of antigen-negative
2.2 血浆病毒分离结果 阴性鸡与阳性鸡直接接触65 d,血浆中外源性ALV分离阳性率见表2。由表2可知,采用ELISA、RT-PCR两种方法检测DF-1细胞培养液中外源性ALV,阳性率分别为60.00%、56.67%。其中RT-PCR检测为阴性的1个样品,ELISA检测为阳性;其他样品2种检测方法结果完全吻合。说明ELISA和RT-PCR检测的匹配度很高;阴性鸡与阳性鸡早期密切接触,外源性ALV的感染几率相当高。图2为RT-PCR检测ALV-p27在720 bp处扩增到的特异性条带。

表2 外源性ALV分离阳性率Table 2 The positive rates of exogenous ALV
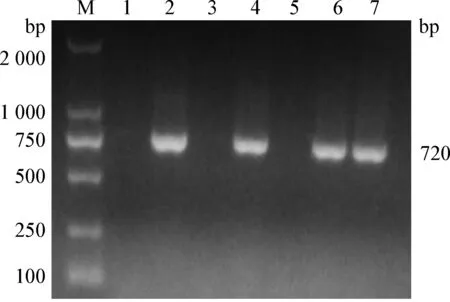
图2 ALV-p27 RT-RCR检测电泳图
Fig.2 ALV-p27 results by RT-RCRM:Marker;1~7:部分样品 M:Marker; 1~7:Some samples
2.3 ALV-J亚型鉴定结果 阴性鸡与阳性鸡直接接触65 d,采用RT-PCR和IFA检测到ALV-J抗原阳性率分别为56.67%和63.33%,结果见表3。图3为RT-PCR检测ALV-J在924 bp处扩增到的特异性条带;图4和图5分别为采用IFA检测ALV- J阴性样品和阳性样品结果。

表3 ALV-J亚型鉴定结果Table 3 The results of ALV-J Subtype identification
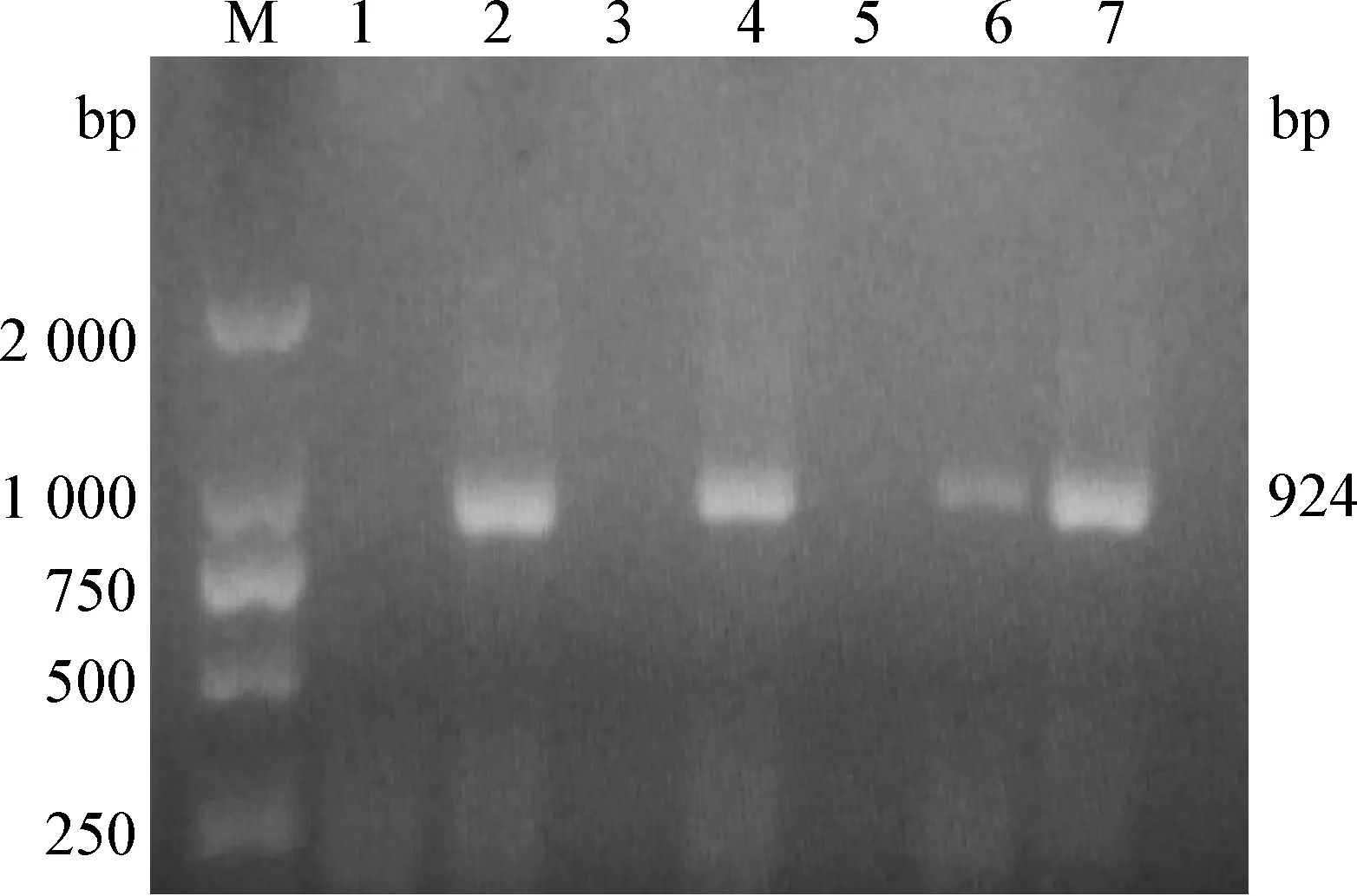
图3 ALV-J RT-RCR检测电泳图
Fig.3 Detection electrophoretic diagram ofALV-J by RT-RCRM:Marker; 1~7: 部分样品 M:Marker; 1~7: Some samples

图4 ALV-J IFA检测阴性样品荧光显微镜(10×10)观察结果
Fig.4 ALV-J results of negative samples by IFAfluorescence microscopy(10×10)
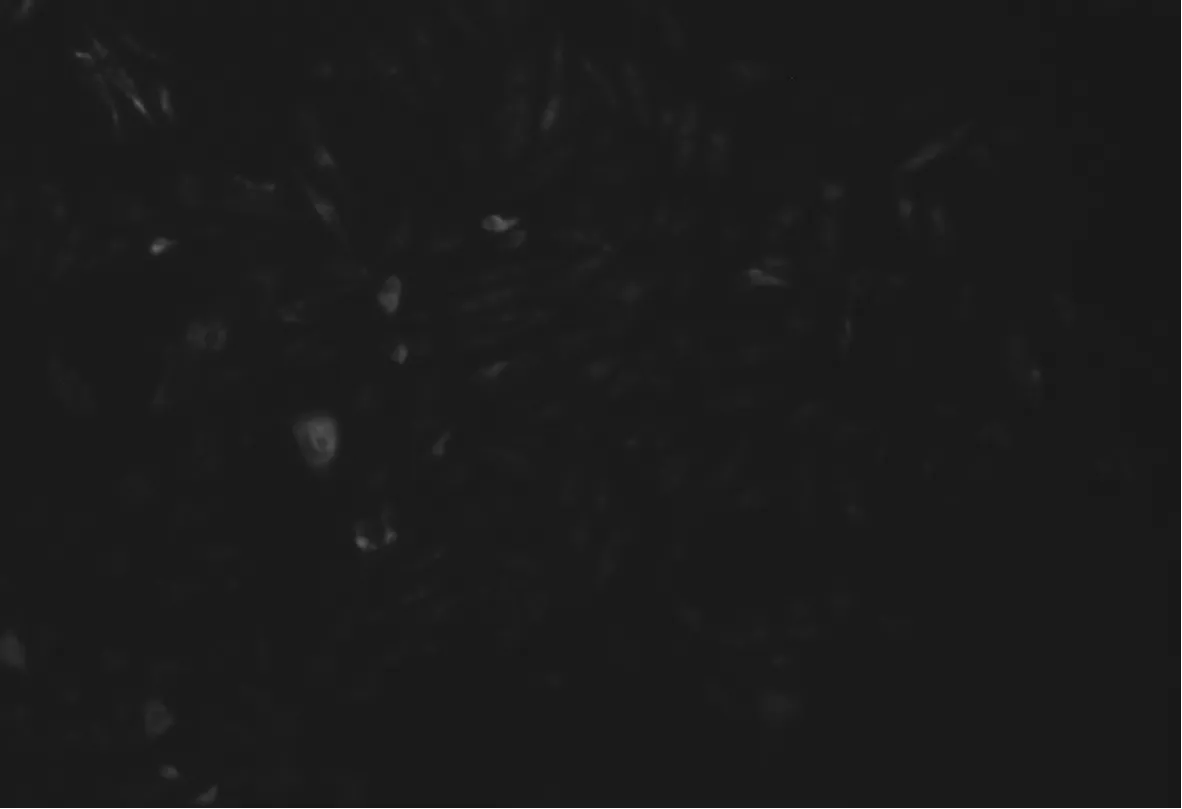
图5 ALV-J IFA检测阳性样品荧光显微镜观察结果(10×10)
Fig.5 ALV-J results of negative samples by IFAfluorescence microscopy(10×10)
2.4 血清中ALV-J抗体检测结果 阴性鸡与阳性鸡直接接触7、15、25、35、45、55、65、75 d和90 d,血清抗体阳性率变化动态见图6。由图6可知,阴性鸡与阳性鸡直接接触7~35 d,阴性鸡血清中一直未检测到ALV-J抗体;45 d ALV-J抗体阳性率为20%,随后ALV-J抗体阳性率逐渐上升,65 d达最高峰为63.33%,65~90 d逐渐降低。
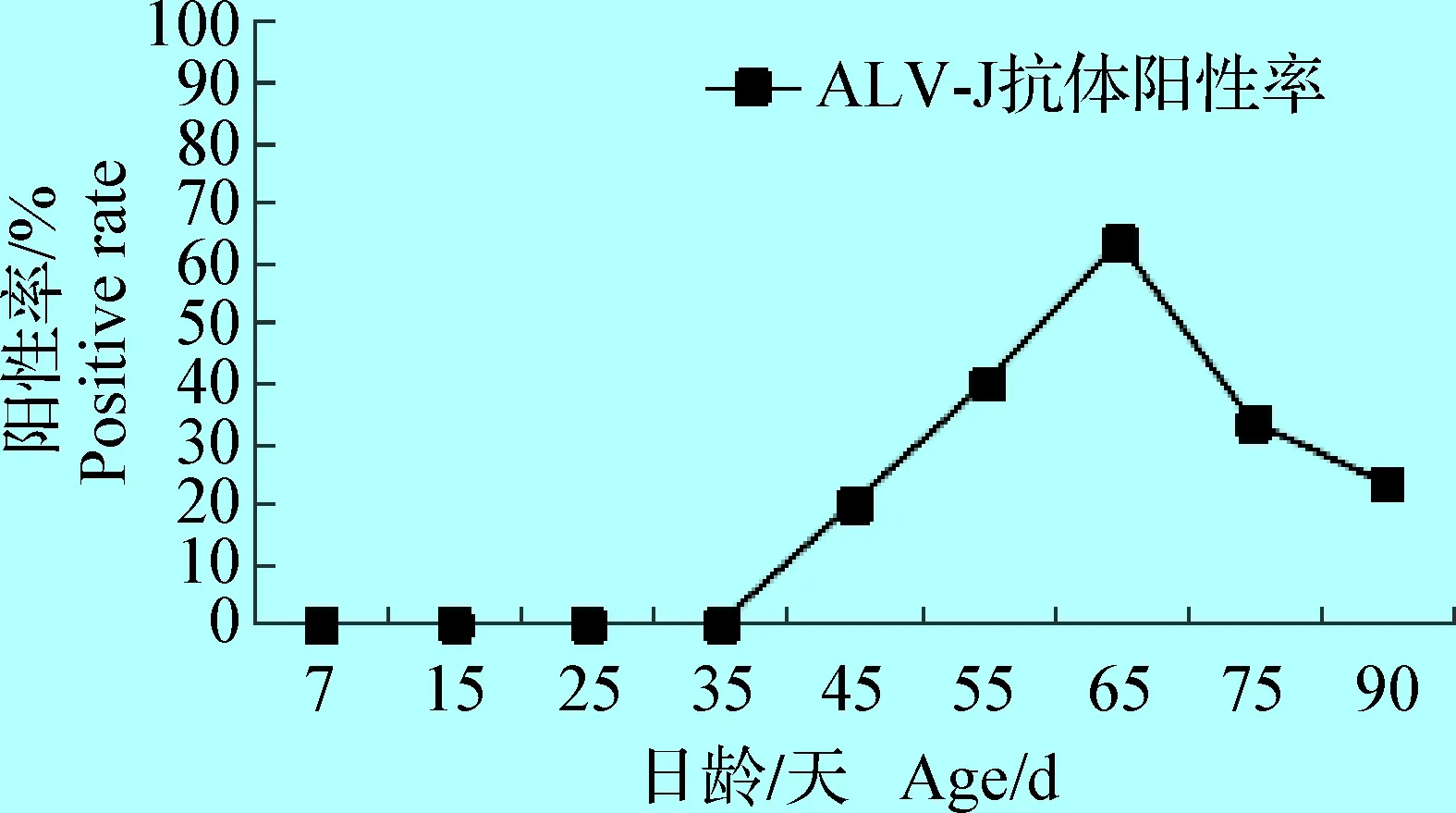
图6 阴性鸡与阳性鸡接触一定时间后抗体产生动态
Fig.6 The serum antibodies of antigen-negativehicken after mixing antigen-negative andantigen-positive chickens for a period of time
3 讨论
本试验结果表明,阴性鸡与感染ALV-J阳性鸡接触15 d,泄殖腔中可检测到ALV-p27抗原,从15~45 d泄殖腔ALV-p27阳性率逐渐增多,65 d阳性率达高峰为50.00%,45~90 d泄殖腔均维持较高的抗原阳性率;65日龄采集阴性鸡血液接种DF-1细胞,利用ELISA、RT-PCR检测到细胞培养液中外源性ALV阳性率分别为60.00%和56.67%;利用RT-PCR和IFA方法检测到细胞培养液中ALV-J抗原阳性率分别为56.67%和63.33%。阴性鸡与感染ALV-J阳性鸡直接接触45 d ALV-J抗体阳性率为20%;随后ALV-J抗体阳性率逐渐上升,65 d达高峰为63.33%。说明阴性鸡与先天感染ALV-J的阳性鸡直接接触混合饲养,通过水平传播被感染外源性ALV的几率相当高,这与许多资料报道的外源性ALV可以通过直接或间接接触从一只鸡传染给其他鸡[16-17]相一致。本试验表明,阴性鸡与阳性鸡直接接触水平传播被感染ALV-J鸡只泄殖腔排毒、血液带毒和抗体产生,65日龄均处于高峰。因此,在开展禽白血病净化时,65日龄左右是检测的一个关键时期。
出雏时,雏鸡之间的紧密接触是ALV横向传播的一种有效传播途径,经垂直传染带有ALV的雏鸡体内病毒粒子具有很高的感染性,可通过胎粪向外排毒,同时雏鸡又有相互啄肛的习惯,导致很高比例的出壳雏鸡被横向传播。老龄鸡的唾液和粪便中也存在感染性病毒粒子,都是ALV水平传播的传染源。
本试验采用ELISA、RT-PCR两种方法检测细胞培养液中的ALV-p27,采用RT-PCR和IFA两种方法检测ALV-J抗原,检测结果符合率相当高。但RT-PCR方法检测到的2个阴性样本IFA方法检测为阳性,这与陈俊霞研究报道IFA检测的灵敏度更高,可检测出一些低滴度的样品,尤其当病毒含量较低时该方法优势更明显相符合[16]。

