H5亚型高致病性禽流感病毒流行特点及其防控
翟新验,刘林青,李 婷,张淼洁,杜 建,张 倩,付 雯,王羽新
(中国动物疫病预防控制中心,北京朝阳100125)
禽流感(Avian influenza,AI)是由A型禽流感病毒(Avian influenza virus,AIV)引起禽类(家禽和野禽)的一种传染性疫病。根据病毒对禽的致病性不同,将其分为高致病性禽流感(Highly pathogenic avian influenza,HPAI)和低致病性禽流感(Low pathogenic avian influenza,LPAI)。依据该病毒外膜血凝素(Haemagglutinin,H)和神经氨酸酶(Neuraminidase,N)蛋白抗原性的不同,AIVs又可分为不同的亚型,其中H5N1、H5N6、H5N8、H7N9等亚型可以引起HPAI。报道第1例家禽HPAI是1878年意大利北部鸡群发生的鸡瘟。1996年,首先在我国广东省家鹅群中分离到了HPAI H5N1病毒(A/goose/Guangdong/1/96,Gs/GD)[1-2],随后,在H5N1 Gs/GD系谱中,逐渐进化发展出10个明显病毒分支和多个亚分支,同时也发生了与其他AIVs的重组[1-2]。世界动物卫生组织(OIE)将HPAI列为必须报告的疫病,我国将其列为一类动物疫病,并采取了强制免疫等综合性预防措施控制HPAI。
1 我国H5亚型HPAI流行情况
1.1 疫情情况 2017-2019年上半年,我国湖南、湖北、内蒙古等11个省、自治区及16个县报告发生16 起H5亚型HPAI疫情,其中13起H5N6和3起H5N1,具体发生情况见表1。发病动物种类涉及到鸡、鸭、鹌鹑等家禽和大雁等野禽,H5N6和H5N1是主要的流行性亚型,且其优势流行毒株亚型的HA分支一直呈现出动态变化的特征,当前优势流行的进化分支主要为2.3.4.4,其次分支是2.3.2.1,并在不断进化之中[3]。
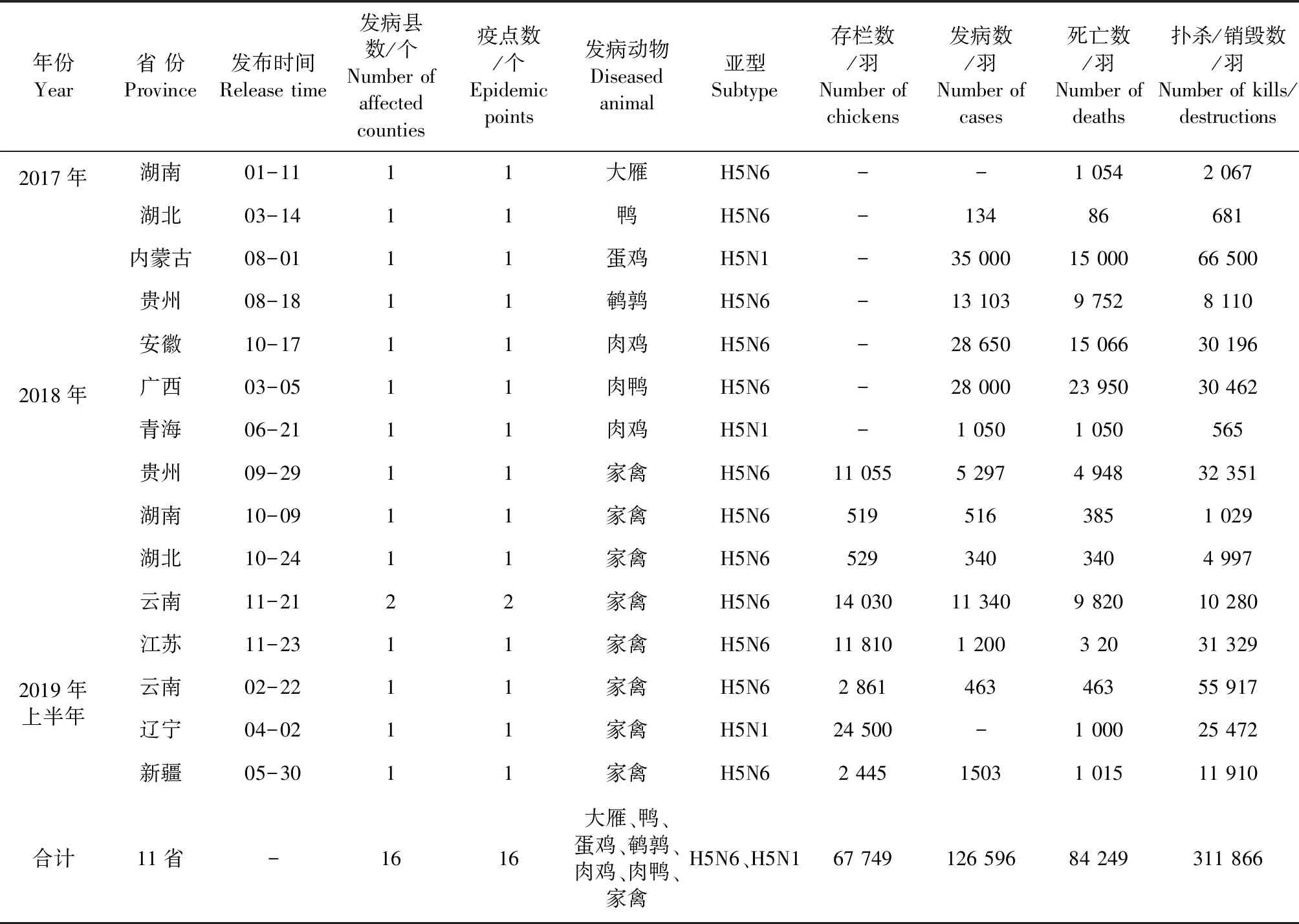
表1 2017-2019年上半年H5亚型HPAI疫情发生情况[4]Table 1 Epidemic situation of H5 subtype HPAI from 2017 to the first half of 2019[4]
1.2 监测情况 2016-2018年,每年在约10万个养殖场(户)、活禽市场、野鸟栖息地等场所开展H5亚型HPAI监测,监测样品约为350万份,其中病原学样品占比约为18%,且从不同监测场点看,各类监测场点均有病原学阳性报告,市场中阳性群体数量较高,总体阳性群体数量由高到低依次是市场、商品代饲养场、散养户、其他场所和种禽场[5]。2018年共监测病原学样品64.12万份,个体阳性率0.08%、群体阳性率0.75%。从历年监测时间节点看,每年冬春季节阳性个体和群体数量较高,夏季较低,但2018年不同时间段个体阳性数量趋于平稳。从不同监测禽种上看,所有监测禽类均有病原学阳性报告,鸡群体阳性数量显著高于其他禽种,鸡、其他禽种近几年有增长趋势,见表2。
2 全球H5亚型HPAI流行情况
根据OIE报告,2013年1月-2018年1月共有68个国家和地区报告至少发生过1次H5亚型HPAI疫情,主要有H5N1、H5N2、H5N3、H5N5、H5N6、H5N8和H5N9共7个亚型。其中欧洲和亚洲是感染H5亚型HPAI最严重的区域,非洲有几个国家感染有H5亚型HPAI,而在美洲,以低致病性为主的H5亚型HPAI只发生在北部地区,中部和南部地区几乎没有[6-10]。表3可知,非洲、美洲、亚洲和欧洲同时存在H5N1、H5N2和H5N8亚型,说明这些亚型病毒具有广泛的地域分布。
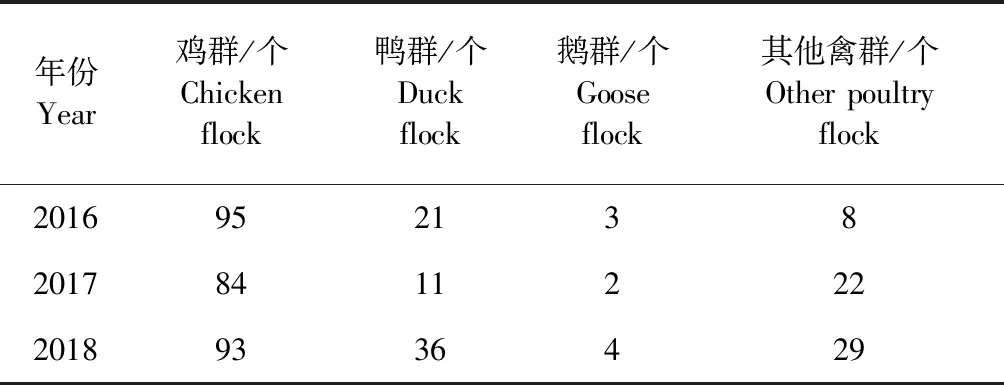
表2 2016-2018年不同禽种H5亚型病 原学阳性群体数量[5]Table 2 Positive flock numbers of H5 subtype pathogen in various poultry species from 2016 to 2018[5]
3 H5亚型进化情况
随着HPAI H5N1病毒的遗传进化和抗原漂移,使得各个病毒株发生了很大变化,从而产生了10个明显的分支[1-2,11]。其中2006年之后,分支2进一步进化形成5个二级分支,2.1分支病毒分离株来自于2003-2007年印度尼西亚家禽和人类宿主;2.2分支病毒分离株来自于2005-2007年东西欧、中东、非洲,以及青海湖和蒙古国发病鸟和人类宿主;2.3分支病毒分离株来自于2003-2006年中国(包括香港)、越南、泰国、老挝及马来西亚家禽和人类宿主的Gs/GD系谱分离株;2.4分支病毒分离株包括:2002-2005年分离于中国云南和广西等省(自治区)的禽流感病毒;2.5分支病毒分离株包括:2003-2004年来自韩国、日本和中国的禽流感病毒分离株,以及2006年在中国广东省汕头市分离的病毒株[2,12]。2008年此类病毒第二级分支进一步分化发展出第三级分支,2011年后一、二、三级分支又逐步拓展形成二、三、四级分支[2,11-12]。

表3 2013年1月-2018年1月家禽中HPAI H5 亚型病毒区域分布[6]Table 3 Regional distribution of HPAI H5 subtype virus in poultry from January 2013 to January 2018[6]
通常情况下,所有H5Nx病毒在HA1和HA2间HA裂解位点共有-RRRKR/G-多碱基氨基酸序列,并认为带有此多碱基氨基酸序列的H5Nx病毒都是高致病性的[2,7,13]。2015年WHO/FAO/OIE H5进化工作组重新确定了2.3.4.4分支作为统一的H5Nx病毒的分类,包括H5N1、H5N2、H5N3、H5N5、H5N6、H5N8[2,9,14]。有研究报道,利用分子时钟分析病毒的系统发育关系和时间演化历史,将H5Nx病毒分为四群(A-D),2.3.4.4 A群主要包括:来自2014年初中国和韩国、日本、中国台湾、加拿大、欧洲国家和北美的H5N8亚型病毒,北美的H5N1和H5N2亚型病毒,以及中国台湾的H5N2和H5N3亚型病毒;2.3.4.4 B群主要包括:来自2013年中国和2014年韩国H5N8亚型病毒、2017-2018年韩国的H5N6亚型病毒、2016-2017年德国的H5N5和H5N8亚型病毒;2.3.4.4 C群主要包括:来自2013-2014年中国和老挝以及2016-2017年韩国的H5N6亚型病毒、2014年越南和中国的H5N1亚型病毒;2.3.4.4D群主要包括来自2013-2014年在中国和越南发现的H5N6亚型病毒[2-3,15-16]。
由此可知,HPAI H5亚型病毒早期分离株Gs/GD通过不断地遗传进化和抗原漂移,逐渐形成了10个病毒分支,每一个分支的病毒株又都分化发展出不同的亚分支,但都具有共同的-RRRKR/G-多碱基氨基酸序列。分支2的进化就是一个很好的例证,分支2有5个二级分支,各个二级分支病毒都有一定的代表分离株,且又逐渐分化出三级、四级分支,2.3.4.4分支就分为4个群,且每个群分布还具有一定的区域性。
4 防控建议
AIVs不仅感染禽等多种动物,而且具有公共卫生意义。目前,HPAIV H5亚型2.3.4.4分支的毒株,如H5N1、H5N2、H5N6等同时存在于我国广大禽群,并已逐渐发展成为优势流行毒株,且其流行范围不断扩大,明显增加了与当地其他流行的亚型AIVs发生重组的概率, 同时病毒对哺乳动物致病力也在发生变化[2-3,17]。加之,HPAIV H5亚型2.3.2.1分支的毒株也依然在传播和流行[18],更是加大了禽流感控制工作的难度,为此,建议从以下几方面做好防控工作。
4.1 加强风险环节监测 多年来,在活禽市场多种禽类中检测出了AI病原,市场中活禽种类和来源复杂,运输过程应激反应以及市场管理水平参差不齐,极易造成病毒的大范围传播,因此需持续关注市场中多种禽类的带毒情况。由于鸭群感染AIVs后,可呈现隐性带毒状态,鸭中检测发现HPAIV毒株的情况值得重视。世界候鸟迁徙路线中东非-西亚、中亚、东亚-澳大利亚迁徙线经过我国[17],鸟类携带病毒风险依然很大,要加强野鸟栖息地等鸟类监测。
4.2 开展病原特性研究 AIVs具有遗传多样性并一直处于不断的进化发展过程中,其病原致病力及抗原特性也具有复杂性,在家禽和野鸟中监测到多个HA进化分支的病毒,并且低致病性毒株和高致病性毒株同时存在,极易发生重组和突变,跟踪研究并分析AIVs遗传变异情况、基因多态性分布及其与病毒致病性和免疫原性之间的关系,了解并掌握优势流行毒株与疫苗毒株的匹配性等。
4.3 持续做好免疫工作 我国对HPAI采取免疫为主的综合防控策略,按照《国家高致病性禽流感免疫方案》,结合各地实际情况,制定科学HPAI免疫程序,合理选择疫苗、冷链运输、规范接种,开展免疫效果监测和评价。尤其要加强鸭、鹅等水禽的免疫及其抗体水平检测,适时调整优化免疫程序,确保免疫成效。
4.4 落实生物安全措施 生物安全是养殖过程中采取的一系列预防和控制疫病发生的综合性技术和管理措施。可以通过在远离养禽场、屠宰厂、活禽交易市场、无害化处理厂等高风险场所建场;办公区和生产区分开,根据禽生长阶段实施分区或分禽舍管理并做到全进全出,净道与污道分开,采用全封闭鸡舍,保持通风、换气和温控设备良好;保持场区卫生清洁,实现雨污分离,具备有效的预防鼠、防虫媒、防犬猫、防鸟进入的设施或是措施;建立病死动物和粪污无害化处理制度;严格控制人员、车辆、物品和动物的流动,并执行良好的消毒管理;从有良好信用和声誉的种禽场引进禽只,并实施隔离观察;开展采样监测和疫病净化等措施。

