GANT61对髓母细胞瘤Daoy细胞增殖、凋亡的影响及作用机制△
卢恩敏,卢恩娟,高丽京,裴立静,王庆艳
1唐山市丰润区人民医院儿科,河北 唐山 063000
2唐山市丰润区第二人民医院儿科,河北 唐山 063000
髓母细胞瘤(medulloblastoma,MB)是儿童中最常见的中枢神经系统肿瘤[1]。目前的治疗手段主要是以手术和放化疗结合为主,术后患者生存率低,且多数患者常伴随长期的放化疗不良反应[2-3]。目前尚无针对性的治疗药物,研究MB发病的分子机制,探索可用于MB治疗的分子生物学靶点,实现MB的靶向治疗,对改善患者预后具有重要意义。音猬因子(sonic hedgehog,SHH)信号通路在胃癌、淋巴癌等多种肿瘤组织中异常激活,与肿瘤的增殖和转移密切相关[4],GANT61是SHH信号通路特异性的抑制剂[5]。本研究通过向人MB Daoy细胞中加入不同浓度的GANT61,观察其对细胞凋亡标志物胱天蛋白酶3(caspase 3)、细胞周期标志物p21和细胞周期蛋白D1(cyclin D1)及SHH信号通路下游的核转录因子GLI家族锌指蛋白 1(GLI family zinc finger 1,GLI1)和 GLI家族锌指蛋白 2(GLI family zinc finger 2,GLI2)的影响,旨在为临床治疗MB提供新的思路,现报道如下。
1 材料与方法
1.1 材料
人MB Daoy细胞株购自美国模式菌种收集中心(American Type Culture Collection,ATCC)。GANT61购自美国Abcam公司。相差显微镜购自德国Leica公司,多功能酶标仪购自美国Thermo Fisher Scientific公司,聚合酶链反应(polymerase chain reaction,PCR)仪购自苏州东胜兴业科学仪器有限公司,凝胶成像装置、电泳仪电源、转膜装置均购自上海天能科技有限公司。二甲基亚砜(dimethyl sulfoxide,DMSO)和噻唑蓝(thiazolyl blue tetrazolium bromide,MTT)均购自上海恒斐生物科技有限公司;β-肌动蛋白(β-actin)抗体购自武汉三鹰生物技术有限公司,cyclin D1抗体购自美国CST公司,p21、caspase 3抗体均购自美国Abcam公司。BCA蛋白浓度测定试剂盒和碘化丙啶(propidium iodide,PI)染料均购自上海碧云天生物技术有限公司。MiniBEST Universal RNA Extraction Kit购自日本TaKaRa公司,TaqMan Small RNA Assays试剂盒购自美国Life公司。
1.2 细胞培养
从液氮罐中取出人MB Daoy细胞后,置于37℃水浴锅中复苏细胞。离心去除冻存液(胎牛血清∶DMSO=9∶1)后接种至含有10%胎牛血清、1%青霉素/链霉素的RPMI-1640培养液中,于5%CO2、37℃无菌培养箱中培养细胞。每隔1天换1次液。每隔2~3天传代1次。
1.3 实验分组
细胞在正常状态下培养24 h后进行分组,共分为4组。A组:培养液中加入0.1%DMSO;B组:培养液中加入10 μmol/L GANT61 和0.1%DMSO;C组:培养液中加入20 μmol/L GANT61和0.1%DMSO;D组:培养液中加入40 μmol/L GANT61和0.1%DMSO。
1.4 MTT 法检测细胞增殖
分别于4组细胞培养0、24、48 h后,吸出培养基,加入含5 mg/ml MTT的新鲜DMEM培养基100 μl,37℃恒温条件下继续培养4 h,应用酶标仪于570 nm波长处检测各孔的光密度(optical density,OD)值。
1.5 实时定量PCR检测GLI1mRNA、GLI2mRNA的相对表达量
采用TaKaRa MiniBEST Universal RNA Extraction Kit提取细胞中的RNA,然后按照TaqMan Small RNA Assays说明书合成cDNA。以cDNA为模板进行实时定量PCR。反应条件:95℃5 min;95 ℃ 30 s,60 ℃ 20 s,72 ℃ 20 s,共40个循环。GLI1mRNA上游引物为5'-CAGGGAGGAAAGCAGACTGAC-3',下游引物为5'-GGCTTGGCTGTGGCTTCA-3';GLI2mRNA上游引物为5'-CAACCAGAACAAGCAGAGCA-3',下游引物为5'-ACCTCAGCCTCCTGCTTACA-3'。以β-actin为 内参,采用2-△△Ct法计算GLI1mRNA、GLI2mRNA的相对表达量。△△Ct=(Ct目的基因-Ct内参基因)实验组-(Ct目的基因-Ct内参基因)对照组。
1.6 蛋白质印迹法(Western blot)检测cyclin D1、p21、caspase3蛋白的表达情况
加入适量RIPA裂解液裂解细胞,低温离心,取上清液采用BCA试剂盒进行蛋白定量,配制10%十二烷基硫酸钠-聚丙烯酰胺凝胶,电泳至溴酚蓝跑出胶面,转膜,5%脱脂牛奶室温封闭,一抗4℃孵育过夜,二抗室温孵育2 h,电化学发光法曝光显影,以β-actin为内参,进行半定量分析。
1.7 流式细胞术检测细胞周期
4组细胞培养72 h后,磷酸盐缓冲液(phosphate buffered saline,PBS)洗涤细胞,胰蛋白酶消化,收集细胞制成单细胞悬液,70%乙醇固定6 h,加入l ml PI后于4℃冰箱中染色30 min,上机检测每组样本的DNA含量。应用MuticycleAV分析软件对每组样本的细胞周期进行拟合分析。
1.8 统计学分析
采用SPSS 21.0软件对数据进行统计分析,符合正态分布的计量资料以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 细胞增殖情况的比较
培养24 h后,C组和D组细胞的OD值均低于A组,差异均有统计学意义(P<0.05);培养48 h后,C组和D组细胞的OD值均低于A组,D组细胞的OD值低于B组和C组,差异均有统计学意义(P<0.05)。(表1)
表1 培养0、24、48 h后4组细胞增殖情况的比较(±s)

表1 培养0、24、48 h后4组细胞增殖情况的比较(±s)
注:a与A组比较,P<0.05;b与B组比较,P<0.05;c与C组比较,P<0.05
组别A组B组C组0.103±0.014 0.112±0.025 0.103±0.035 0.553±0.039 0.443±0.014 0.352±0.130a 0.761±0.121 0.552±0.121 0.364±0.014a D组OD值0 h 0.113±0.014 24 h 0.235±0.043a 48 h 0.140±0.013a b c
2.2 GLI1mRNA、GLI2mRNA 相对表达量的比较
4组细胞中GLI1mRNA、GLI2mRNA的相对表达量比较,差异均有统计学意义(P<0.01)。C组和D组细胞中GLI1mRNA和GLI2mRNA的相对表达量均低于A组,D组细胞中GLI1mRNA和GLI2mRNA的相对表达量均低于B组,差异均有统计学意义(P<0.05)。(表2)

表2 4组细胞中GLI1 mRNA、GLI2 mRNA相对表达量的比较
2.3 cyclin D1、p21、caspase3蛋白表达情况的比较
4组细胞中cyclin D1、p21、caspase 3蛋白表达水平比较,差异均有统计学意义(P<0.01)。C组和D组细胞中cyclin D1蛋白表达水平均低于A组和B组,p21、caspase 3蛋白表达水平均高于A组和B组,差异均有统计学意义(P<0.05)。(表3)
表3 4组细胞中cyclin D1、p21、caspase 3蛋白表达水平的比较(±s)
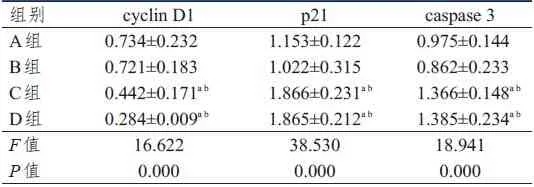
表3 4组细胞中cyclin D1、p21、caspase 3蛋白表达水平的比较(±s)
注:a与A组比较,P<0.05;b与B组比较,P<0.05
组别A组B组C组D组F值P值cyclin D1 0.734±0.232 0.721±0.183 0.442±0.171a b 0.284±0.009a b 16.622 0.000 p21 1.153±0.122 1.022±0.315 1.866±0.231a b 1.865±0.212a b 38.530 0.000 caspase 3 0.975±0.144 0.862±0.233 1.366±0.148a b 1.385±0.234a b 18.941 0.000
2.4 细胞周期分布情况的比较
B组、C组和D组中G0/G1期细胞比例均高于A组,G2/M期细胞比例均低于A组,差异均有统计学意义(P<0.05);C组和D组中G0/G1期细胞比例均高于B组,差异均有统计学意义(P<0.05)。(表4)
表4 4组细胞中细胞周期分布情况的比较(%,±s)

表4 4组细胞中细胞周期分布情况的比较(%,±s)
注:a与A组比较,P<0.05;b与B组比较,P<0.05
组别A组B组C组D组F值P值43.816±5.873 56.653±6.810a 58.355±8.922a b 60.383±7.134a b 10.592 0.000 35.453±2.534 33.342±3.210 30.564±5.376 31.223±6.341 2.291 0.095 20.423±4.223 10.726±4.645a 10.544±1.637a 8.326±2.134a 24.924 0.000 G0/G1期S期G2/M期
3 讨论
MB严重影响着世界儿童的健康,每年死亡人数约达10万,但是具体的发病机制仍不清楚[6]。研究发现,SHH信号通路的上下游出现异常激活均可导致肿瘤的发生发展。SHH信号通路在胃癌中过度激活与胃癌的发展及转移相关,SHH信号通路抑制剂可降低胃癌细胞的侵袭能力[7]。GLI1和GLI2是SHH信号通路下游的核转录因子,发挥关键的转录激活作用,在肿瘤中表达升高并参与肿瘤的发生发展[8]。研究表明,GLI的特异性抑制剂GANT61可抑制胶质母细胞瘤中的SHH信号通路,对胶质母细胞瘤的细胞周期调控和细胞增殖具有重要影响[9]。细胞周期调控及细胞凋亡与肿瘤的发生发展密不可分,细胞周期调控失常可导致肿瘤细胞的增殖能力增强。cyclin D1基因位于人染色体11q13,是细胞周期蛋白家族成员之一。cyclin D1是调控细胞周期的重要蛋白,在正常组织中低表达或不表达,在许多组织的癌变过程中,可检测到cyclin D1的表达上调,它是评价肿瘤发生发展及转移的重要指标。目前认为,cyclin D1是调控G期至S期最关键的细胞周期蛋白,细胞周期抑制蛋白p21可抑制cyclin D1的活性,从而导致细胞周期阻滞[10-11]。细胞凋亡是多基因多阶段严格调控的过程。caspase 3是半胱氨酸蛋白酶家族成员之一,是细胞凋亡的标志性蛋白,能够反映细胞的凋亡水平。有研究表明,caspase 3可以被cyclin D1、p21、GLI1激活,caspase 3被激活后,可使细胞核及细胞骨架中的重要蛋白酶失活,诱导凋亡小体形成,促进细胞凋亡[12-15]。
本研究结果显示,GANT61可显著抑制人MB Daoy细胞的生长,具有抑制MB细胞增殖的作用。进一步研究发现,GANT61能够抑制SHH信号通路下游的关键靶点GLI1和GLI2mRNA水平。Western blot结果显示,GANT61对细胞周期的关键蛋白cyclin D1有下调作用,对于p21及caspase 3有上调作用,说明GANT61具有阻滞细胞周期和促进细胞凋亡的作用。进一步研究GANT61对MB细胞周期的阻滞作用,结果发现,与单独应用DMSO相比,GANT61可阻滞更多肿瘤细胞于G0/G1期。本研究推测GANT61调控细胞周期和抗肿瘤的机制可能主要是通过抑制GLI1mRNA和GLI2mRNA水平进而影响cyclin D1、p21、caspase 3蛋白表达来实现。
综上所述,GLI1抑制剂GANT61对MB细胞具有抑制细胞增殖和促进细胞凋亡的作用,主要是通过调节GLI1和GLI2的mRNA水平进而影响cyclin D1、p21、caspase 3蛋白表达来实现。目前的研究结果提示,GANT61有望成为临床治疗MB的新药物。

