超声造影在乳腺癌转移性前哨淋巴结诊断中的应用价值
陈灵丽,张社芳,陈国超
义马煤业集团股份有限公司总医院超声科,河南 三门峡 472300
乳腺癌作为全球女性常见且高发恶性肿瘤之一,发病率呈逐年上升趋势,但随着早期诊疗技术的不断完善,疾病控制率、病死率、总体生存时间等均得到较好控制[1]。多项研究证实,乳腺癌患者的预后不仅与分化程度和病理学类型有关,还与区域淋巴结转移情况密切相关,腋窝淋巴结作为乳腺癌的重点关注部位,其在临床诊断及预后评估中均具有重要作用[2-4]。腋窝淋巴结清扫术是诊断乳腺癌患者腋窝淋巴结转移情况的金标准,但手术范围相对较大、并发症相对较多,随外科手术技术的不断完善,前哨淋巴结活检已经逐步替代了淋巴结清扫术,成为现阶段乳腺癌腋窝淋巴结转移的常见预测方法之一。近年来,超声诊断技术不断发展,在乳腺、腋窝、甲状腺等检查中优势明显,成为目前前哨淋巴结转移常见的检查手段之一,但常规二维超声检查的灵敏度和特异度均较低。金利芳等[5]研究发现,超声造影可明显弥补常规超声在前哨淋巴结诊断中的缺陷。本研究探讨超声造影在乳腺癌转移性前哨淋巴结诊断中的应用价值,现报道如下。
1 资料与方法
1.1 一般资料
选取2016年1月至2019年12月河南省义马煤业集团股份有限公司总医院收治的乳腺癌患者。纳入标准:①均经组织病理学确诊,符合《2008年NCCN乳腺癌临床实践指南(中国版)解读》[6]中乳腺癌诊断及分期标准;②术前均接受常规超声和超声造影定位腋窝前哨淋巴结,且诊断信息完整;③检查前均未接受放疗、化疗、内分泌治疗等抗肿瘤治疗;④均为单侧肿瘤,检查前生命体征平稳,检查耐受性良好。排除标准:①过敏体质,对造影剂已知成分过敏;②合并重要脏器(心、肝、肾等)损害、自身免疫系统缺陷、其他恶性肿瘤等;③合并精神疾病;④转移性乳腺癌;⑤既往存在肿瘤及淋巴区域手术史。依据纳入和排除标准,本研究共纳入102例乳腺癌患者,乳腺癌根治手术前均接受常规超声和超声造影定位腋窝前哨淋巴结,年龄22~65岁,平均年龄为(48.23±10.37)岁;肿块直径8~51 mm,平均肿块直径(24.27±8.36)mm;肿瘤部位:左侧48例,右侧54例;病理类型:浸润性导管癌84例,黏液癌9例,导管原位癌5例,其他4例;临床分期:Ⅰ期49例,Ⅱ期53例。
1.2 检查方法
采用Philips iU22型超声诊断仪对所有患者进行检查,该仪器支持超声造影,探头为L12-5高频线阵探头,机械指数为0.08;微泡造影剂为注射用六氟化硫微泡,配置方案为白色冻干粉+5 ml生理盐水,充分震荡后形成微气泡息浮液。常规超声:患者仰卧位,背部以软垫固定,完全暴露患侧胸部及腋窝,上肢取外旋外展位。以患侧乳头为中心,分别对乳腺各象限进行横切、纵切、斜切扫描,充分观察其腋窝淋巴结、肿块情况,包括位置、边界、大小、形态、血流情况、内部回声(皮质是否增厚)及周围边界关系等。转移性淋巴结诊断标准(≥2项即可):①淋巴纵横比<2;②淋巴结皮质为向心或偏心宽阔型;③淋巴结内部存在不均匀回声;④淋巴门结构疏松或消失。超声照影:患者仰卧位,背部以软垫固定,完全暴露患侧胸部及腋窝,患侧上肢外旋外展位,将患者乳晕区域麻醉后取造影剂2 ml,分别于患侧乳晕区域3、6、9、12点处进行皮下注射,每处0.5 ml,适当按摩注射部位(10~30 s)同时启动造影系统。沿注射部位向腋窝处扫描,待发现淋巴管显影后沿此追踪,并将首个增强淋巴结认定为前哨淋巴结,若出现多条淋巴管显示时,分别将沿各淋巴追踪发现的首个淋巴结均认定为前哨淋巴结;待探头扫清病灶后,分别在乳腺3、6、9、12点处皮下注射0.5 ml的1%亚甲兰注射液,探测前哨淋巴结,其中转移性淋巴结为低回声增强或灌注性缺损。
所有患者均于超声造影结束后4 h内进行前哨淋巴结活检,患者仰卧位并将患侧上肢外展90°,常规游离皮瓣后分别对周围组织实施乳腺癌改良根治术,再解剖已染蓝的前哨淋巴结,并送病理检查,由病理科医师检查完成后,继续进行乳腺癌改良根治术。
1.3 观察指标
所有患者均以病理诊断结果为“金标准”,记录所有患者的超声造影和常规超声检查结果,分析两种诊断方式与病理学诊断结果的一致性,比较两种检查方式对乳腺癌转移性前哨淋巴结的诊断效能。灵敏度=真阳性例数(/真阳性例数+假阴性例数)×100%,特异度=真阴性例数(/真阴性例数+假阳性例数)×100%,阳性预测值=真阳性例数/(真阳性例数+假阳性例数)×100%,阴性预测值=真阴性例数(/真阴性例数+假阴性例数)×100%,准确度=(真阳性例数+真阴性例数)/总例数×100%。
1.4 统计学方法
采用SPSS 17.0软件对所有数据进行-统计学分析,正态分布计量资料以均数±标准差(±s)表示,比较采用t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验;等级资料的比较采用秩和检验;采用受试者工作特征(receiver operating characteristic,ROC)曲线和曲线下面积(area under the cure,AUC)比较超声造影和常规超声检查对乳腺癌前哨淋巴结转移情况的诊断效能,两种检查方法的一致性采用Kappa值,Kappa>0.4表示两种诊断方式存在一致性,Kappa>0.75表示一致性较高。以P<0.05为差异有统计学意义。
2 结果
2.1 超声造影和常规超声检查对乳腺癌前哨淋巴结转移的诊断价值
病理检查结果显示,102例乳腺癌患者中前哨淋巴结133枚,其中非转移性淋巴结78枚,转移性淋巴结55枚。(表1)

表1 超声造影和常规超声检查诊断乳腺癌前哨淋巴结转移的结果与病理学检查结果的对照
2.2 超声造影和常规超声对乳腺癌前哨淋巴结转移情况的诊断效能
超声造影诊断乳腺癌转移性前哨淋巴结的灵敏度、特异度、阳性预测值、阴性预测值和准确度均高于常规超声,差异均有统计学意义(P<0.05),其中超声造影与病理学诊断结果的一致性较高(Kappa=0.829),常规超声与病理学诊断结果的一致性较低(Kappa=0.549)。超声造影诊断乳腺癌前哨淋巴结转移情况的AUC为0.913(95%CI:0.856~0.971),高于常规超 声的 0.744(95%CI:0.689~0.859),差异有统计学意义(Z=4.491,P<0.05)。(表2、图1)
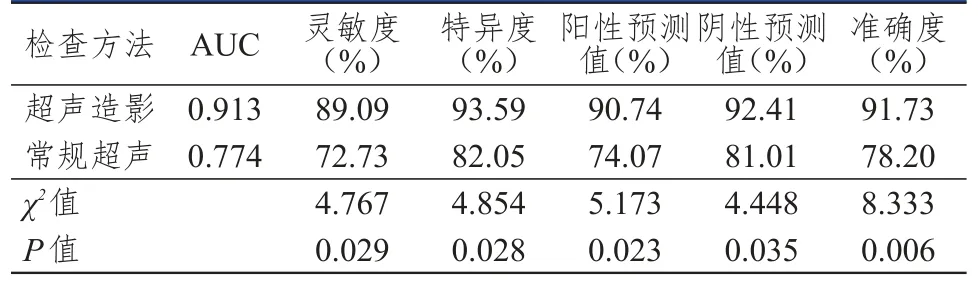
表2 超声造影和常规超声对乳腺癌前哨淋巴结转移情况的诊断价值
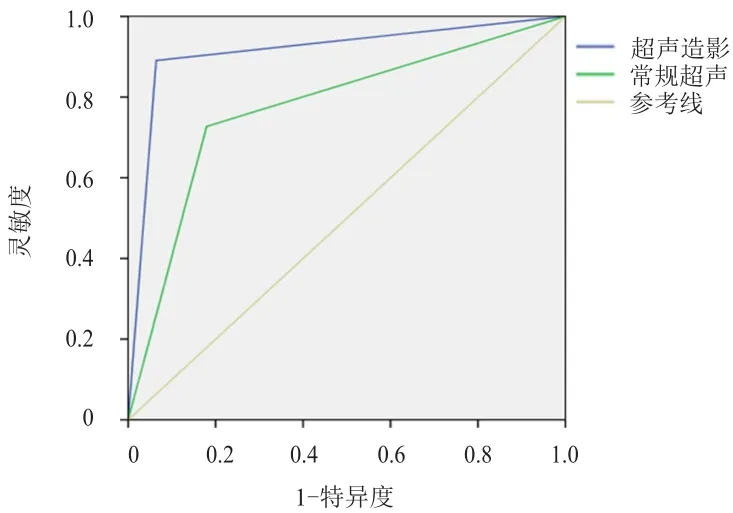
图1 超声造影和常规超声诊断乳腺癌前哨淋巴结转移情况的ROC曲线
3 讨论
乳腺癌前哨淋巴结是原发肿瘤引流首站淋巴结,其组织病理状态可代表整个腋窝淋巴结的状态,因此,前哨淋巴结活检对乳腺癌患者进一步治疗发挥重要作用[7-9]。前哨淋巴结活检的顺利实施,需要精准的术前定位和精确的病理诊断结果相配合,传统检查手段多为放射性同位素和染料法,放射性同位素价格昂贵、降解困难,且易进入二级淋巴导致标记的淋巴结数量多于实际;染料法作为一项有创检查,需对患者淋巴网进行解剖,部分患者会出现过敏反应,导致注射部位坏死[10-11]。超声作为一项无创的影像学检查手段,具有操作简单、价格低廉、实时动态等优势,同时还能全方位多角度的探查腋窝淋巴结情况,使其在前哨淋巴结诊断中具有一定的优势[12]。
乳腺癌细胞转移主要经输入淋巴达皮质,沉积于背膜下淋巴窦,再经副皮质进入淋巴门,使其在超声检查下呈局部皮质隆起、偏心性皮质增厚的特点,且随疾病进展,淋巴门逐渐转为完全消失,超声显示圆形低回声改变。多项研究结果发现,超声在转移性腋窝淋巴结诊断中具有较好的特应性,但因淋巴结微转移、仪器限制等,导致该方法检测灵敏度相对较差[13-15]。随着医学影像学技术地不断发展,超声造影逐渐应用于临床,该技术是在常规超声的基础上利用造影剂进行组织成像,通过微泡造影剂特性进行组织微血管成像,进而准确评估淋巴结转移情况[16-17]。
本研究结果显示,超声造影诊断乳腺癌转移性前哨淋巴结准确度明显高于常规超声,且灵敏度、特异度、阳性预测值、阴性预测值均较高,与徐雪峰[18]研究结果基本一致。本研究还将两种检查方式与病理学检测结果的一致性进行分析,结果发现,超声造影与病理学诊断结果的一致性较高(Kappa=0.829),且经ROC曲线分析发现,超声造影诊断乳腺癌前哨淋巴结转移情况的AUC为0.913,高于常规超声的0.744,表明超声造影对乳腺癌前哨淋巴结转移情况的诊断价值较高。微淋巴丛重叠疏松,多为无平滑肌内皮细胞组成,超声造影是将微泡造影剂经乳晕注射,可快速流入淋巴管,并沿淋巴管引流路径到达前哨淋巴结[19-20]。因此,超声造影可准确定位前哨淋巴结,动态实时观察显影淋巴管、增强淋巴结,操作简单且重复性较好。
综上所述,术前超声造影可准确定位乳腺癌患者的腋窝前哨淋巴结,其对转移性前哨淋巴结诊断准确性、灵敏度、特异度、阳性预测值、阴性预测值和准确度均高于常规超声,且检测一致性较好,具有较高的临床应用价值。
——中国居民收入分配中的逆向调节机制

