基于IL-33/ST2信号通路的茯苓多糖调控溃疡性结肠炎大鼠肥大细胞活化的机制研究
梁桐尔 刘杨洋 王 烜
(西南医科大学附属医院全科医学科,泸州 646000)
溃疡性结肠炎(ulcerative colitis,UC)是一种累及结直肠的非特异性炎症性肠病,主要表现为持续、反复腹泻,排黏液性脓血便,腹痛等症状[1]。UC发病因素较为复杂,目前认为其发病可能与感染、免疫、精神等多种因素相关,而免疫因素被认为是主要因素。肥大细胞(mast cells,MC)是一种主要分布于结缔组织和黏膜上皮的重要免疫细胞,其胞质含有嗜碱性颗粒[2]。应激状态下,MC可通过脱颗粒释放多种炎症因子,如TA、IL-6等[3]。UC发生过程中,IL-33/ST2信号通路协同IgE介导MC的脱颗粒效应,促进炎症因子的释放,启动炎症级联反应[4]。目前西医治疗UC主要采用糖皮质激素、免疫抑制剂等药物,但其易引起腹泻、腹痛、恶心、呕吐等不良反应。研究报道茯苓多糖具有增强巨噬细胞、淋巴细胞等免疫细胞活性的作用,但其与IL-33/ST2信号通路的研究目前尚未见报道[5]。本研究通过建立UC大鼠模型,给予茯苓多糖灌胃治疗,探讨茯苓多糖对UC大鼠MC活化的作用机制及对IL-33/ST2信号通路的影响,以期为更合理有效治疗UC大鼠,减少治疗带来的不良反应奠定理论基础。
1 材料与方法
1.1材料
1.1.1实验动物 SPF级SD大鼠90只由北京大学医学院实验动物中心提供,合格证号:SYXK(京)2018-0013,体质量(180±40)g。严格按照实验动物饲养管理规定饲养,温度18~28℃,湿度 40%~70%。
1.1.2主要仪器与试剂 茯苓多糖购自江方格药业有限公司;柳氮磺胺吡啶片(SASP)购自上海信宜天平药业有限公司;2,4,6-三硝基苯磺酸(TNBS)购自上海西格玛奥德里奇公司;RNA提取试剂盒、反转录试剂盒、荧光定量PCR试剂盒购自Promega公司;IL-33、IL-5、IL-13、IL-4、IL-6 ELISA试剂盒购自上海广锐生物科技有限公司;4%多聚甲醛、蛋白酶抑制剂、RIPA裂解液购自罗氏公司;IL-33、ST2单克隆抗体购自CST公司;Anti-beta-Actin、辣根过氧化物酶标记二抗(HRP)购自北京博奥森生物技术有限公司;荧光定量PCR仪购自美国Bio-Rad公司;Olympus BH2显微镜购自日本Nikon公司;匀浆机、微量移液枪购自德国 Eppendorf公司;电泳仪购自北京六一生物科技有限公司。
1.2方法
1.2.1动物模型的制备 对照组15只,大鼠适应性喂养1周后,除对照组外剩余75只大鼠均建立UC大鼠模型[6]。造模前大鼠禁食24 h,麻醉大鼠后在大鼠肛门处缓慢插入橡胶管约8 cm至结肠,每只大鼠以100 mg/kg注入5%的TNBS与乙醇1∶1 的混合溶液,灌入后倒置大鼠约30 s防止灌注液倒流,随即平放大鼠至自然清醒,造模后观察大鼠情况,至第2天大鼠出现排泄稀烂便、甚至出现精神萎靡、脓血便及活动减少等症状,说明造模成功。对照组大鼠同采用体积的生理盐水灌肠。
1.2.2动物分组与给药 对照组15只,其余75只UC大鼠造模成功后按照随机数字表法分为模型组、茯苓多糖低剂量组、茯苓多糖中剂量组、茯苓多糖高剂量组、SASP组(阳性对照组),每组均15只。参考文献[7]灌注药物,分组后茯苓多糖低、中、高剂量组按照每天5 mg/kg、100 mg/kg、200 mg/kg,SASP组300 g/kg SASP灌胃,对照组、模型组每天灌胃生理盐水10 ml/kg,连续治疗14 d。
1.2.3大鼠一般情况的观察 各组大鼠在试验期间均无死亡,分别于分组后、治疗结束时称量体质量,实验期间常规监测大鼠的饮食、嗜睡、懒动、毛色、大小便等情况。并观察大鼠疾病活动度,对大鼠进行疾病活动指数(DAI)评分,定期观察大鼠体质、大便隐血、大便性状情况,按照0~4分进行评分,DAI=体质量下降百分比评分+大便隐血/便血评分+大便性状评分。
1.2.4样品的采集 各组动物灌胃14 d后,乙醚麻醉后于尾静脉取血3 ml,室温静置30 min,3 000 r/min 离心15 min,分离血清,-20℃冰箱保存待测。3%戊巴比妥腹腔注射麻醉大鼠,开腹截取肛门2~10 cm处结肠组织,沿肠系膜剪开肠腔,去除肠黏膜表面黏附的血液、粪便、分泌物,等渗生理盐水冲洗干净并吸干水分,称重;平展肠黏膜组织,肉眼观察结肠大体形态,进行结肠黏膜损伤指数(CMDI)评分;切取病变明显结肠组织一部分冻存于-80℃冰箱,一部分固定于4%多聚甲醛。
1.2.5ELISA方法检测血清IL-33、IL-5、IL-13、IL-6、sST2的水平 采用酶联免疫吸附测定法 (enzyme-linked immuno sorbent assay,ELISA)检测血清IL-33、IL-5、IL-13、IL-6、sST2的水平,具体操作步骤如下:将1.2.4中抽取的冰冻血液标本和ELISA试剂盒取出后,于室温平衡30 min,然后按照说明书将试剂盒内标准品配置成所需的浓度备用。分别设待测样品孔、标准孔和空白孔,然后依次加入待测标本、标准品和辣根过氧化物酶标记的检测抗体,经过温育、洗涤,采用底物四甲基联苯胺显色,并用酶标仪在450 nm处测吸光度,绘制标准曲线,计算待测标本浓度。
1.2.6HE染色及免疫组化染色 甲醛固定组织用于HE染色及免疫组化染色,HE染色后观察结肠组织病理变化,进行组织学损伤(TDI)评分。甲醛固定组织制备切片,免疫组化SP法检测TA表达水平,HE染色和免疫组化染色均按照试剂盒说明进行操作。
1.2.7甲苯胺蓝改良法染色检测MC形态 取1.2.4中甲醛固定组织,常规石蜡包埋,切片,梯度乙醇脱水,二甲苯透明,石蜡包埋,4 μm厚间断切片,采用甲苯胺蓝改良法染色检测MC形态、数目、脱颗粒率,随机选取3个视野,置于高倍(×400)镜下观察,取平均值,计数MC 数量、脱颗粒细胞数目、脱颗粒率,脱颗粒率=脱颗粒细胞数目/MC 数目×100%。
1.2.8Western blot检测结肠组织IL-33、ST2蛋白水平 取1.2.4中的冻存组织,用蛋白提取试剂盒提取蛋白,采用RIPA蛋白裂解法提取组织中的总蛋白,冰上裂解45 min,裂解期间间隔混匀组织液,裂解完成后于4℃条件下14 000 g离心15 min,收集上清液,采用BCA法测定蛋白浓度,根据测定结果调整所有蛋白样本为相同浓度后,进行SDS-PAGE电泳分离(10%分离胶和5%浓缩胶),湿转全部转移至硝酸纤维膜上,用5%的脱脂奶粉封闭2 h,加入预先按照说明书稀释好的一抗,4℃孵育过夜,TBST洗膜后加室温孵育对应的二抗2 h,以actin为内参,TBST清洗后ECL显色曝光得到蛋白条带,并使用Image J进行条带分析 。

2 结果
2.1大鼠一般情况观察 对照组大鼠饮食正常,大小便正常,皮毛光滑;模型组大鼠出现扎堆、嗜睡、厌食、皮毛干枯等表现,3 d后出现大便带血、少动少食,体重减轻等症状;灌肠后茯苓多糖治疗组和SASP组大鼠在治疗第2周后便血、皮毛干枯、饮食量少等症状开始缓解,茯苓多糖中、高剂量组和SASP组大鼠恢复良好。与对照组比较,模型组大鼠日摄食量、日体质量增加量显著降低,DAI评分显著升高(P<0.05);与模型组比较,茯苓多糖治疗组和SASP组日摄食量、日体质量逐渐增加,DAI评分逐渐降低(P<0.05)。见表1。
2.2各组大鼠结肠组织切片HE染色观察 对照组大鼠结肠组织切片显示大鼠肠黏膜形态完整,腺体排列整齐,无水肿、溃疡;模型组显示肠黏膜腺体结构排列紊乱,出现水肿、出血、糜烂,肠黏膜上皮损坏,散在溃疡连续存在,黏膜和黏膜下层较多炎症细胞浸润;茯苓多糖各治疗组和SASP组肉眼及镜下结肠损伤较轻,少量溃疡,炎症细胞浸润减轻见图1。与对照组比较,各组大鼠CMDI、TDI评分显著升高(P<0.05);与模型组比较,茯苓多糖各治疗组和SASP组CMDI、TDI评分均降低,尤以茯苓多糖高剂量组、SASP组降低最为显著(P<0.05),见表2。
2.3各组大鼠结肠组织切片甲苯胺蓝改良法检测MC形态及数目 甲苯胺蓝染色结果显示,光镜下可见近端结肠黏膜固有层和黏膜下层弥散分布肥大细胞,肥大细胞呈卵圆形或梭形,胞浆呈紫色,核蓝色,未脱颗粒者形态完整,胞浆均匀,染色呈紫色;脱粒者形态不规则,胞浆颜色较浅,细胞周围可见紫色颗粒物质(图2中箭头所指)。与对照组比较,模型组近端结肠MC数目显著增加(P<0.01);与模型组相比,茯苓多糖低、中、高剂量组和SASP组MC数目显著减少(P<0.01),见表3。
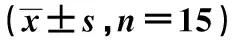
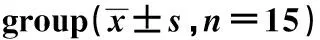

GroupsDose ofadministration(g/kg)Average dailyintake(g/d)Average dailyweight gain(g/d)DAI scoresControl-14.68±0.433.73±0.320.23±0.08Model-11.27±0.151)3.08±0.171)2.93±0.311)Poria cocos polysaccharide low dose50 mg/kg11.94±0.201)2)3.11±0.231)2)2.70±0.301)2)Poria cocos polysaccharide medium dose100 mg/kg14.25±0.351)2)3.55±0.221)2)2.00±0.231)2)Poria cocos polysaccharide high dose200 mg/kg14.39±0.391)2)3.62±0.291)2)1.28±0.181)2)SASP300 m/kg 14.52±0.331)2)3.66±0.201)2)1.01±0.111)2)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.

图1 各组大鼠结肠组织切片HE染色(×100)Fig.1 HE staining of colon slices of rats in each group(×100)Note: A.Control group;B.Model group;C.Poria cocos polysaccharide low dose group;D.Poria cocos polysaccharide medium dose group;E.Poria cocos polysaccharide high dose group;F.SASP group.
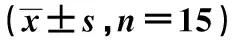
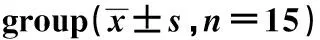

GroupsCMDITDIControl14.74±0.453.75±0.35Model11.33±0.191)3.02±0.201)Poria cocos polysaccharide low dose11.96±0.221)2)3.13±0.251)Poria cocos polysaccharide medium dose13.02±0.311)2)3.25±0.271)2)Poria cocos polysaccharide high dose14.21±0.381)2)3.46±0.311)2)SASP14.60±0.391)2)3.61±0.291)2)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.

图2 各组大鼠结肠组织切片甲苯胺蓝染色(×400)Fig.2 Toluidine blue staining of colon slices of rats in each group(×400)Note: A.Control group;B.Model group;C.Poria cocos polysaccharide low dose group;D.Poria cocos polysaccharide medium dose group;E.Poria cocos polysaccharide high dose group;F.SASP group.
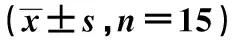


GroupsMC(n/400 hp)Degranulationrate(%)Control3.14±0.450.45±0.12Model10.33±2.191)0.86±0.201)Poria cocos polysaccharide low dose8.03±2.171)2)0.75±0.181)2)Poria cocos polysaccharide medium dose6.42±1.911)2)0.63±0.081)2)Poria cocos polysaccharide high dose3.75±1.731)2)0.48±0.061)2)SASP3.42±1.371)2)0.46±0.041)2)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.

图3 各组大鼠结肠组织TA表达(×400)Fig.3 Expression of TA in colon tissue of rats in each group(×400)Note: A.Control group;B.Model group;C.Poria cocos polysaccharide low dose group;D.Poria cocos polysaccharide medium dose group;E.Poria cocos polysaccharide high dose group;F.SASP group.
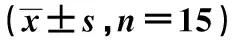
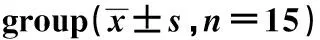
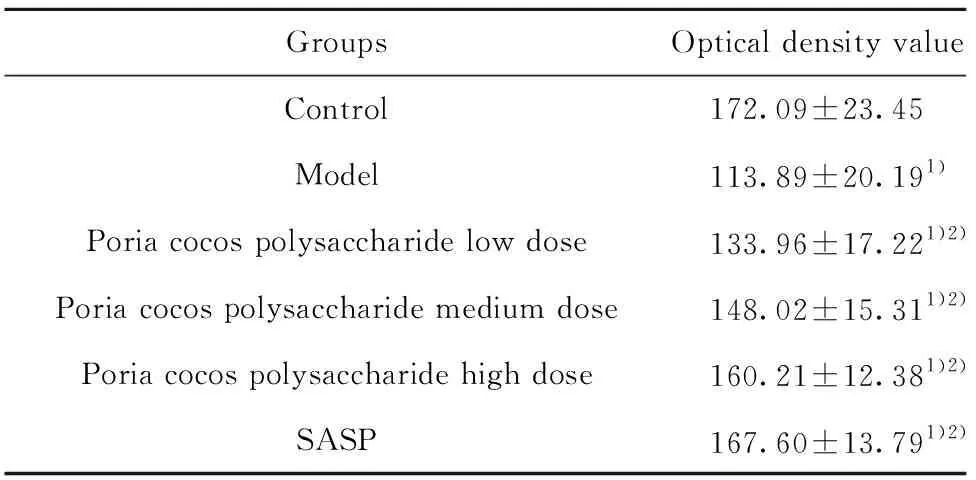
GroupsOptical density valueControl172.09±23.45 Model113.89±20.191)Poria cocos polysaccharide low dose133.96±17.221)2)Poria cocos polysaccharide medium dose148.02±15.311)2)Poria cocos polysaccharide high dose160.21±12.381)2)SASP167.60±13.791)2)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.

GroupsIL-33(pg/ml)IL-5(pg/ml)IL-13(pg/ml)IL-6(pg/ml)sST2(ng/L)Control15.10±2.522.21±0.358.52±1.2030.28±6.0258.19±15.52Model39.29±3.321)4.02±0.671)17.21±2.891) 83.25±14.041)180.91±29.261)Poria cocos polysaccharide low dose32.03±3.161)2)3.55±0.451)2)14.91±1.351)2) 60.06±14.151)2) 160.89±24.031)2)Poria cocos polysaccharide medium dose25.29±2.091)2)3.06±0.351)2)11.56±1.571)2) 46.56±9.341)2) 135.68±18.951)2)Poria cocos polysaccharide high dose17.02±2.191)2)2.46±0.311)2)10.39±1.781)2) 35.17±8.121)2) 105.68±17.611)2)SASP15.78±2.161)2)2.41±0.291)2)9.95±2.031)2) 33.26±7.021)2) 94.02±6.151)2)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.

图4 各组大鼠IL-33、ST2蛋白的表达Fig.4 Expression of IL-33 and ST2 proteins in rats of each groupNote: 1.Control group;2.Model group;3.Poria cocos polysaccharide low dose group;4.Poria cocos polysaccharide medium dose group;5.Poria cocos polysaccharide high dose group;6.SASP group.

GroupsIL-33ST2Control0.35±0.080.10±0.02Model1.10±0.121)1.02±0.111)Poria cocos polysaccharide low dose0.56±0.051)2)0.75±0.071)2)Poria cocos polysaccharide medium dose0.60±0.071)2)0.45±0.081)2)Poria cocos polysaccharide high dose0.36±0.061)2)0.32±0.051)2)SASP0.32±0.041)2)0.11±0.031)2)
Note:Compared with control group,1)P<0.05;compared with model group,2)P<0.05.
2.4各组大鼠结肠组织MC的TA表达水平 与对照组比较,模型组结肠TA水平显著增加(P<0.01);与模型组相比,茯苓多糖低、中、高剂量组和SASP组TA水平显著减少(P<0.01)。
2.5各组大鼠血清sST2及炎症因子表达水平 与对照组比较,模型组IL-33、IL-5、IL-13、IL-6、sST2水平显著升高,与模型组比较,茯苓多糖各治疗组和SASP组IL-33、IL-5、IL-13、IL-6、sST2水平显著降低(P<0.05)。
2.6各组大鼠IL-33、ST2蛋白的表达 与对照组比较,模型组IL-33、ST2蛋白水平显著升高,与模型组比较,茯苓多糖各治疗组和SASP组IL-33、ST2蛋白水平显著降低(P<0.05)。
3 讨论
中医认为UC的病症主要是湿热蕴肠、气滞络淤,属本虚标实之症[8]。近年来研究表明,UC的发病与机体免疫密切相关,UC患者T淋巴细胞降低,免疫力减弱[9]。茯苓具有涩肠止泻、清热燥湿的功效,茯苓多糖可增强T淋巴细胞、B细胞活性,增强巨噬细胞功能,但关于茯苓多糖对MC的作用目前尚不清楚。本研究通过制备UC模型,观察茯苓多糖对MC及IL-33/ST2通路的作用,结果显示茯苓多糖治疗后,大鼠排脓血便、皮毛干枯、饮食量减少等症状得到缓解,且治疗组大鼠DAI评分显著降低,提示茯苓多糖可降低UC大鼠的临床病理症状。SASP属于磺胺类药物,是治疗大鼠溃疡性结肠炎的常用药物。本研究中,与茯苓多糖治疗组比较,SASP组治疗效果更优,但长期使用SASP易引起呕吐、药物热、白细胞减少等不良症状,故选择中药代替西药,进一步分析结肠黏膜病理结构和MC数目及炎症因子水平。
UC是严重的肠道炎症性疾病,主要表现为肠道腺体结构排列紊乱、炎症细胞浸润等典型的组织学特征,是一种自身免疫性疾病[10]。本研究采用茯苓多糖治疗UC大鼠,治疗后大鼠结肠损伤减轻,炎症细胞浸润减弱,肠黏膜水肿减轻,提示茯苓多糖可通过抑制结肠黏膜的炎症细胞缓解UC症状。黏膜免疫在肠道炎症和损伤中发挥重要作用,淋巴细胞活化参与UC的发生[11]。目前认为UC是个体对肠腔内正常促炎因子的异常反应引起的免疫失调,MC可能是这一过程的关键因子[12]。MC是免疫细胞的一种,可分泌多种细胞因子,参与T细胞、B细胞、APC细胞的活化。研究显示,MC常分布于肠黏膜下小血管、毛细血管丛,其在炎症性肠病中显著提高,并释放大量颗粒[13]。MC活化释放多种细胞介质,TA是MC活化、释放颗粒的特异性标志,UC患者中TA水平显著增高[14]。另外TA也可激活MC,可刺激MC脱颗粒,放大MC效应,使MC以瀑布效应得到激活。动物实验证实,向健康小鼠结肠内灌注TA可引发肠道炎症[15]。本研究显示,茯苓多糖治疗后,大鼠MC数目、脱颗粒率及TA水平均显著下降,提示茯苓多糖可抑制MC的激活,进而缓解UC病理症状。
ST2是IL-1受体家族成员,可分为可溶型ST2(sST2)和跨膜型ST2(ST2L),主要在Th2细胞、MC、巨噬细胞中表达[16]。研究报道IL-33是ST2的功能配体,炎性肠病患者血清IL-33、ST2水平与疾病的严重程度密切相关,是疾病活动程度的标志物[17]。机体胃肠道组织细胞损伤时,IL-33作为组织损伤的信号被凋亡细胞释放。研究显示,IL-33在UC及克罗恩病患者血清中异常升高[18]。本研究中,UC大鼠IL-33、ST2水平显著高于对照组,茯苓多糖治疗后,UC大鼠IL-33、ST2水平显著降低,提示抑制IL-33、ST2水平对缓解UC炎症反应具有重要作用。UC主要是Th2细胞介导的肠黏膜炎症,Th2细胞特征性的细胞因子IL-5在UC患者血清中异常增加[19]。IL-5的主要来源是嗜酸性粒细胞,嗜酸性粒细胞又通过分泌IL-5来促进炎症的发展。IL-13也是Th2细胞介导的关键因子,其与细胞凋亡和修复密切相关。IL-33与受体ST2结合对Th2细胞进行调节,进而作用于MC、巨噬细胞、自然杀伤细胞调节免疫反应。IL-33/ST2信号可促进肠黏膜Th2细胞分泌IL-4、IL-5、IL-13,加强炎症反应,促进疾病进程的发展。本研究中,与对照组比较,模型组大鼠MC数目、IL-5、IL-13、IL-6的水平升高,茯苓多糖治疗后MC数目、IL-5、IL-13、IL-6的水平显著降低,提示茯苓多糖可通过IL-33/ST2信号通路抑制MC的激活及炎症反应。
综上所述,茯苓多糖能够通过IL-33/ST2抑制MC的激活进而缓解结肠黏膜损伤及炎症反应,发挥结肠黏膜保护作用,但关于茯苓多糖调控IL-33/ST2通路的机制有待进一步研究。

