尿液外泌体circ_0040507联合PSA对前列腺癌诊断价值的初步研究
陶文 何涛 何娅娣 罗量 黄文涛 李科 胡成 李辽源


【摘要】目的 探讨尿液外泌体circ_0040507及其联合前列腺特异性抗原(PSA)对前列腺癌的诊断价值。方法 选择35例前列腺癌患者(前列腺癌组)和27例BPH患者(BPH组),采用第三代微滴数字PCR检测尿液外泌体circ_0040507表达水平,以前列腺活组织检查(活检)病理结果为金标准,应用受试者工作特征(ROC)曲线分析尿液外泌体circ_0040507、PSA及两者联合对前列腺癌的诊断效能。结果 前列腺癌组和BPH组尿液外泌体circ_0040507表达量分别为(8.35±5.87) copies/ml和(3.25±2.45)copies/ml,前列腺癌组尿液外泌体circ_0040507表达量高于BPH组(P < 0.001);尿液外泌体circ_0040507、PSA及两者联合诊断前列腺癌的ROC曲线下面积分别为0.767(95%CI 0.649 ~ 0.896)、0.782(95%CI 0.668 ~ 0.896)、0.851(95%CI 0.755 ~ 0.946)。结论 尿液外泌体circ_0040507联合PSA诊断前列腺癌具有较好的临床价值。
【关键词】前列腺癌;诊断;外泌体;前列腺特异性抗原;环状核糖核酸
【Abstract】Objective To investigate the diagnostic value of urinary exosomal circ_0040507 combined with prostate-specific antigen (PSA) for prostate cancer. Methods Digital droplet polymerase chain reaction (ddPCR) was employed to detect the expression level of circ_0040507 in the urinary exosomes of 35 patients with prostate cancer and 27 patients with benign prostatic hyperplasia. The pathological results of prostate biopsy were regarded as the gold standard. The receiver operating characteristic (ROC) curve was delineated to analyze the sensitivity and specificity of urinary exosomal circ_0040507, PSA and the combination of them for the diagnosis of prostate cancer. Results The expression level of urinary exosomal circ_0040507 in the BPH group was (3.25±2.45) copies/ml, significantly lower compared with (8.35±5.87) copies/ml in the prostate cancer group (P < 0.001). The area under ROC for circ_0040507, PSA, and the combination was 0.767 (95%CI 0.649-0.896), 0.782 (95%CI 0.668-0.896) and 0.851(95%CI 0.755-0.946), respectively. Conclusion The determination of urinary exosomal circ_0040507 combined with PSA is a valuable biomarker for the diagnosis of prostate cancer.
【Key words】Prostate cancer;Diagnosis;Exosome;Prostate-specific antigen;Circular RNA
前列腺癌是男性常見的恶性肿瘤, 血清前列腺特异性抗原(PSA)是前列腺癌早期诊断的指标之一,但其特异度较低,在部分BPH和前列腺炎患者中也会增高[1-2]。环状RNA (circRNA)是一类特殊的单链闭合环状结构的RNA,其可耐受核酸外切酶,因此较传统的线性RNA稳定。目前研究显示,circRNA广泛参与前列腺癌的发生、发展过程[3-4]。外泌体是一类直径在30 ~ 100 nm的细胞外囊泡,其中包含蛋白质、脂质和核酸等物质,在细胞间通讯发挥着重要作用[5]。有研究显示,circRNA在外泌体中富集并稳定,可作为恶性肿瘤诊断的生物标志物[6]。本研究通过微滴数字PCR (ddPCR)检测可疑前列腺癌患者尿液外泌体circ_0040507的水平,分析其表达水平及其联合PSA对前列腺癌诊断的临床价值。
对象与方法
一、研究对象
将2018年1月至2019年6月中山大学附属第三医院泌尿外科收治的、经穿刺活组织检查(活检) 确诊的35例前列腺癌患者纳入前列腺癌组,并将同期收集的27例经穿刺活检确诊的BPH患者纳入BPH组。排除标准:①此前接受其他任何肿瘤相关治疗;②患有其他肿瘤或严重慢性疾病;③患严重的精神性疾病。研究方案经医院伦理委员会批准,入组患者均已签署知情同意书。
二、尿液采集
所有患者在前列腺穿刺前行前列腺按摩,自前列腺底部至尖部,侧叶外侧至中线;自上而下按压侧叶各3次,重复1次,最后按摩前列腺中央沟3次。采集初始尿液80 ~ 100 ml,置于-80℃冰箱保存。
三、外泌体分离
尿液样品在4℃解冻过夜,4℃、3000×g离心15 min以去除细胞和细胞碎片,取上清液至2支38.5 ml薄壁多聚异体离心管(美国Beckman Coulter),天平配平之后,置超速离心机,4℃、100 000×g离心120 min,弃上清,用5 ml磷酸盐缓冲液(PBS)溶解沉淀。取1 ml ExoQuick-TC试剂与上一步得到的液体按照1∶5比例混合,在4℃孵育过夜后,4℃、1500×g离心30 min,弃上清再离心5 min去除残留液体。得到的外泌体用PBS溶解用于进一步实验或者置-80℃冰箱保存。
四、总RNA提取、逆转录
使用miRNeasy Mini试剂盒(德国Qiagen)提取尿液外泌体中总RNA,使用美国Agilent 2100生物分析仪检测RNA的浓度和完整性。应用逆转录试剂盒Perfect Real Time (日本TaKaRa),采用随机引物将提取的RNA逆转录为模板DNA。
五、数字PCR检测
ddPCR实验使用ddPCR EvaGreen Supermix试剂(美国Bio-Rad)在QX200微滴数字PCR系统上进行。Circ_0040507上游引物为5-CGCTGGGAGAGCTGTACATA-3,下游引物为5-GCTGAGAGAGATCTGGACAA-3,产物长度为113 bp。配制20 μl反应体系(2 μl模板DNA,10 μl QX200 EvaGreen ddPCR Supermix,4 μmol/L上下游引物,无核酸酶水补足20 μl体积),并用无核酸酶水替代反应模板设置阴性对照。将20 μl反应体系和70 μl微滴生成油转移至微滴生成卡生成微滴,并取40 μl至96孔PCR板;PX1热封仪封膜后在T100TM PCR 仪进行PCR扩增,反应条件:95℃ 5 min;95℃ 30 s,64℃ 60 s,循环45次;4℃ 5 min,90℃ 5 min稳定信号;4℃保存。检测微滴:通过微滴分析仪使用QuantaSoft软件计算结果,并换算为copies/ml。
六、统计学处理
所有数据均采用SPSS 25.0进行分析。符合正态分布的计量资料以描述,组间比较采用t检验;不符合正态分布的计量资料用中位数(四分位数间距)表示,组间比较采用秩和检验。绘制受试者工作特征(ROC) 曲线,分析尿液外泌体circ_0040507表达水平和PSA对前列腺癌诊断的临床价值。ROC曲线与散点图绘制分别使用SPSS 25.0和GraphPad Prism 8.0。P < 0.05为差异有统计学意义。
结果
一、前列腺癌组和BPH组患者的一般情况
2组患者的年龄比较差异无统计学意义(t = 1.636,P = 0.107),2组患者的其他一般资料详见表1。
二、前列腺癌组和BPH组患者的尿液外泌体circ_0040507表达情况
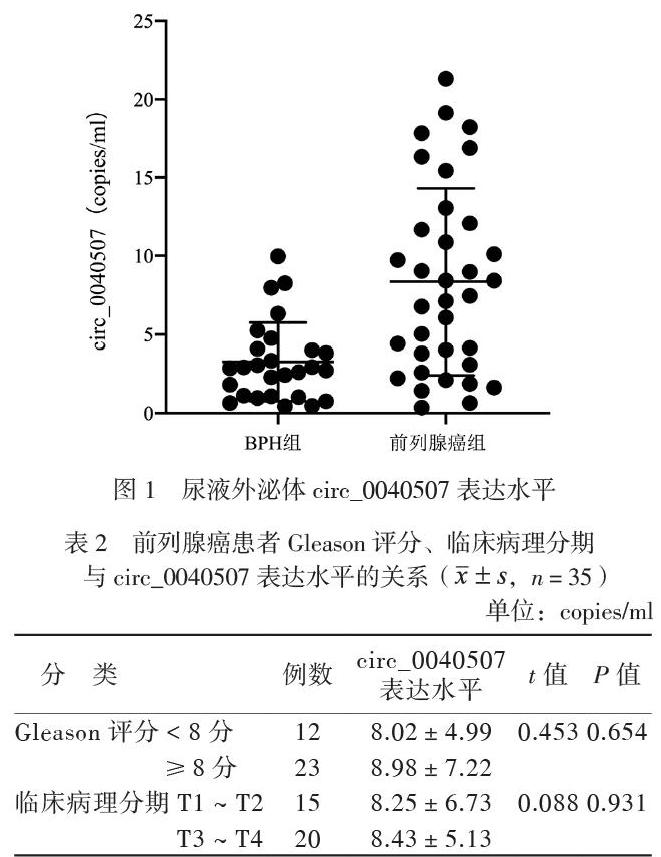
前列腺癌组患者尿液外泌体circ_0040507表达水平为(8.35±5.87)copies/ml,高于BPH组的(3.25±2.45)copies/ml(t = 4.165,P < 0.001),见图1。前列腺癌患者中,Gleason评分< 8分与≥8分者、临床病理分期T1 ~ T2与T3 ~ T4者尿液外泌体circ_0040507表达水平比较差异均无统计学意义(P均> 0.05),见表2。
三、尿液外泌体circ_0040507诊断前列腺癌的ROC曲线分析
ROC曲线分析显示,尿液外泌体circ_0040507鉴别前列腺癌与BPH的曲线下面积为0.767(95% CI 0.649 ~ 0.884),当前列腺癌的诊断临界值为4.12 copies/ml时,其灵敏度和特异度分别为68.6%和77.8%;当诊断临界值为6.55 copies/ml时,其灵敏度和特异度分别为57.1%和88.9%;同时兼顾到灵敏度和特异度,4.12 copies/ml可作为尿液外泌体circ_0040507诊断前列腺癌最佳临界值,见图2。
四、尿液外泌体circ_0040507、PSA及两者联合诊断前列腺癌的ROC曲线分析
尿液外泌体circ_0040507、PSA及两者联合诊断前列腺癌[Logit(P) = -1.631+0.037×PSA+ 0.194×circ_0040507]的ROC曲线下面积分别为0.767(95% CI 0.649 ~ 0.884)、0.782 (95% CI 0.668 ~ 0.896)、0.851 (95% CI 0.755 ~ 0.946)。两者联合诊断的曲线下面积高于尿液外泌体circ_0040507单一诊断(P = 0.021)。PSA诊断前列腺癌的灵敏度和特异度分别为74.3%和74.1%,尿液外泌体circ_0040507和PSA联合诊断前列腺癌时,其灵敏度和特异度分别为82.9%和77.8%,见图2。两者联合诊断较PSA单一诊断的灵敏度和特异度有所提高,但曲线下面积比较差異无统计学意义(P = 0.160)。
讨论
前列腺癌是男性常见肿瘤之一,其发病率逐年增高,且大多数患者在确诊肿瘤时已是中晚期,失去了根治性手术治疗的时机[7]。因此,寻找新的检测指标对于前列腺癌的筛查和诊治有着重要意义。液体活检通过采集血液、尿液及唾液等检测其中携带的包括循环肿瘤细胞、外泌体RNA 和循环肿瘤DNA等在内的多种肿瘤标志物,是一种非侵入性或微侵入性体液检测技术[8]。与组织活检相比,其可减少操作过程中出血、感染等几率,且有动态监测的优势。
近来,关于circRNA与肿瘤的研究报道越来越多,有报道circCSNK1G3通过miR-181b/d作用于前列腺癌,且与其线性mRNA无关[4]。circ-AURKA在神经内分泌前列腺癌(NEPC)细胞系NCI-H660中的表达比在非NEPC前列腺细胞LNCaP和VCaP中的表达较高[3]。因其独特的环状结构,circRNA可稳定存在于组织或体液中,被广泛作为肿瘤诊断和预后的标志物[9-10]。外泌体通过传递信号、物质转运等方式参与肿瘤增殖、侵袭及转移等过程[11]。据报道,circRNA可在外泌体中富集,并与肿瘤微环境、转移灶形成及药物耐药性相关[12]。尿液中存在外泌体,且样本收集、保存方便,更重要的是可跟踪疾病进程,实现动态监测。本研究使用微滴数字PCR检测尿液外泌体circ_0040507表达水平,与传统的实时荧光定量PCR相比,其使用油包水液滴技术,使每个反应单元中至多包含一个拷贝的模版,并通过泊松分布的原理,实现检测分子的绝对定量,具有更好的重复性和更高的灵敏度[13]。本研究中前列癌组与BPH组相比,前者尿液外泌体circ_0040507水平高于后者,提示检测尿液外泌体circ_0040507可作为诊断前列腺癌的一种新方法。
本研究以组织穿刺活检为金标准,探索尿液外泌体circ_0040507及其联合PSA诊断前列腺癌的价值。目前前列腺癌的主要临床指标是血清PSA, 但存在特异度不高的缺点,其在部分BPH和前列腺炎患者中也升高,且易受各种因素干扰,包括泌尿系统感染、前列腺按摩等。本研究中,与PSA单一诊断前列腺癌相比,尿液外泌体circ_0040507与PSA两者联合诊断的灵敏度和特异度均提高。本研究中,两者联合诊断与PSA单一诊断曲线下面积分别为0.851、0.782,两者曲线下面积相近,可能与样本量偏小有关,有待后续扩大样本量进一步验证。我们认为,血清PSA水平是临床最常见的检测指标,而尿液样品也是较容易获得的临床标本,通过将两指标联合,提高了单一诊断的效能。本研究的不足之处是样本量偏小,我们正在收集更多的病例进行前瞻性验证。
综上所述,本研究初步分析了尿液外泌体circ_0040507在前列腺癌诊断中的价值,并进一步探讨了其联合血清PSA的诊断意义。鉴于尿液样本收集简单易行及circRNA的稳定性,我们认为检测尿液外泌体circ_0040507并结合血清PSA诊断前列腺癌具有较好的临床价值。
参 考 文 献
[1] Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin, 2015, 65(2):87-108.
[2] 陈羽, 胡劲, 严亮, 庄锦涛. 中老年患者血清tPSA轻度异常时PSA相关指标鉴别无症状性前列腺炎与前列腺癌的价值. 新医学, 2017, 48(5): 326-331.
[3] Vo JN, Cieslik M, Zhang Y, Shukla S, Xiao L, Zhang Y, Wu YM, Dhanasekaran SM, Engelke CG, Cao X, Robinson DR, Nesvizhskii AI, Chinnaiyan AM. The landscape of circular RNA in cancer. Cell,2019, 176(4):869-881.
[4] Chen S, Huang V, Xu X, Livingstone J, Soares F, Jeon J, Zeng Y, Hua JT, Petricca J, Guo H, Wang M, Yousif F, Zhang Y, Donmez N, Ahmed M, Volik S, Lapuk A, Chua MLK, Heisler LE, Foucal A, Fox NS, Fraser M, Bhandari V, Shiah YJ, Guan J, Li J, Orain M, Picard V, Hovington H, Bergeron A, Lacombe L, Fradet Y, Têtu B, Liu S, Feng F, Wu X, Shao YW, Komor MA, Sahinalp C, Collins C, Hoogstrate Y, de Jong M, Fijneman RJA, Fei T, Jenster G, van der Kwast T, Bristow RG, Boutros PC, He HH. Widespread and functional RNA circularization in localized prostate cancer. Cell, 2019, 176(4):831-843.
[5] Maas SLN, Breakefield XO, Weaver AM. Extracellular vesicles: unique intercellular delivery vehicles. Trends Cell Biol, 2017, 27(3):172-188.
[6] Li Y, Zheng Q, Bao C, Li S, Guo W, Zhao J, Chen D, Gu J, He X, Huang S. Circular RNA is enriched and stable in exosomes: a promising biomarker for cancer diagnosis. Cell Res, 2015 , 25(8):981-984.
[7] 葉定伟, 朱耀. 中国前列腺癌的流行病学概述和启示. 中华外科杂志, 2015, 53(4): 249-252.
[8] Siravegna G, Marsoni S, Siena S, Bardelli A. Integrating liquid biopsies into the management of cancer. Nat Rev Clin Oncol, 2017, 14(9):531-548.
[9] Ju HQ, Zhao Q, Wang F, Lan P, Wang Z, Zuo ZX, Wu QN, Fan XJ, Mo HY, Chen L, Li T, Ren C, Wan XB, Chen G, Li YH, Jia WH, Xu RH. A circRNA signature predicts posto-perative recurrence in stage Ⅱ/Ⅲ colon cancer. EMBO Mol Med, 2019, 11(10):e10168.
[10] Xu H, Wang C, Song H, Xu Y, Ji G. RNA-Seq profiling of circular RNAs in human colorectal cancer liver metastasis and the potential biomarkers. Mol Cancer, 2019, 18(1):8.
[11] Wortzel I, Dror S, Kenific CM, Lyden D. Exosome-mediated metastasis: communication from a distance. Dev Cell, 2019, 49(3):347-360.
[12] Wang Y, Liu J, Ma J, Sun T, Zhou Q, Wang W, Wang G, Wu P, Wang H, Jiang L, Yuan W, Sun Z, Ming L. Exosomal circRNAs: biogenesis, effect and application in human diseases. Mol Cancer, 2019, 18(1):116.
[13] Hindson CM, Chevillet JR, Briggs HA, Gallichotte EN, Ruf IK, Hindson BJ, Vessella RL, Tewari M. Absolute quantification by droplet digital PCR versus analog real-time PCR. Nat Methods, 2013, 10(10):1003-1005.
(收稿日期:2020-02-10)
(本文編辑:林燕薇)

