激素耐药型肾病综合征儿童与COL4A5基因突变的关系研究
张玉霞 赵青

【摘要】目的 探讨糖皮质激素(激素)耐药型肾病综合征(SRNS)儿童与Ⅳ型胶原A5(COL4A5)基因突变的关系。方法 选取51例原发性肾病综合征(PNS)患儿,其中经足量激素治疗4周无效的患儿即SRNS 26例,经足量激素治疗4周有效的患儿即激素敏感型NS(SSNS)25例,并选择同期体检的27名健康儿童作对照,采集外周血提取DNA,并进行DNA测序。结果 COL4A5基因突变仅在PNS患儿中检出而在对照组中未检出。51例PNS患儿中,检出COL4A5基因突变16例,其中散发突变和遗传突变各8例。SRNS患儿的COL4A5基因突变检出率为46%,高于SSNS患儿的16%(P < 0.05)。SRNS患儿和SSNS患儿的突变来源比较差异无统计学意义(P > 0.05)。结论 COL4A5基因突变和PNS的发生有关,且该突变可能与患儿激素耐药有关。
【关键词】糖皮质激素耐药型肾病综合征;脱氧核糖核酸测序;Ⅳ型胶原A5;基因突变
【Abstract】Objective To investigate the relationship between steroid-resistant nephrotic syndrome (SRNS) and type Ⅳ collagen alpha 5 (COL4A5) gene mutation in children. Methods A total of 51 children with primary nephrotic syndrome (PNS) were enrolled. Twenty-six children who were not healed after 4-week adequate hormone therapy were assigned into the SRNS group, 25 patients who were effectively treated with adequate hormone therapy were allocated into the steroid-sensitive NS (SSNS) group, and 27 healthy children receiving physical examination were recruited as normal controls. DNA was extracted from the peripheral blood of PNS and healthy children. DNA sequencing was performed. Results COL4A5 gene mutation was detected in the PNS children rather than the normal controls. Among 51 PNS children, COL4A5 gene mutation was identified in 16 children including 8 cases of sporadic and 8 cases of genetic mutations. The COL4A5 gene mutation rate in the SRNS group was 46%, significantly higher compared with 16% in the SSNS group (P < 0.05). The source of mutation did not significantly differ between the SRNS and SSNS children (P > 0.05). Conclusion The COL4A5 gene mutation is closely correlated with the occurrence of PNS, which is probably associated with the steroid resistance in children.
【Key words】Steroid-resistant nephrotic syndrome;DNA sequencing;Type Ⅳ collagen alpha 5; Gene mutation
腎病综合征(NS)是儿童期常见的肾小球疾病,其临床症状多见蛋白尿、低蛋白血症和不同程度的水肿等[1]。大部分患儿对于糖皮质激素(激素)治疗敏感,但有10% ~ 20%的患儿经足量激素治疗后蛋白尿仍为阳性,这类称为激素耐药型NS(SRNS),这类患儿大多会很快发展为终末期肾病[2]。SRNS不仅给患儿家庭带来沉重的经济负担,而且患儿由于长时间大量服用激素,易引起代谢紊乱,引发其他疾病[3]。近年来,随着分子生物学研究的进展,有关SRNS发生发展的研究进入分子和基因水平,认为基因突变可引发SRNS[4]。肾小球基底膜是其滤过屏障中不可或缺的一部分,而作为肾小球基底膜中支架结构的Ⅳ型胶原蛋白同样在滤过屏障过程中发挥着关键作用[5]。Ⅳ型胶原A5 (COL4A5) 基因是编码Ⅳ型胶原分子的一级结构6条α链的基因之一。Ⅳ型胶原的6种α链可组成3种三聚体,其中α3α4α5三聚体是肾小球基底膜的重要组成部分[6]。已有报道表明Ⅳ型胶原编码基因COL4A3、COL4A4和COL4A5的突变可造成多种异质性的肾脏疾病,其中包含Alport综合征(AS)、良性家族血尿(BFH)和局灶节段性肾小球硬化(FSGS)等[7]。目前有关NS与COL4A5基因突变的相关报道较少。为此,本研究对PNS患儿进行COL4A5基因测序,分析COL4A5基因突变和PNS疾病的关系,并探讨COL4A5基因突变与SRNS的相关性,现报告如下。
对象与方法
一、研究对象
选取2017年12月至2019年1月在我院儿科就诊的51例原发性NS(PNS)患儿为研究对象。51例患儿中,男35例、女16例,年龄5 (1,9)岁,有血尿症状24例,发展为终末期肾病(ESRD) 3例。15例行肾穿刺病理检查,其中局灶性节段性肾小球硬化症(FSGS) 6例、微小病变型肾病(MCNS)4例、系膜增生性肾小球肾炎(MsPGN)3例、膜性肾病(MN)1例、弥漫性系膜硬化(DMS)1例。经足量激素治疗4周无效的患儿即SRNS患儿26例、经足量激素治疗4周有效的患儿即激素敏感型NS(SSNS)患儿25例。另选择同期来我院体检的27名无肾病家族史和肾病病史健康儿童作对照。本研究经过医院伦理委员会批准,入组儿童均由其监护人签署知情同意书。
二、诊断标准
儿童PNS的诊断标准:①1周内有3次的尿蛋白定性为(+++)~(++++)或随机或晨尿中的尿蛋白/尿肌酐≥2.0,24 h尿蛋白定量≥50 mg/(kg·d);②血清白蛋白≤25 g/L;③血清胆固醇> 5.7 mmol/L;④有水肿现象。其中①和②为诊断PNS的必要条件。排除标准:①出生3个月以内即发病的先天性NS;②有全身性疾病导致过相关的肾损害;③肾脏病理活组织检查(活检)结果为膜增生性肾小球肾炎或泌尿生殖系统畸形等;④经耳和眼部检查诊断为Alport综合征。
三、主要试剂及仪器
人血液基因组DNA提取试剂盒购于天根生物技术有限公司。实验所需的引物由上海生工生物技术有限公司合成。荧光染料等购自日本TaKaRa公司。高速低温离心机购自德国Heraeus公司。超低温冰箱购自Millus公司;NanoDrop ND-2000紫外分光光度计购自美国NanoDrop公司。微量移液器购自美国Thermo公司。实时定量PCR仪购自瑞士Roche公司。
四、DNA测序
取患儿和对照健康儿童外周血1 ml,根据说明书,使用基因DNA试剂盒抽提基因组DNA,送广州嘉检医学检测有限公司完成目标DNA测序,所鉴定的基因突变致病性是基于以下标准中的至少一种:①截短突变(无义,共有剪接位点多或者少1或2个碱基,大片段缺失和移码);②先前描述为人类基因组突变数据库(HGMD)、人类基因变异数据库(LOVD)网站和美国国立生物技术信息中心(NCBI)主办的与疾病相关的人类基因组变异数据库ClinVar中具有相似表型患儿中引起疾病的变体;③中间的甘氨酸错义变体(COL4A5中的p.Gly624 Asp除外),新的非甘氨酸替代物在大种群[千人基因组、人类外显子组整合数据库(ExAC)、人类基因组整合数据库(gnomAD)]中不存在或频率很低,在领域内高度进化守恒,并有2个以上的预测分数将等位基因归类为致病基因(SIFT, Mutation Taster, Polyphen 2)。采用NCBI的序列和结果比对,当出现基因变异结果时,另检测互补链来明确变异是否存在。从NCBI数据库中获得COL4A5基因序列(GeneBankID 9606,MIM 303630)、mRNA序列(NM_000495.4)和蛋白质序列(NP_000486.1)。根据人类DNA序列变异命名建议为突变基因命名。
五、统计学处理
采用SPSS 21.0对研究数据进行分析。计量资料以中位数(下四分位数,上四分位数)表示,组间比较采用秩和检验。计数资料以例(%)表示,组间比较采用χ2检验或Fisher确切概率法。P < 0.05为差异有统计学意义。
结果
一、3组儿童的一般资料比较
SRNS患儿26例,男19例、女7例,年龄5.4(1.5,9.2)岁。SSNS患儿25例,男16例、女9例,年龄5.5(1.8,8.7)岁。对照组27名,男19名、女8名,年龄6.0(1.5,8.9)岁。3组儿童的性别构成、年龄比较差异均无统计学意义(P均> 0.05)。
二、PNS患儿和对照组健康儿童的COL4A5基因检测结果
1. 总体情况
51例PNS患儿按入院顺序编号,共16例(31%)检出COL4A5基因突变,其基因突变涉及多种形式,包括单碱基突变导致氨基酸改变如c.2858G>T(p.G953V)、剪切突变如c.834+5G>T、碱基缺失如c.3049-3051 delinsA(p.P1017Rfs*2)等;其中散发突变8例、遗传突变8例,见表1。对照组27名健康儿童均未检出COL4A5基因突变。
2. 散发和遗传性COL4A5基因突变的典型检测结果
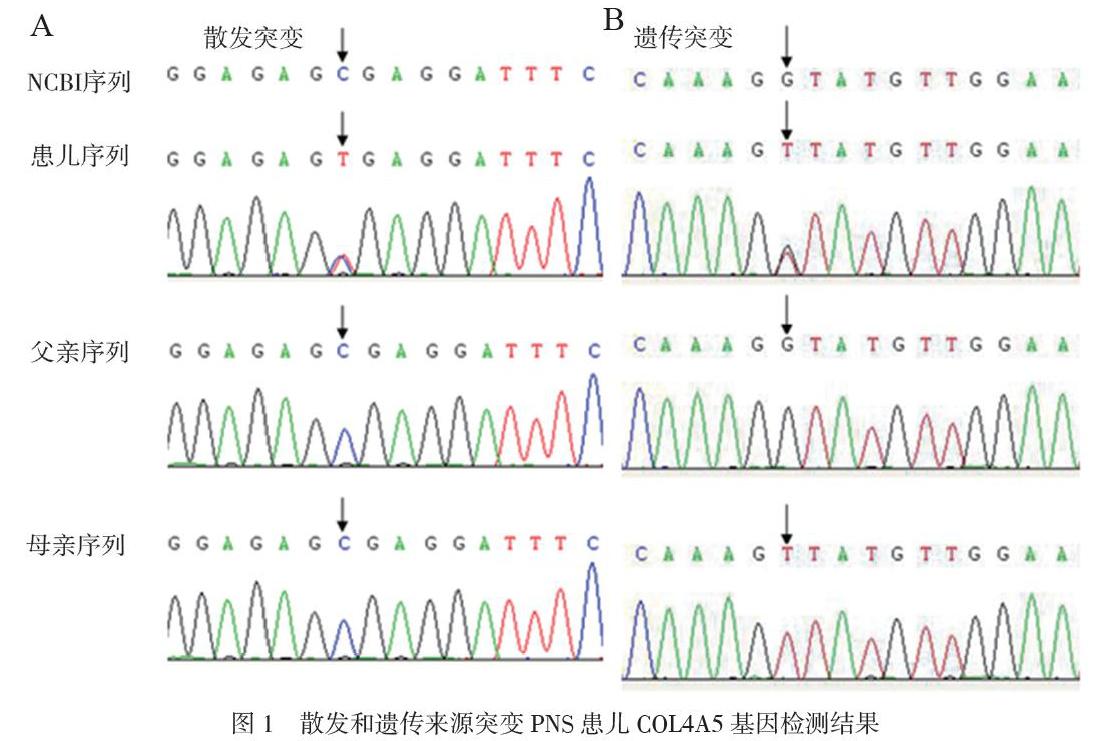
散发来源:编号7患儿,取样时6岁半,临床症状为反复肉眼血尿,B超提示左肾静脉受压,肾病理检测结果显示肾小球病变轻微,基底膜偏薄,自身抗体、体液免疫检测结果未见异常,患儿父母未有相应临床表现。检测到COL4A5基因杂合变异c.1117C > T (p.R373*),见图1A。患儿父母并无携带这个变异,此变异是新发的,为罕见的无义变异,预测可能会导致蛋白质合成提前出现氨基酸的終止密码。该变异在AS相关临床病例中被报道过(PMID: 8651296),在参考人群基因数据库中频率较低。结合送检患儿的临床表现,依据美国ACMG 变异分类指南(PMID: 25741868),此变异为“1类-致病突变”。
遗传来源:编号39患儿,取样时9岁,临床症状为持续1年血尿、尿蛋白高,肾脏病理检测显示有局灶性节段性肾小球硬化症状。患儿父母无相应临床表现。此次检测检出COL4A5基因半合子变异c.1579G > T(Gly > Cys),见图1B。验证试验显示该变异遗传自送检者的母亲(杂合状态)。此变异为罕见的无义变异,预测可能会导致蛋白质合成提前出现氨基酸的终止密码。该变异没在相关临床病例或参考人群基因数据库中报道。结合送检患儿的临床表现和家系分析,依据美国ACMG变异分类指南(PMID:25741868),此变异为“2类-可能致病”。
三、COL4A5基因突變与激素耐药性的关系分析
SRNS患儿的COL4A5基因突变检出率为46%(12/26),高于SSNS患儿的16% (4/21) (χ2 = 5.382,P = 0.020)。12例检出COL4A5基因突变的SRNS患儿中,散发突变5例、遗传突变7例。4例检出COL4A5基因突变的SSNS患儿中,散发突变3例、遗传突变1例,SRNS患儿和SSNS患儿的突变来源比较差异无统计学意义(P = 0.569)。
讨论
NS是一种以蛋白尿、低蛋白血症、不同症状水肿为临床症状的慢性肾脏病。目前激素是NS的一线治疗药物,但部分NS患儿经足量激素治疗仍无缓解或再次复发后使用激素治疗无效,这部分NS被称为SRNS。研究表明,遗传、免疫缺陷、肾小管损伤和耐药基因的异常表达等均可能导致SRNS [8]。如果能明确地诊断SRNS将可减少甚至避免大剂量激素治疗和免疫抑制治疗对患儿带来的影响。COL4A5是编码Ⅳ型胶原分子一级结构α5肽链的基因,α5肽链可和α3、α4形成三螺旋分子结构,α5 (Ⅳ) 链在肾小球基底膜含量较高,是肾小球基底膜的重要组成部分[6]。由Ⅳ型胶原异常导致的疾病多与肾脏相关,如COL4A5突变引起的AS即眼-耳-肾综合征,就是由于Ⅳ型胶原异常导致的[9]。Goodpasture综合征是一种危及生命的疾病,其主要特点是存在抗肾小球基底膜的抗体,有报道表明α5 (Ⅳ)链的NC1区存在该抗原决定簇,基因突变会导致该疾病的发生[10]。COL4A5突变相关肾病的研究较多,但目前有关COL4A5突变和PNS的相关报道较少,因此本研究以本地区PNS患儿为研究对象,探究其与COL4A5基因突变的关系。
Ⅳ型胶原编码基因COL4A3、COL4A4和COL4A5的突变可造成多种异质性的肾脏疾病,包含AS、BFH和FSGS等,研究表明COL4A4和COL4A5基因和FSGS的发生密切相关[11]。而FSGS又是NS的典型病理特征之一[12]。目前,关于儿童PNS是否和COL4A5基因突变有关的报道很少,为此,本研究取PNS患儿和健康儿童的血液样本提取基因组DNA进行测序,测序结果显示健康儿童均未检出COL4A5基因突变,仅PNS患儿有COL4A5基因突变,这部分基因突变涉及单碱基突变导致的氨基酸改变、剪切突变和碱基缺失等,且COL4A5基因突变有散发也有家族性来源,其中散发突变和遗传突变患儿各8例,这表明PNS的患儿基因中确实存在COL4A5基因的突变。
为了探究SRNS是否和COL4A5基因突变有关,我们进行了进一步的分析。研究表明SRNS涉及遗传学因素,其发生和许多基因的突变密切相关,如在家族性和出生2年内发生SRNS患儿中有基因突变的约为95%,而且基因突变导致的SRNS和继发性的SRNS相比较病程发展更快,并且其对激素或相关免疫治疗反应性更差[13]。同时,随着测序技术的快速发展,临床应用更加普遍,目前已发现至少50多个遗传基因和SRNS的发生相关,包括NPHS2、LMX1B、WT1等[14-16]。本研究表明,PNS患儿的COL4A5基因突变与患儿激素耐药有关,结合已有研究,说明COL4A5基因突变很可能是PNS患儿激素耐药的相关因素,其可能可以作为筛查和早期诊断SRNS的一个分子标志物,为SRNS患儿避免激素或免疫治疗提供生物学参考依据。本研究中,COL4A5基因突变散发还是遗传来源与激素耐药无关,但是考虑到SRNS的家族遗传相关性,本研究样本量较少,因此尚不能下确切结论,日后将进行多方面研究以确认研究结论。
综上所述,COL4A5基因突变和PNS的发生有关,且该突变可能与患儿激素耐药有关。
参 考 文 献
[1] Li C, Yao Z, Zhu M, Lu B, Xu H. Biopsy-free prediction of pathologic type of primary nephrotic syndrome using a machine learning algorithm. Kidney Blood Press Res,2017,42(6):1045-1052.
[2] Liu J, Wan Z, Song Q, Li Z, He Y, Tang Y, Xie W, Xie Y, Zhang J. NR3C1 gene polymorphisms are associated with steroid resistance in patients with primary nephrotic syndrome. Pharmacogenomics,2018,19(1):45-60.
[3] 白丽春, 覃远汉, 黄韦芳, 周志强, 雷凤英, 陈秀萍. LMX1B基因突变检测对激素耐药型肾病综合征患儿的早期诊断价值. 山东医药, 2015, 55 (12):21-23.
[4] 于海绍. LMX1B基因多态性与儿童原发性肾病综合征关系的研究. 南宁:广西医科大学, 2016.
[5] Rathod ML, Ahn J, Saha B, Purwar P, Lee Y, Jeon NL, Lee J. PDMS sylgard 527-based freely suspended ultrathin membranes exhibiting mechanistic characteristics of vascular basement membranes. ACS Appl Mater Interfaces,2018,10(47):40388-40400.
[6] Clavarino G, Gauthier A, Hellmark T, Carron PL, Giovannini D, Colliard S, Dragon-Durey MA, Segelmark M, Cesbron JY, Dumestre-Pérard C. Routinely used immunoassays do not detect circulating anti-GBM antibodies against native NC1 hexamer and EA epitope of the α3 chain of type Ⅳ collagen. Eur J Immunol,2018,48(6):1082-1084.
[7] 李昂. 遗传性肾病基因诊断体系的建立及其在Ⅳ型膠原相关肾病中的临床应用研究. 镇江:江苏大学,2018.
[8] 章万林, 岑东. 激素抵抗型肾病综合征的基因诊断进展. 现代实用医学, 2018, 30 (12):10-12.
[9] Malone AF, Funk SD, Alhamad T, Miner JH. Functional assessment of a novel COL4A5 splice region variant and immun-ostaining of plucked hair follicles as an alternative method of diagnosis in X-linked Alport syndrome. Pediatr Nephrol,2017,32(6):997-1003.
[10] Wang YY, Rana K, Tonna S, Lin T, Sin L, Savige J. COL4A3 mutations and their clinical consequences in thin basement membrane nephropathy (TBMN). Kidney Int,2004,65(3):786-790.
[11] Hines SL, Agarwal A, Ghandour M, Aslam N, Mohammad AN, Atwal PS. Correction: novel variants in COL4A4 and COL4A5 are rare causes of FSGS in two unrelated families. Hum Genome Var,2018,5:24.
[12] Doublier S, Zennaro C, Musante L, Spatola T, Candiano G, Bruschi M, Besso L, Cedrino M, Carraro M, Ghiggeri GM, Camussi G, Lupia E. Soluble CD40 ligand directly alters glomerular permeability and may act as a circulating permeability factor in FSGS. PLoS One,2017,12(11):e0188045.
[13] 王丽君, 李建国. 儿童激素耐药型肾病综合征的分子遗传学机制研究进展. 中国妇幼保健, 2018, 33(11):226-230.
[14] Dhandapani MC, Venkatesan V, Rengaswamy NB, Gowris-hankar K, Ekambaram S, Sengutavan P, Perumal V. Report of novel genetic variation in NPHS2 gene associated with idiopathic nephrotic syndrome in South Indian children. Clin Exp Nephrol,2017,21(1):127-133.
[15] Nakata T, Ishida R, Mihara Y, Fujii A, Inoue Y, Kusaba T, Isojima T, Harita Y, Kanda C, Kitanaka S, Tamagaki K. Steroid-resistant nephrotic syndrome as the initial presentation of nail-patella syndrome: a case of a de novo LMX1B mutation. BMC Nephrol,2017,18(1):100.
[16] Yue Z, Wang H, Lin H, Yang J, Liu T, Liu Y, Chen H, Sun L. WT1 mutation-associated nephropathy: a single-center experience. Clin Nephrol,2017,87(5):245-254.
(收稿日期:2019-08-20)
(本文编辑:林燕薇)

