纯种西门塔尔牛冷冻胚胎分割条件优化试验
赵增元,郭伟婷,毕江华,冯春涛,朱宏波,张 普,孙建辉,王敏生,余文莉*,李树静*
(1.河北天和肉牛养殖有限公司,石家庄 050200;2.河北省牛产业技术研究院,石家庄 050200;3.石家庄市畜牧技术推广站,石家庄 050200;4.石家庄市鹿泉区动物卫生监督所,石家庄 050200)
1 材料与方法
1.1 冷冻胚胎与试验耗材
牛一级冷冻胚胎,河北天和肉牛养殖有限公司生产;纯种西门塔尔牛一级冷冻胚胎,购自新疆金荷牧源畜牧科技有限公司。
四孔平皿(型号为148861),购自美国Thermo公司;六孔平皿(型号为090109),购自美国SPI公司;35 mm平皿(型号为7302029)、60 mm平皿(型号为4194016),均购自美国B.D.公司;胚胎冷冻细管(型号为0.25 mL),购自法国卡苏公司;显微分割刀(型号为Pullman WA)、取样吸头(2μL)、通用吸 头(200 μL),均 购 自 美 国AB 公 司;0.22μm滤器(型号为FE6 923),购自美国Pall公司;一次性注射器(1,5,20 mL),购自石家庄炫博医疗器械有限公司。
1.2 主要试剂
胚胎保存液(批号为180307),购自美国ICP公司;胚胎冷冻液(批号为12715001),购自美国MOFA公司。
mCR1aa(前期)液、mCR1aa(后期)液、胚胎分割液均为自配液。mCR1aa(前期)液配方:胚胎培养基础液mCR1aa +6 mg/mL牛血清白蛋白(BSA)+20μL/mL必需氨基酸(EAA,50×)+10μL/mL 非 必 需 氨 基 酸(NEAA,100×)+0.15 mg/mL L-谷氨酰胺;mCR1aa(后期)液配方:胚胎培养基础液mCR1aa +10%胎牛血清(FBS,V/V)+20μL/mL EAA(50×)+10μL/mL NEAA(100×)+0.15 mg/mL L-谷氨酰胺[11];胚胎分割液配方:0.05 g/L CaCl2·2H2O +0.04 g/L MgCl2·6H2O+0.2 g/L KCl+0.2 g/L KH2PO4+8 g/L NaCl+1.15 g/L Na2HPO4+0.0015 g/L EDTA·Na2·2H2O。
1.3 仪器设备
CO2培养箱(型号为Thermo 3131、Thermo 371),购自美国Thermo公司;实体显微镜(型号为SZ61)、倒置显微镜(型号为OLYMPUS CK40-F100),购自奥林巴斯北京销售服务有限公司;胚胎分割仪(型号为WETZLAR DC-3 Links),购自美国AB公司;恒温台(型号为HP-4 530),购自日本富士平工业株式会社;移液枪(型号为Eppendorf Research plus 200 mL),购自Eppendorf中国有限公司;电冰箱(型号为BCD-458WDVMU1),购自青岛海尔股份有限公司;超净工作台(型号为ZHJH-C1109B),购自上海智城分析仪器制造有限公司;高精度数显恒温水浴锅(型号为HH-4),购自上海力辰邦西仪器科技有限公司;胚胎移植枪(型号为1801-1),购自日本Misawa公司。
1.4 试验步骤
1.4.1 筛选牛一级冷冻胚胎分割前/后体外培养液 取牛一级冷冻胚胎180枚,解冻后随机分为3组,每组6个重复,每个重复10枚胚胎。3组分别置于胚胎保存液、mCR1aa(前期)液、mCR1aa(后期)液中培养24 h,统计各组胚胎发育率。胚胎解冻方法:胚胎→空气浴5 s→32℃水浴10 s→揩干细管→用70%酒精棉球擦拭细管,晾干→剪去细管塞→推入胚胎保存液洗3遍→解冻完成。胚胎培养方法:使用35 mm 平皿微滴(7 滴/皿、100μL/滴)盖以矿物油,置于38.5℃、饱和湿度、5% CO2培养箱中培养。胚胎发育率的评估方法:用实体显微镜观察胚胎在CO2培养箱培养24 h后是否出现囊胚腔,以重新形成囊胚腔的胚胎统计胚胎发育率。
1.4.2 筛选牛一级冷冻胚胎分割前培养时间 取牛一级冷冻胚胎210枚,解冻后随机分为7组作为试验组,每组6个重复,每个重复10枚半胚。取牛一级冷冻胚胎60枚作为对照组,重复6次,每次10枚整胚。采用1.4.1筛选出的培养液对解冻后的牛一级冷冻胚胎在分割前分别进行0,15,30,45,60,90,120 min共7组培养,之后进行分割,将对照组整胚和分割后的半胚培养24 h,统计各组胚胎发育率。胚胎分割方法:解冻后的牛一级冷冻胚胎在胚胎分割液中吹洗3次后,放入装有分割液滴的60 mm平皿中,将显微分割刀固定于胚胎分割仪,调试好角度,以内细胞团为中心把胚胎平均分为两部分,分别放入胚胎保存液中分割完成。胚胎解冻、胚胎培养和胚胎发育率的评估方法同1.4.1表述。
1.4.3 筛选牛一级冷冻胚胎半胚移植前培养时间 取牛一级冷冻胚胎120枚,解冻后随机分为4组,其中2组为试验组,每组6个重复,每个重复10枚半胚;另外2组为对照组,每组3个重复,每个重复10枚整胚。采用1.4.1筛选出的培养液和1.4.2筛选出的分割前培养时间对4组进行操作,将2个试验组分为不经短暂培养(no short culture,NSC)组和30 min组,2个对照组分为NSC对照组和30 min对照组。之后将各组胚胎分别装入含有胚胎冷冻液的0.25 mL细管中,在4℃冰箱放置30 min,之后在室温(25℃)下推入胚胎保存液中洗3次,再培养24 h,统计各组胚胎发育率。胚胎解冻、胚胎培养和胚胎发育率的评估方法同1.4.1表述,胚胎分割方法同1.4.2表述。
2.正确分析溶质的组成。与水反应的物质,其溶质发生变化,如SO3溶于水后变为H2SO4且水量减少;含结晶水的物质,如CuSO4·5H2O溶于水,水的量会增加;溶质发生变化,如弱酸、弱碱和可水解的盐,溶质的离子组成会发生变化,如NaHCO3溶液中含碳物质有三种:;再如1molNaHSO4溶于水电离出离子的物质的量为3mol。
1.4.4 纯种西门塔尔牛一级冷冻胚胎半胚移植 取纯种西门塔尔牛一级冷冻胚胎100枚,解冻后随机分为整胚、双半胚、单半胚3组进行移植。60枚用1.4.1筛选出的培养液和1.4.2筛选出的分割前培养时间及1.4.3筛选出半胚移植前的培养时间进行操作,其中40枚进行双半胚移植、20枚进行单半胚移植;剩下的40枚进行整胚移植。将3组获得的胚胎保存于胚胎保存液中,15 min之内将双半胚、单半胚、整胚用胚胎移植枪移植到发情7 d的受体牛有黄体侧子宫角,并用双半胚同侧移植。统计受体母牛妊娠率、流产率、双犊率、犊牛成活率。胚胎解冻、胚胎培养方法同1.4.1表述,胚胎分割方法同1.4.2表述。
1.5 数据的统计分析
试验数据采用 Excel软件进行整理,用SPSS20软件进行方差分析或卡方检验以确定差异显著性。
2 结果与分析
2.1 筛选牛一级冷冻胚胎分割前/后体外培养液
解冻180枚牛一级冷冻胚胎,分别在胚胎保存液、mCR1aa(前期)液、mCR1aa(后期)液中培养24 h,统计胚胎发育率,结果见表1。
由表1可以看出:胚胎保存液组胚胎发育率极显著低于mCR1aa(前期)液组、mCR1aa(后期)液组(P<0.01);mCR1aa(后期)液组发育率高于mCR1aa(前期)液组,但差异不显著(P>0.05)。说明mCR1aa(后期)液优于胚胎保存液和mCR1aa(前期)液。
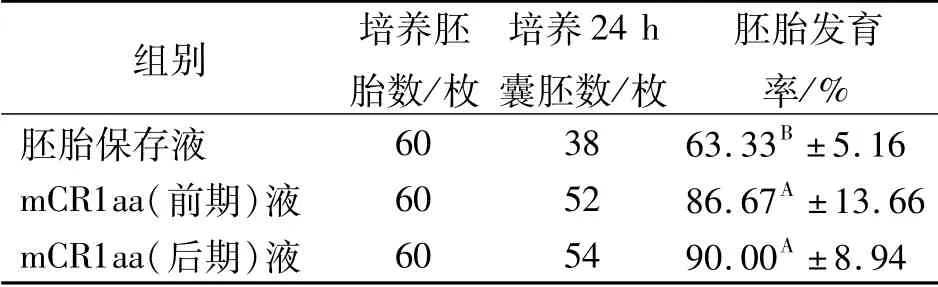
表1 牛一级冷冻胚胎分割前/后培养液筛选结果
2.2 筛选牛一级冷冻胚胎分割前培养时间
取210枚牛一级冷冻胚胎,解冻后分别进行0,15,30,45,60,90,120 min培养后再进行分割,另解冻60枚牛一级冷冻胚胎作为对照组,将各组半胚和对照组整胚用mCR1aa(后期)液培养24 h,统计胚胎发育率,结果见表2。
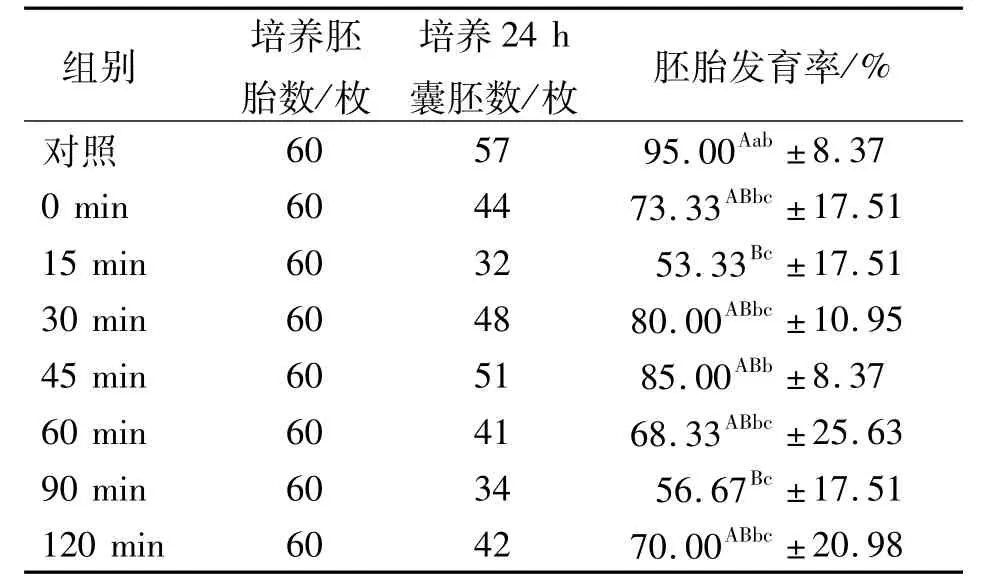
表2 牛一级冷冻胚胎分割前培养时间筛选结果
由表2可以看出:对照组胚胎发育率与解冻后培养15,90 min组差异极显著(P<0.01);试验组中解冻后培养45 min组胚胎发育率最高,与15,90 min组差异显著(P<0.05),与对照组差异不显著(P>0.05)。说明牛一级冷冻胚胎分割前培养45 min优于其他培养时间。
2.3 筛选牛一级冷冻胚胎半胚移植前培养时间
取60枚牛一级冷冻胚胎解冻后培养45 min,进行胚胎二分操作,分割后的半胚分为NSC和培养30 min两组,后将半胚装入含有胚胎冷冻液的0.25 mL细管中,在4℃冰箱放置30 min,再将半胚用mCR1aa(后期)液培养24 h,统计胚胎发育率。另解冻60枚牛一级冷冻胚胎不分割,分为NSC对照组和30 min对照组。筛选结果见表3。
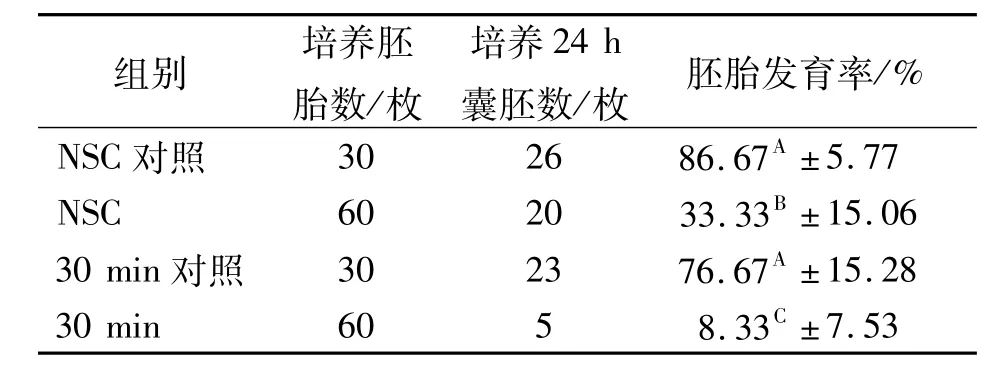
表3 半胚移植前培养时间筛选结果
由表3可以看出,NSC对照组和30 min对照组胚胎发育率差异不显著(P>0.05),二者极显著高于NSC、30 min组(P<0.01),NSC组胚胎发育率极显著高于30 min组(P<0.01)。说明半胚移植前NSC组优于30 min组。
2.4 纯种西门塔尔牛一级冷冻胚胎半胚移植
采用筛选出的分割条件,对60枚纯种西门塔尔牛一级冷冻胚胎进行二分操作,其中双半胚移植40头(每头受体同侧移植2枚半胚)、单半胚移植40头(每头受体移植1枚半胚)、整胚移植受体40头,统计妊娠率、流产率、双犊率、犊牛成活率,结果见表4。
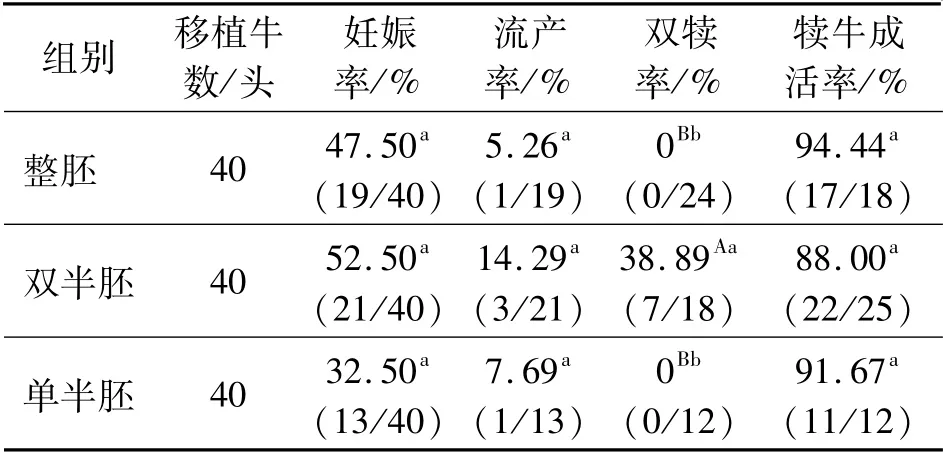
表4 纯种西门塔尔牛一级冷冻胚胎半胚移植结果
由表4可以看出,3组间妊娠率、流产率、犊牛成活率均差异不显著(P>0.05),双半胚移植的双犊率极显著高于整胚、单半胚移植(P<0.01)。
3 讨论
3.1 筛选牛一级冷冻胚胎分割前/后体外培养液
本试验中,将牛一级冷冻胚胎解冻后在3种不同培养液中培养,结果mCR1aa(前期)液组、mCR1aa(后期)液组的胚胎发育率为86.67%、90.00%,极显著高于胚胎保存液组,mCR1aa(后期)液组胚胎发育率高于mCR1aa(前期)液组。刘凤军等[12]在山羊孤雌胚胎的研究中发现,mCR1aa培养液中血清添加量为10%时胚胎发育力最好。本试验使用的mCR1aa(后期)培养液中FBS添加量为10%,与刘凤军等[12]报道的一致。其原因可能是,随着胚胎的进一步发育,胚胎发育倾向于依赖血清[13],当血清中的胚胎营养因素(大分子蛋白、促生长因子等)与胚胎毒性因子在培养液中的浓度比恰当时才能得到较好的胚胎发育效果[12]。
3.2 筛选牛一级冷冻胚胎分割前培养时间
牛一级冷冻胚胎解冻后分割前培养45 min组胚胎发育率为85.00%,显著高于15 min组(53.33%)和90 min组(56.67%),与对照组差异不显著。陈焕华等[9]报道,水牛体外胚胎解冻后培养24 h再分割培养的胚胎发育率为58.33%。本试验中,45 min组胚胎发育率优于陈焕华等[9]的试验结果。可能的原因是,本试验使用的体内冷冻胚胎质量、活力高于体外胚胎。胚胎分割前培养24 h如果应用于生产,会导致用时过长、污染风险增加,难以在生产中推广应用。
3.3 筛选牛一级冷冻胚胎半胚移植前培养时间
NSC对照组和30 min对照组的胚胎发育率为86.67%、76.67%,2组间差异不显著,说明NSC和短暂培养30 min两种处理方法对牛一级冷冻胚胎发育率无显著影响。但NSC组胚胎发育率为33.33%,极显著高于30 min组,表明分割造成的损伤及分割后处理的方式是导致胚胎发育率差异显著的主要因素。NSC组缩短了操作时间且胚胎发育率更高,便于产业化推广。
3.4 纯种西门塔尔牛一级冷冻胚胎半胚移植
本试验中,双半胚组、整胚组的妊娠率为52.50%、47.50%,2组间差异不显著。裴燕等[14]报道,鲜双半胚、鲜整胚移植妊娠率为65.45%、63.72%,冻双半胚、冻整胚移植妊娠率为20.00%、39.29%。本试验中的纯种西门塔尔牛一级冷冻胚胎移植结果较裴燕等[14]报道的结果有很大提高。这可能是由于分割前冷冻胚胎短暂培养45 min,使冷冻损伤得到较好的修复,因此解冻后短暂培养45 min再分割的胚胎移植能够获得产业化可接受的移植妊娠率。本试验中,单半胚组妊娠率为32.50%,低于双半胚组与整胚组。清家升等[15]报道,每头受体牛移植2枚半胚和1枚半胚的胚胎着床率分别为53.8%、48.4%。双半胚组妊娠率高于单半胚组妊娠率,与本试验结果一致。其原因可能是单半胚细胞数量少、妊娠识别信号弱,导致妊娠率下降。双半胚组流产率(14.29%)高于整胚组和单半胚组,原因可能是2枚半胚着床于同侧子宫角产生竞争,导致妊娠终止率上升。本试验双半胚组双犊率为38.89%;冯春涛等[8]报道,鲜双半胚双犊率为36.9%。说明采用筛选后的分割方法使冷冻胚胎也可达到与鲜双半胚相近的双犊率。本试验中双半胚组、整胚组的犊牛成活率为88.00%、94.44%。裴燕等[14]报道,双半胚与整胚组犊牛成活率为72% 、90%;而冯春涛等[8]研究发现,双半胚与整胚的犊牛成活率为84.3%、93.3%。双半胚移植的犊牛成活率均低于整胚移植。这可能是因为双半胚移植产的犊牛体质较弱,需要加强双半胚移植后代犊牛后期护理,提高犊牛成活率。
4 结论
纯种西门塔尔牛冷冻胚胎解冻后用mCR1aa(后期)液培养45 min再分割,获得的半胚直接移植,可有效提高冷冻胚胎利用效率和分割后半胚移植妊娠率。

