DNMT3B基因对猪睾丸支持细胞迁移及下游相关基因表达的影响
汪 亮,丁良梅,刘 娣*
(1.黑龙江省农业科学院 畜牧研究所,哈尔滨 150086;2.黑龙江省农业科学院 博士后工作站,哈尔滨 150086)
环境温度是影响生猪生长、繁殖的重要限制性因素之一。在低温环境下,猪只经常会发生低温病,导致仔猪死亡、母猪生长缓慢,进而影响生猪生产[1]。民猪是在我国东北地区培育的能够适应寒冷环境的地方优秀猪种[2],研究民猪抗寒的分子机制及其遗传方式对于挖掘其优秀的遗传特性、促进优良基因利用和推动生猪生产具有重要意义。
表观遗传学是指不通过DNA序列的改变,而是通过DNA甲基化、染色体构象变化等方式将亲代对环境的反应传递给后代,使后代获得对类似环境的适应性[3]的一种遗传方式。精子是雄性个体向后代传递遗传信息的唯一渠道,而睾丸支持细胞(sertoli cells,ST)是构成曲细精管的唯一体细胞,为精子发育提供环境条件[4-5]。因此,ST细胞中的基因表达差异会影响精子发生,并进一步通过受精作用影响后代表型[6]。
DNA甲基转移酶3B(DNA methyltransferase 3B,DNMT3B)可以通过在基因组CpG二核苷酸胞嘧啶的第5位碳原子上加一个甲基改变基因组甲基化状态,以此抑制或关闭基因的表达,发挥调节作用[7-9]。前期研究表明,环境温度的改变会明显改变ST细胞中的DNMT3B基因的表达,进一步研究其对ST细胞迁移和下游基因的影响,特别是对组蛋白相关基因、热应激相关基因和细胞增殖凋亡相关基因的影响,对人们了解该基因对精子发育环境的影响及精子传递是否与民猪抗寒性状相关具有重要意义。
1 材料
1.1 试验细胞
ST细胞,购自通派(上海)生物科技有限公司。
1.2 主要试剂及仪器
RNAiso Plus(9109,TaKaRa)、反转录试剂盒(RR047A,TaKaRa),购自哈尔滨宝士德生物科技有限公司;荧光定量试剂 UltraSYBR Mixture(01170/30105),购自北京康为世纪生物科技有限公司;胎牛血清(FBS,A6806-31 NQBB),澳大利亚产;DMEM/F-12培养基(10092007,CORNING),美国产;Annexin V-FITC/PI,购自上海翊圣生物科技有限公司;PCR仪(TC-512),购自德国Biometro公司;电泳仪(DYY-12C),购自北京市六一仪器厂;凝胶成像系统(HR-7752),购自美国BIO-RAD公司;荧光定量PCR仪(Stepone),购自美国Applied Biosystems公司;二氧化碳培养箱(CB150),购自德国BINDER公司。
2 方法
2.1 DNMT3B真核表达载体的构建
2.1.1 ST细胞总RNA提取及反转录 采用TRIzol法提取对数期细胞总RNA,测定总RNA浓度和纯度,按TaKaRa反转录试剂盒说明书操作。
1)基因组DNA除去反应体系:5×gDNA Eraser Buffer 2μL,gDNA Eraser 1μL,模板RNA 1μg,加RNase Free Water至10μL。PCR反应条件:42℃2 min,16℃2 min。
2)逆转录反应体系的配制及反应体系:RT Primer Mix 1μL,5×PrimeScript Buffer 2 4μL,PrimeScript RT Enzyme MixⅠ1μL,RNase Free Water 4μL,加入步骤1)反应液10μL。PCR反应条件:42℃15 min,84℃5 s,16℃1 min。获得cDNA,于-20℃保存,用于后续试验。
2.1.2 DNMT3B基因的克隆测序 在NCBI中检索猪DNMT3B(NM_001348900.1)的CDS序列信息。利用Primer5.0软件分别设计上、下游引物,引物序列见表1。

表1 DNMT3B基因CDS区扩增引物序列
以2.1.1中得到的cDNA为模板,利用表1的引物扩增获取DNMT3B基因cDNA全长编码区序列。PCR扩增体系:2×Taq Master Mix 10μL,10μmol/L上下游引物各0.5μL,模板1μL,ddH2O补至20μL。降落PCR扩增程序:94℃5 min;94℃30 s,63℃30 s,72℃2 min,26个循环;94℃30 s,50℃30 s,72℃2 min,20个循环;72℃5 min;16℃1 min。以10 000 bp Marker作为参照,取6μL PCR产物用琼脂糖凝胶进行电泳检测。参照北京全式金生物公司试剂盒(EasyPure Quick Gel Extraction Kit,货号为EG101-01)说明书操作,纯化回收上述PCR产物,连接到pGM-T Vector(TIANGEN),构建pGM-T-DNMT3B质粒。连接体系:10×T4 DNA ligase Buffer 1μL,T4 DNA ligase 1μL,pGM-T载体1μL,目的基因胶回收产物4μL,ddH2O 3μL,在PCR仪中16℃过夜连接。连接产物转化到DH5α感受态细胞中,挑取单克隆,经菌液PCR鉴定后,选取阳性克隆送至北京擎科生物技术有限公司进行测序,测序结果用DNAMan、Premier 5.0等软件进行分析。
2.1.3 pcDNA3.1-DNMT3B真核表达载体的构建 扩大培养测序正确的单克隆菌液,按照TIANGEN质粒小提试剂盒说明书提取pGM-T-DNMT3B质粒,利用HindⅢ和EcoRⅠ两种限制性内切酶对pGM-T-DNMT3B重组质粒及pcDNA3.1(+)进行双酶切,反应体系:HindⅢ0.5μL;EcoRⅠ0.5μL;10×Buffer 1μL;Plasmid 1μL;ddH2O 7μL。反应条件:37℃10 min。经琼脂糖凝胶电泳后回收酶切后含DNMT3B基因产物及pcDNA3.1(+)载体酶切后产物。两者通过T4连接酶16℃过夜连接,经转化、涂板,单克隆鉴定阳性菌落(方法同2.1.2),最终获得pcDNA3.1-DNMT3B真核表达载体。
2.2 细胞划痕法测定DNMT3B基因过表达对细胞迁移的影响
将对数生长期ST细胞调整为细胞密度约10×105个/mL,接种于60 mm细胞培养皿中。次日将构建的绿色荧光蛋白真核表达载体pEGFP-N1空质粒、pcDNA3.1(+)空质粒组、pcDNA3.1-DNMT3B重组质粒瞬时转染到ST细胞中(转染步骤按照Lipofectamine 2000说明书进行)。24 h后将转染绿色荧光蛋白真核表达载体pEGFP-N1空质粒的细胞倒置于荧光显微镜下观察,确定转染效率;同时将转染pcDNA3.1(+)空质粒组及pcDNA3.1-DNMT3B重组质粒的ST细胞按5×104个/孔的密度接种于35 mm细胞培养皿,每组分别设3个重复。当培养皿底部被单层细胞覆盖时进行细胞划痕试验,步骤如下:用10μL无菌枪头在单层细胞表面轻轻划两条平行直线,用DPBS缓冲液轻轻冲洗脱落下来的细胞2次,向培养皿中加入含1%胎牛血清的DMEM培养液,放置于37℃、5%CO2培养箱中。细胞划痕后分别在第0,24,48,72小时检测细胞迁移情况,用倒置显微镜在同一视野50倍镜下对划痕拍照。采用Motic Image 2000 1.3软件测量不同时间点各组划痕宽度,0小时记为S0,t小时记为St,将对照组细胞相对迁移速率设为1,各试验组细胞相对迁移速率为迁移距离与对照组迁移距离的比值。
2.3 DNMT3B基因过表达对下游基因表达的影响
2.3.1 定量引物设计及DNMT3B基因在ST细胞中的过表达 将pcDNA3.1-DNMT3B重组质粒转染到对数生长期的ST细胞中,以pcDNA 3.1(+)质粒为对照组(转染步骤按照Lipofectamine 2000说明书进行),参照Real-time PCR引物设计原则,分别设计猪cDNA中DNMT3A、DNMT3B、常染色质组蛋白赖氨酸N-甲基转移酶2(Euchomatic hiST 细 胞 onelisine N-methyltransferase 2,EHMT2)、组蛋白脱乙酰酶1(histone deacetylase 1,HDAC1)、血红素加氧酶1(heme oxygenase 1,HMOX1)、热休克转录因子1(heat shock transcription factor 1,HSF1)、热休克蛋白70(heat shock protein 70,HSP70)、热休克蛋白90(heat shock protein 90,HSP90)、热休克蛋白1[heat shock protein family B(small)member 1,HSPB1]、tRNA-天冬氨酸甲基化酶(tRNA aspartic acid methyltransferase 1,TRDMT1)、CSD结构域的E1蛋白(cold shock domain containing E1,CSDE1)、特异性促凋亡因子DNA损伤诱导转录蛋白3(DNA damage inducible transcript 3,DDIT3)、蛋白精氨酸甲基转移酶5(protein arginine methyltransferase 5,PRMT5)、P53、Caspase3、C-myc基因定量引物,引物序列见表2。

表2 基因定量引物序列
2.3.2 下游基因的荧光定量检测 用TRIzol法 提取细胞总RNA,经反转录,得到cDNA,于-20℃保存。基因定量引物(见表2)进行实时荧光定量PCR反应,反应体系:cDNA样品0.5μL,2×SYBR Green PCR Mixture 10μL,上下游引物各0.5μL,灭菌水补充至20μL,每个样品重复3次。扩增条件:95℃10 min;95℃15 s;60℃1 min;72℃30 s,40个循环;溶解曲线程序:95℃15 s;60℃1 min;95℃15 s;60℃1 min。用相对定量分析方法,以β-ACTIN基因为内参,计算各基因相对表达量。
2.4 数据的统计分析
试验组内均设置3个重复,每个试验均重复3次。试验数据用GraphPad Prism 5.0、Motic Image 2000 1.3软件进行分析,采用单因素方差分析法进行差异显著性分析,当P<0.05时有统计学意义。
3 结果与分析
3.1 细胞总RNA的提取
采用TRIzol法提取细胞总RNA,1%琼脂糖凝胶电泳结果见图1。总RNA电泳显示出3条清晰亮带,由上至下分别为28S、18S、5S。经紫外分光光度计测定,提取的总RNA质量较好,可用于后续基因表达量的检测。
3.2 DNMT3B基因真核过表达载体的构建
3.2.1 猪DNMT3B基因PCR扩增结果 以猪ST细胞cDNA为模板进行DNMT3B基因CDS区PCR扩增,1%琼脂糖凝胶电泳检测结果见图2。DNMT3B基因在2 000~3 000 bp之间获得的片段与预期片段(2 571 bp)大小相符,清晰条带。
3.2.2 pGM-T-DNMT3B重组质粒构建及双酶切鉴定结果 将纯化获得的目的片段连接到pGM-T Vector载体上,转化纯化重组质粒,用HindⅢ和BamHⅠ对获得的pGM-T-DNMT3B质粒双酶切鉴定,酶切产物进行琼脂糖凝胶电泳,结果见图3。在2 000~3 000 bp中间位置获得与预期条带(2 571 bp)大小相符的条带,证明重组质粒已成功连接。经胶回收得到单一清晰条带,其菌液送往测序公司进行测序。
3.2.3 pcDNA3.1-DNMT3B重组质粒鉴定 将双酶切后纯化的DNMT3B基因片段与双酶切后纯化的pcDNA3.1(+)质粒片段进行连接、转化反应,构建成pcDNA3.1-DNMT3B重组质粒,以转化重组质粒的菌液提取质粒并用HindⅢ和EcoRⅠ进行酶切鉴定。琼脂糖凝胶电泳检测,在2 000~3 000 bp之间获得了DNMT3B基因片段,证明pcDNA3.1-DNMT3B重组质粒构建成功,见图4。
3.3 过表达DNMT3B基因对细胞迁移速率的影响
采用细胞划痕方法检测DNMT3B基因过表达对细胞相对迁移速率的影响,以pcDNA3.1(+)空载体及转染细胞组作为对照组和空白组,分别在0,24,48,72小时拍照,观察到24,48小时时转染pcDNA3.1-DNMT3B重组质粒的细胞迁移能力明显低于空白组和pcDNA3.1(+)空载体组。结果表明:过表达DNMT3B基因的ST细胞24小时时划痕的相对迁移率低于pcDNA3.1(+)空质粒转染组及未转染组细胞,为空白组迁移速率的0.512倍,差异显著(P <0.05);48小时时为空白组迁移速率的0.620倍且差异显著(P <0.05);72小时时为空白组迁移速率的0.799倍,但差异不显著。迁移速率结果见表3,DNMT3B基因过表达对猪ST细胞迁移的影响见图5。
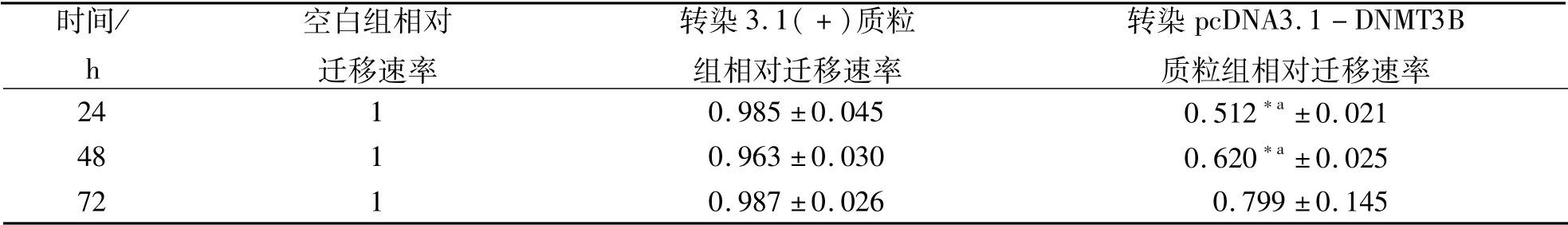
表3 DNMT3B过表达对猪ST细胞相对迁移距离的影响
3.4 过表达DNMT3B基因的ST细胞中下游基因相对表达量变化
Real-time PCR检测各组cDNA中DNMT3A、DNMT3B、EHMT2、HDAC1、HMOX1、HSF1、HSP70、HSP90、HSPB1、TRDMT1、CSDE1、DDIT3、PRMT5、P53、Caspase3、C-myc基因相对表达量,并用SPSS13.0软件对数据进行单因素一维方差分析,结果见图6。伴随着DNMT3B基因的过表达,DNMT3A、EHMT2、HDAC1、CSDE1、HSF1、P53、Caspase3、C-myc相对表达量升高,其中DNMT3A、HSF1、P53、C-myc相对表达量显著升高(P <0.05),分别为正常猪ST细胞的1.57,1.51,1.78,1.47倍;TRDMT1相对 表 达 量 略降 低;PRMT5、HSP70、HSP90、HMOX1、HSPB1、DDIT3相对表达量不变。
4 讨论
4.1 DNMT3B基因过表达对细胞迁移的影响
细胞迁移能力反映了细胞在特定环境下生长和运动的能力,细胞划痕试验是检测细胞迁移能力的方法。细胞的划痕修复能力能够反映细胞在某些特定环境或特定基因表达变化时的生长活性。本试验检测了ST细胞在正常培养、转染pcDNA 3.1空质粒和过表达DNMT3B基因条件下ST细胞的迁移情况,结果表明,DNMT3B基因的过表达会明显抑制ST细胞的迁移,并且这种抑制作用随着时间的增加而逐渐减弱。目前已知DNMT3A、DNMT3B具有DNA从头甲基化功能,可以增加DNA某些区段的甲基化水平,抑制或关闭相关基因的表达。朱慧等[10]在肝细胞癌的研究中发现,通过转染HbsAg基因抑制DNMT3B基因表达后肝癌细胞的增值受到抑制。而董高宏等[11]的研究则证明DNMT3B基因可能是通过Hippo信号通路发挥其对细胞生长的抑制作用。但彭芳等[12]在宫颈癌的研究中却发现,DNMT3B表达的升高会促进人宫颈癌细胞的生长和侵袭。这些研究表明,DNMT3B基因对细胞生物学行为的调控可能与细胞类型、生长环境等因素间存在复杂的相互作用关系,是调节细胞活力和运动的极为重要的基因。
4.2 DNMT3B基因过表达对下游基因影响分析
在检测的下游基因中包含了EHMT2和HDAC1,这两种基因与组蛋白修饰相关,它们的表达情况可以间接反映细胞核中染色体的包装状态。细胞通过这些组蛋白相关基因的表达来调节染色体上其他基因的表达与抑制。S.C.Hyun等[13]通过siRNA干扰敲低某些癌细胞中的EHMT2基因,结果抑制了膀胱癌、肺癌、前列腺癌和乳腺癌细胞的生长。而在大量医学研究中都发现,HDAC1广泛参与肿瘤细胞的生长、凋亡、侵袭和迁移等过程,干扰HDAC1表达能够降低子宫内膜癌细胞的迁移和侵袭能力[14]。本试验在ST细胞中过表达DNMT3B基因后检测EHMT2和HDAC1基因的表达,发现这两种基因的表达量仅略有升高,表明DNMT3B对其影响不大,DNMT3B对下游基因表达的影响并非通过调节组蛋白完成。
热应激蛋白(heat shock proteins,HSPs)家族中的HSP70和HSP90、CSDE1、HSF1、HSPB1等基因是与动物温度应激相关基因,是细胞在受到温度、PH值和渗透压等环境刺激时合成的一种保护性蛋白[15-17]。这些蛋白虽然成为热应激蛋白,但当生物体处在寒冷环境时这些蛋白的基因表达也会做出相应的调整。本试验中CSDE1、HSF1的表达有明显增高。说明DNMT3B能够通过对特定热应激蛋白类基因的甲基化作用影响动物对压力环境的反应。
凋亡基因Caspase3基因、癌基因P53基因和C-myc基因都在细胞增殖和凋亡过程中起着重要作用[18-19]。Caspase3基因是细胞凋亡的标记基因之一,功能涉及DNA修复和DNA完整性的监护。当Caspase3表达量增高时,引发裂解核小体间的DNA断裂,进而导致细胞凋亡[20]。C-myc具有抑制细胞分化及促进肿瘤转化的作用,在对未成熟胸腺细胞中C-myc表达研究中发现,过度表达的C-myc蛋白会导致胚胎胸腺细胞出现明显凋亡[21]。P53是一种抑癌基因,其蛋白可以调节细胞周期、保持基因组稳定性并避免细胞发生癌变[22-23]。因此这3种基因表达的上调表明DNMT3B具有抑制细胞生长的作用,这与本试验中DNMT3B抑制细胞迁移的结论相同。
5 结论
本试验通过在ST细胞中过表达DNMT3B基因,研究了其对细胞迁移生长和下游基因表达的影响,结果表明,DNMT3B基因具有广泛细胞生物学作用,它的过量表达具有促进癌基因表达、抑制细胞生长和迁移并提高特定热应激蛋白类基因表达量的作用。由此也可以推测,当动物遭遇逆境时DNMT3B基因表达量的变化将可能影响动物对环境的适应能力。

