老年大鼠肝脏和肠道自噬水平的变化及其在衰老相关炎症中的作用
晁欣,何玉廷,李希,任卫英
复旦大学附属中山医院老年病科,上海200032
炎性衰老是衰老的生物学标志之一,它是指衰老生物体的细胞和组织中具有较高的炎性标志物,从而导致低度慢性无菌的促炎状态[1]。自噬有助于提高免疫效应体对病原体的识别的功能,同时减轻炎症反应[2]。肝脏和肠道来源于同一胚层,肝脏是免疫反应的重要器官,肠道因其免疫和营养摄入功能,一直被认为是介导机体延长寿命的重要靶器官[3]。目前对于肝脏和肠道炎性衰老的机制还不清楚。本研究旨在通过观察自噬相关蛋白和促炎因子在老年大鼠肝脏和不同部位肠道(回肠、结肠)组织中的表达变化,研究自噬与炎症之间的关系,进一步阐明自噬在肝脏与肠道炎性衰老中的作用。
1 材料与方法
1.1.1 主要试剂 Trizol 裂解液(Sigama,美国),RNA逆转录试剂盒(Takara,日本),PCR 96 孔板(Corning,美国),SDS-PAGE 凝胶配制试剂盒(碧云天,中国),GAPDH 一抗(Proteintech,中国),LC3、P62 一抗(Cell Signaling Technology,美国),ZO-1、Occludin一抗(Abcam,美国),苏木素、伊红(Sigama,美国)。
1.1.2 主要仪器 纯水仪(Millipore,美国),PCR 扩增仪(ProFlex,美国)。
1.2 实验动物和标本获取SPF 级雄性Wistar大鼠购买自上海西普尔必凯实验动物有限公司,8 只12月龄大鼠自2017年9月1日购买之日起在复旦大学上海医学院实验动物中心继续饲养至2019年1月31日,达到29月龄(老年组),另取8 只3月龄大鼠作为对照组(成年组)。饲养环境为湿度40%和8h 照明的无菌环境,自由饮用蒸馏水和标准啮齿动物饲料。每周观察记录大鼠饮食饮水及生长情况,采取0.5%的戊巴比妥钠0.7g/mL 腹腔麻醉后处死实验大鼠,解剖取材符合相关动物伦理委员会规定。用高温高压消毒灭菌过的器械快速取部分肝左叶迅速放入冻存管再置于液氮罐中,再取一部分1.5×1×1cm 的肝左叶于3.5mL 4%多聚甲醛中固定;取大鼠回肠末端和结肠中段3cm于冻存管置于液氮罐暂存,再快速取回肠末端和结肠中段1.5×1×0.5cm 于4%多聚甲醛中固定。
1.3 肝脏、回肠和结肠组织形态学分析 各组织标本经过4%多聚甲醛固定24h后进行脱水石蜡包埋切取4m 组织切片进行苏木精和伊红(HE) 染色,在光镜下进行病理学观察。
1.4 Western Blot 检测肝脏和肠道组织中自噬相关蛋白LC3II、P62 及炎性小体NLRP3 表达 用高温高压消毒过且4℃预冷的器械剪取20mg 组织标本快速放入配置好的RIPA 裂解液中,匀浆后冰上静置1.5h,离心后提取上清蛋白,BCA 蛋白定量。配置12%的胶,等质量等浓度等体积上样,电泳恒压80V 跑胶至溴酚蓝指示线见底,转膜电流30mA,1.5h 湿转,10%脱脂牛奶封闭2 h,1∶1 000 的稀释比例稀释一抗GAPDH、P62、LC3II 和NLRP3,4℃摇床(慢)孵育过夜,1×TBST 清洗3 次后孵育二抗1h,1×TBST 清洗3 次,曝光机前显影,用Image pro plus 测量条带灰度值并用目的基因灰度值比内参GAPDH。
1.5 qRT-PCR检测肝脏和肠道组织中促炎因子TNF- 、IL-6、IL-1 和MMP-9 mRNA 的表达 按标准操作提取各组织标本RNA(所有过程均置冰且无酶操作)并测浓度,逆转录后实时定量PCR:95℃变性60sec 后进入PCR 扩增循环,具体参数为95℃,15sec;60℃,60sec,72℃,45sec×40 个循环。扩增结果采用实时定量PCR 分析程序测CT 值,计算2-△△ct 值,基因序列见表1。

表1 引物序列表
1.6 免疫组化检测回肠和结肠组织中Occludin、ZO-1蛋白的表达水平 组织经固定、脱水、石蜡包埋、切片(4m)、贴片,脱蜡至水,抗原修复20min,缓慢冷却至室温,3%双氧水37℃孵育10min,室温封闭1h,滴加一抗,4℃过夜,滴加二抗,室温孵育1h,显色、复染、盐酸乙醇分化、封片。每张切片各选取6 个视野,计算面密度(累计光密度/组织像素面积),areal density=IOD/AREA。
1.7 统计学分析 采用SPSS 21.0 统计软件对数据进行统计学分析,计量资料以均数±标准差(±s)表示,组间比较应用独立样本 检验,<0.05 为差异有统计学意义。
2.结果
2.1 老年大鼠肝脏、回肠和结肠的组织形态病理学改变
2.1.1 肝脏随增龄组织病理学改变 成年大鼠肝小叶结构清晰,肝索排列整齐,肝汇管区正常,胞核大小正常;老年大鼠肝脏出现明显脂肪变,肝细胞出现较多脂滴和脂肪空泡,肝汇管区有胆管增生并伴有炎性细胞浸润,见图1。
2.1.2 回肠与结肠随增龄组织病理学改变 回肠HE 染色病理学分析显示成年大鼠黏膜层肠上皮结构完整,单层柱状上皮细胞形态结构正常、排列紧密;固有层肠腺丰富,老年大鼠黏膜层局部可见上皮细胞脱落,固有层肠腺数量减少,结缔组织增生并伴有少量炎性细胞浸润且下肌层增厚明显,见图2。
2.2 老年大鼠肝脏和肠道组织中自噬相关蛋白LC3、P62表达的变化Western Blot 结果显示,与成年组大鼠相比,老年组大鼠肝脏LC3II 蛋白表达下降(<0.01),P62 蛋白表达上升(<0.01),见图3。回肠和结肠LC3II蛋白表达较成年组下降(<0.05),P62 蛋白表达较成年组增加(<0.01),见图4和图5。

图1 两组大鼠肝组织的病理学改变(HE 染色)。
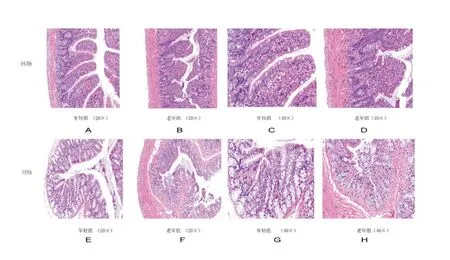
图2 两组大鼠的回肠和结肠组织病理改变(HE 染色)。
2.3 老年大鼠肝脏和肠道组织中促炎因子的表达变化qRT-PCR 检测结果显示,与成年组相比,老年组大鼠肝脏促炎因子白细胞介素-1 (interleukin-1 ),肿瘤坏死因子(tumor necrosis factor- ,TNF- ),白介素6(interleukin-6),基质金属蛋白酶9(MMP-9)的表达水平增加(<0.05),见图6。回肠中MMP-9,IL-1表达增加(<0.01),IL-6,TNF- 表达增加(<0.01),见图7。结肠中IL-6,IL-1 ,TNF- 表达增加(<0.01),MMP-9 表达增加(<0.05),见图8。IL-1 在老年大鼠和成年大鼠肝脏与肠道中的表达差相较于其他促炎

图3 两组大鼠肝脏自噬相关蛋白LC3,P62 表达,**<0.01。

图4 两组大鼠回肠组织自噬相关蛋白LC3,P62 的表达,*<0.05,**<0.01。

图5 两组大鼠结肠自噬相关蛋白LC3,P62 的表达,<0.05,**<0.01。

图6 两组大鼠肝脏促炎因子mRNA 的表达,**<0.05,**<0.01。

图7 两组大鼠回肠组织中各促炎因子的mRNA 表达mRNA 表达*<0.05,**<0.01。
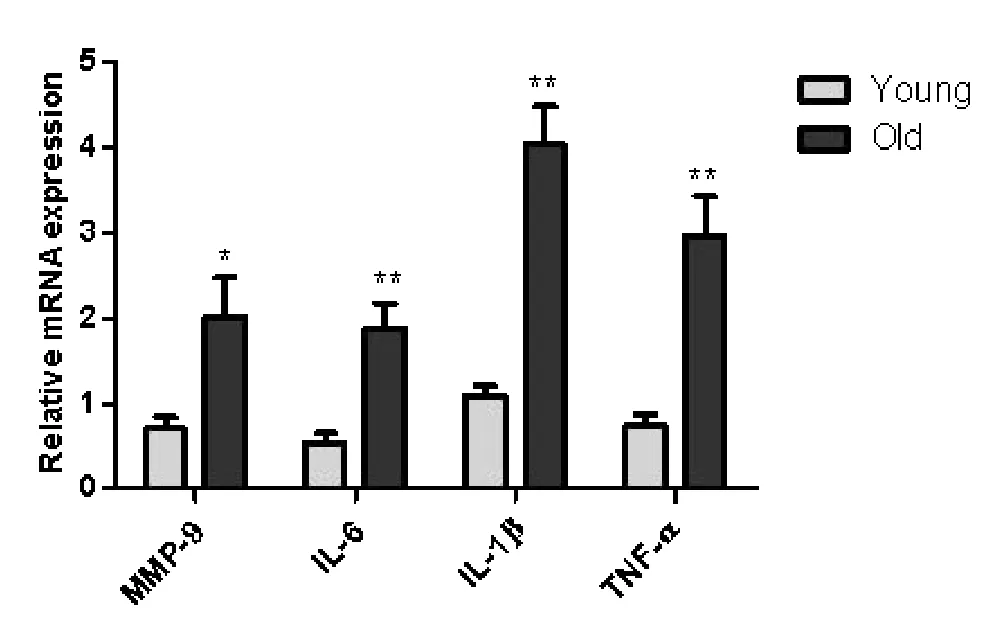
图8 两组大鼠结肠组织中各促炎因子的mRNA 表达*<0.05。
2.4 老年大鼠肝脏和回肠、结肠中NLRP3 蛋白的表达变化 Western Blot 结果显示,与成年组大鼠相比,老年组大鼠肝脏NLRP3 蛋白表达增加(<0.05),见图9。老年组大鼠回肠和结肠NLRP3 蛋白表达增加(<0.01),见图10 和图11,差异均具有统计学意义。

图9 两组大鼠肝脏炎性小体NLRP3 蛋白的表达(*<0.05)。

图10 两组大鼠结肠炎性小体NLRP3 蛋白达(**<0.01)。
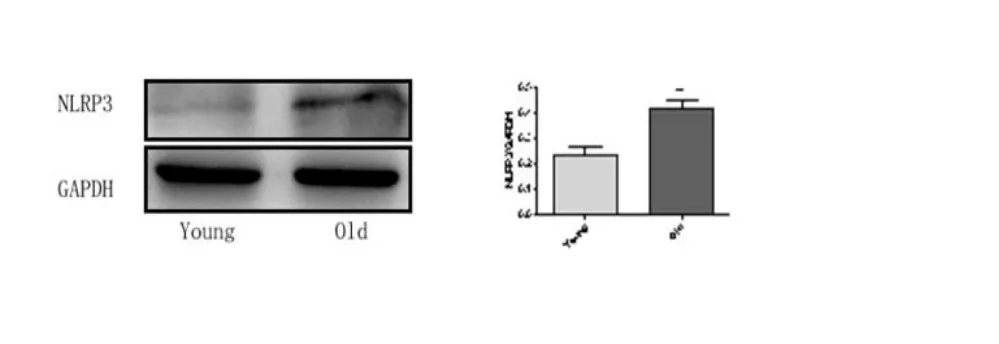
图11 两组大鼠结肠炎性小体NLRP3 蛋白的表达(**<0.01)。
2.5 老年大鼠回肠和结肠中紧密连接蛋白Occludin 和ZO-1 的表达变化 免疫组化结果显示:与成年组对比,老年大鼠回肠中 Occludin, ZO-1 表达下降(<0.01),老年大鼠结肠中Occludin, ZO-1 表达下降(<0.05),表明大鼠衰老过程中肠道紧密连接蛋白减少,肠道屏障功能障碍,见图12。
3 讨论
炎性衰老是指衰老过程中伴随的低度炎症反应状态[4],肝脏的始基由前肠胚层发育而来[5],肝脏的衰老又加速了肝脏相关疾病的进程[6]。病理学结果分析得知肝脏有炎性细胞浸润且出现脂肪变,符合肝脏衰老的组织学表现,且肠道组织病理学结果显示肠道固有层肠腺萎缩,有炎症细胞灶性浸润,提示肠道整体呈现出萎缩衰老状态。
自噬涉及多种如发育,细胞分化,对病原体的防御和营养饥饿等生物学功能[7]。在自噬过程中,胞质形式的LC3(LC3-I)与磷脂酰乙醇胺偶联,形成具有膜结合能力LC3-II,随后募集到自噬体膜上[8],自噬底物P62 也可反应自噬活性[9]。自噬流受阻伴随着p62 的积累。本次研究发现:29月龄Wistar 大鼠的肝脏、回肠和结肠组织中的LC3II 蛋白相较于成年组表达下降,P62 表达增高,表明老年大鼠肝脏和不同肠段自噬水平下降,同时发现,29月龄老年大鼠肝脏,回肠和结肠中的多种促炎因子(IL-6、IL-1 、TNF-、MMP-9)基因表达相较组升成年组增高,提示肝脏和肠道存在慢性炎症状态,并且反应了炎性衰老的系统性特点。根据前期研究,自噬通过至少两种方式来保护细胞免受过度持久的炎症影响:(1)通过允许有效清除受损的细胞器(例如线粒体)或细胞内病原性微生物(它们都构成有效的炎症刺激)而间接清除;护细胞免受过度持久的炎症影响:(1)通过允许有效清除受损的细胞器(例如线粒体)或细胞内病原性微生物(它们都构成有效的炎症刺激)而间接清除;以及(2)通过抑制促炎复合物[10]。另外,炎性小体的活化也参与了肝脏的衰老[11]。
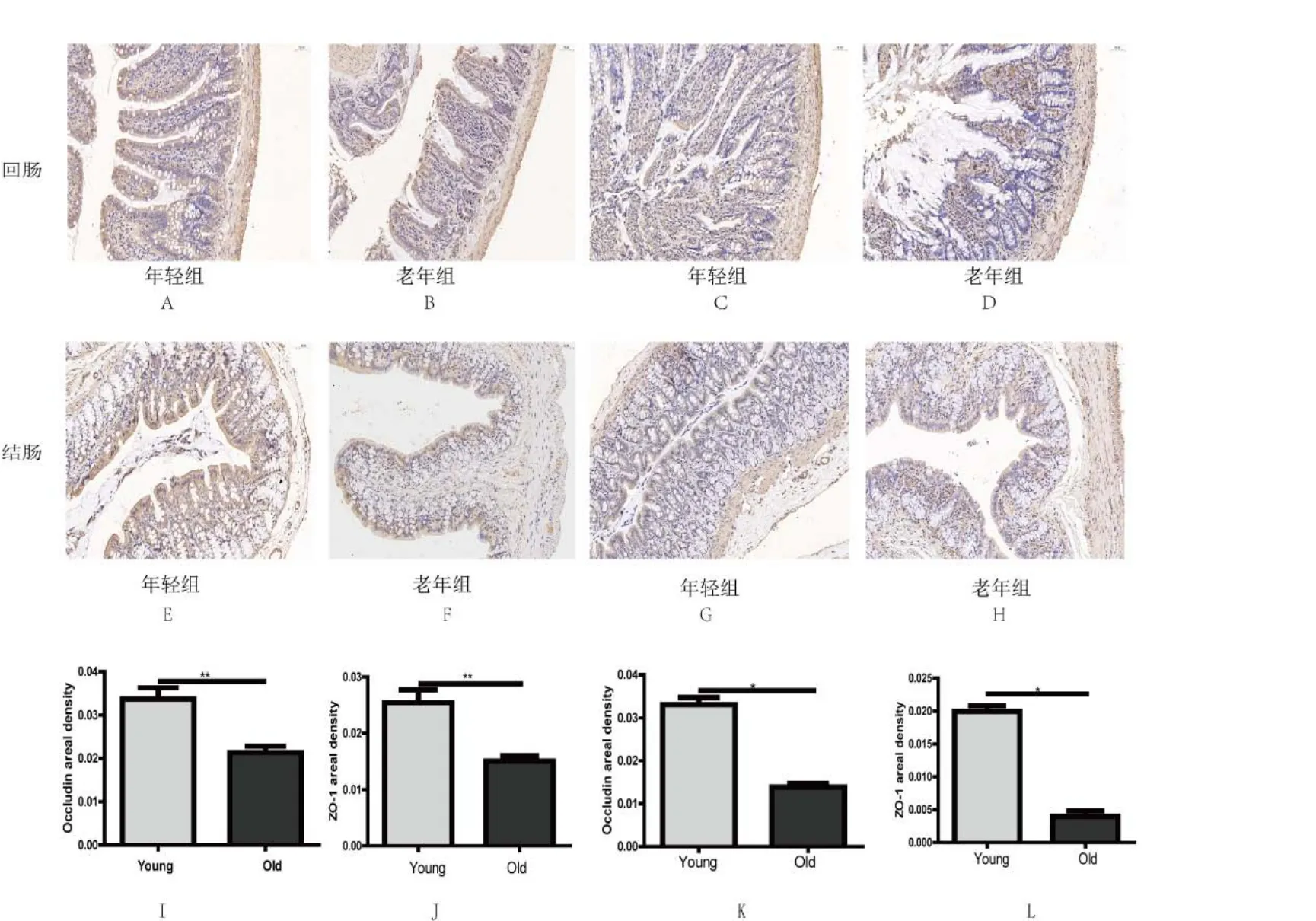
图12 两组大鼠回肠与结肠中肠道紧密连接蛋白Occludin,ZO-1 的表达(A、B、E、F:Occludin 蛋白;C、D、G、H:ZO-1 蛋白;I:回肠中Occludin 蛋白表达;J:回肠中ZO-1 蛋白表达;K:结肠中Occludin 蛋白表达;L:结肠中ZO-1 蛋白表达变化;*<0.05,**<0.01。
自噬不仅维持细胞器的稳态,而且参与线粒体的稳态。自噬水平下降,线粒体损伤不断累积,导致线粒体进行性解偶联,从而导致生物能不足和活性氧(ROS)产生增加[12]。肠道与肝脏均是线粒体最活跃的组织之一,自噬水平下调影响了ROS,ROS 可直接激活NLRP3 受体,还可通过引发硫氧还蛋白互作蛋白(Thioredoxin interacting protein,TXNIP)构象变化间接活化NLRP3 炎性小体[13]。而炎性小体NLRP3能够识别多种病原相关分子模式,当其激活后,进而激活caspase-1,切割pro-IL-1 和pro-IL-18 形成成熟形式而发挥作用[14]。巨噬细胞中的NLRP3 炎性小体活化后分泌IL-1 和IL-18 来促进嗜中性粒细胞趋化[15],IL-1 释放后加强NF-KB 的活化[16],NF-KB 进入细胞核调节促炎的基因如IL-1,IL-6 和TNF- 等的表达。因此结合本次研究结果可以推测,在肝脏与肠道衰老过程中,自噬清除能力下降,功能失调的线粒体和蛋白积累,导致活性氧产物增加和氧化应激反应;炎性小体NLRP3 被激活,引发肝脏与肠道的炎症级链反应,导致肝肠促炎相关因子增加。
此外,本研究还发现,29月龄大鼠回肠和结肠肠道紧密连接蛋白Occludin,ZO-1 相较成年均降低。肠道形态学病理分析结果提示肠道组织退行性变,炎症反应增加,对肠道稳态的维持起到负面调控。肠屏障是构成抵抗外部环境的最重要屏障的一层[17],最新研究发现,自噬可通过TJ 蛋白claudin-2 的溶酶体降解选择性地降低离子和小分子的上皮TJ 渗透性[18]。自噬功能下降,ROS 增加,炎症小体被激活,促炎与抗炎反应失衡,形成肠道的慢性炎症状态;而肠道慢性炎症状态又加速衰老,呈恶性交互作用,可致肠道稳态失衡,进而影响肠道通透性以及肝脏参与的全身代谢反应。
综上所述,自噬可能参与肝脏和肠道的衰老并在其炎性衰老中起到重要作用,但相关作用机制有待进一步研究。既往研究显示二甲双胍可通过多种信号通路如AMPK 激活自噬,改善炎症反应。自噬的激活剂还包括雷帕霉素,白藜芦醇等[19]。后续将在细胞和动物水平通过靶向药物干预进一步探讨自噬与炎症的对话机制。

