新型冠状病毒肺炎治疗中抗病毒药物的合理使用
徐晓涵,翟所迪,杨 丽
(北京大学第三医院药剂科,北京 100191)
目前,针对2019年暴发的严重急性呼吸综合征冠状病毒2型(severe acute respiratory syndrome coronavirus 2,SARS-CoV-2)所致疫情,抗病毒药主要基于阻断病毒的入侵及扩散、抑制病毒核酸复制及病毒蛋白合成、调节机体的抗病毒免疫和联合性治疗等方面发挥作用[1]。国家卫生健康委员会最新发布的《新型冠状病毒肺炎诊疗方案(试行第六版)》(以下简称“第六版方案”)中推荐可试用的抗病毒药物治疗方案包括α干扰素(interferon-α,IFN-α)、洛匹那韦/利托那韦、利巴韦林、阿比多尔和磷酸氯喹[2-3],大多是从治疗严重急性呼吸综合征冠状病毒(severe acute respiratory syndrome coronavirus,SARS-CoV)和中东呼吸综合征冠状病毒(Middle East respiratory syndrome coron-avirus,MERS-CoV)的临床经验而来的。为了协助临床诊疗工作,让患者得到更合理的药物治疗,现根据药物特性和合理使用证据,对上述5种化学抗病毒药的人群选择、剂型与规格、用法及用量、不良反应和相互作用等方面进行整理,汇总如下。
1 IFN-α
IFN-α为氨基酸组成的多肽,可与细胞膜上特殊受体结合后抑制若干酶系统,增强细胞免疫功能,阻止病毒RNA转录、翻译和蛋白质的合成,具有广谱的抗病毒活性[4]。IFN-α在SARS-CoV-2感染患者的联合治疗中有协同作用,特别对感染初期患者有效性高,建议在确诊SARS-CoV-2感染后尽早使用IFN-α,在48 h内使用[4]。
1.1 IFN-α的人群选择
IFN-α的人群选择见表1[4-5]。
1.2 IFN-α的剂型与规格
IFN-α的剂型与规格:目前,我国批准上市的非长效IFN-α有IFNα-2a、IFNα-2b和IFNα-1b 3种亚型,均多为基因重组产品,IFNα-2b相对证据更多,但三者在基因来源、分子结构、抗病毒、免疫调节作用及不良反应等方面存在一定差异,见表2[6-7]。根据不同亚型药物对于同一疾病的药品说明书常规用量推算,1 μg=1百万国际单位(MIU)=10万IU。
1.3 IFN-α的用法与用量
IFN-α的用法与用量见表3[2,7]。(1)注射剂雾化给药:对于非长效的普通重组人干扰素注射用剂型雾化给药,虽然受到空气射流冲击重组人干扰素分子会出现二硫键断裂,但其生物活性基本保留,且不会导致变态反应等不良反应[8-9]。与肌内注射相比,雾化吸入可加快干扰素在肺组织分布并提高浓度,延迟血药浓度达峰时间和药物代谢时间[10]。(2)雾化液配制浓度要求:目前,对于IFN-α的雾化,建议每次使用灭菌注射用水2 ml[2]。而王兵等[11]的研究结果表明,重组人干扰素分子二硫键的破坏程度与雾化液浓度呈负相关,为了减少耗损,建议不超过100万IU/ml。临床上,常见小容积雾化器储药罐容积限量10~20 ml,一般加药量为2~6 ml,为了提高重组人干扰素的疗效,若条件允许,可增加灭菌注射用水或0.9%氯化钠注射液的用量。(3)雾化治疗风险防控:由于雾化产生气溶胶可污染室内空气,可能导致医患之间以及患者之间的交叉感染,应尽量避免气溶胶散播。雾化应结合储雾罐(也可用延长管代替)方式,面罩或鼻罩尽可能贴合面部,减少漏气;全脸面罩和头盔会导致雾化吸入的药物沉积在眼睛中,不推荐使用;有创通气患者应选用配备雾化功能的呼吸机进行雾化(呼气支加用带吸附功能的过滤器过滤);宜设置低流量和方波送气以及较长的吸气时间,有利于气溶胶在肺内的沉积[12]。(4)注射给药:IFN-α注射剂型的药品说明书批准的给药途径为肌内注射、皮下注射和病灶注射。对于成人和>4个月的儿童SARS-CoV-2感染患者,皮下注射和肌内注射IFN-α的有效性、安全性及耐受性良好[7,13]。

表1 IFN-α的人群选择

表2 IFN-α的剂型与规格

表3 IFN-α的用法与用量
1.4 IFN-α的不良反应
注射使用IFN-α的不良反应多为可耐受的血红蛋白水平降低、氨基转移酶水平升高以及淀粉酶水平升高,对甲状腺功能有影响,可导致甲状腺功能减退或甲状腺功能亢进,但多数不影响治疗[13]。雾化使用IFN-α基本无明显不良反应,安全性高[10]。药学监护建议对患者血常规、肝功能和甲状腺功能等指标加强监测。
1.5 IFN-α与药物的配伍禁忌和相互作用
IFN-α与药物的配伍禁忌和相互作用见表4[5,11]。

表4 IFN-α与药物的配伍禁忌和相互作用
2 洛匹那韦/利托那韦
洛匹那韦是一种蛋白酶抑制剂,主要通过阻断Gag-Pol多聚蛋白的裂解产生抗病毒作用,通常与利托那韦联合应用,通过抑制肝药酶CYP来延长洛匹那韦的半衰期。洛匹那韦/利托那韦与SARS-CoV-2有明确结合位点,体外实验结果显示,其能在一定程度上抑制冠状病毒活性[4]。
2.1 洛匹那韦/利托那韦的人群选择
洛匹那韦/利托那韦的人群选择见表5[14]。
2.2 洛匹那韦/利托那韦的剂型与规格
洛匹那韦/利托那韦的剂型与规格见表6。

表5 洛匹那韦/利托那韦的人群选择

表6 洛匹那韦/利托那韦的剂型与规格
2.3 洛匹那韦/利托那韦的用法与用量
洛匹那韦/利托那韦的用法与用量见表7[15]。
2.4 洛匹那韦/利托那韦的不良反应
洛匹那韦/利托那韦的不良反应见表8[15]。

表7 洛匹那韦/利托那韦的用法与用量

表8 洛匹那韦/利托那韦的不良反应

表9 洛匹那韦/利托那韦的药物相互作用
2.5 洛匹那韦/利托那韦的药物相互作用
洛匹那韦/利托那韦的药物相互作用见表9[16]。
3 利巴韦林
利巴韦林为核苷类抗病毒药,当微生物遗传载体类似于嘌呤RNA的核苷酸时,利巴韦林可干扰病毒复制所需的RNA代谢而具有广谱抗病毒作用[17]。
3.1 利巴韦林的人群选择
利巴韦林的人群选择见表10[17-18]。

表10 利巴韦林的人群选择
3.2 利巴韦林的剂型与规格
利巴韦林的剂型与规格见表11[6]。

表11 利巴韦林的剂型与规格
3.3 利巴韦林的用法与用量
利巴韦林的用法与用量见表12[18]。
3.4 利巴韦林的不良反应
利巴韦林的不良反应见表13[18-19]。
3.5 利巴韦林的药物相互作用
利巴韦林的药物相互作用见表14[18]。

表12 利巴韦林的用法与用量
4 磷酸氯喹
氯喹最初被用于疟疾的治疗,其还具有广泛免疫调节作用。磷酸氯喹为氯喹的磷酸盐,其可能通过提高细胞内pH而阻断病毒感染,同时干扰病毒的细胞受体血管紧张素转换酶Ⅱ的糖基化过程,阻断SARS-CoV-2侵染细胞[19-20]。

表13 利巴韦林的不良反应

表14 利巴韦林的药物相互作用
4.1 磷酸氯喹的人群选择
磷酸氯喹的人群选择见表15[2]。

表15 磷酸氯喹的人群选择
4.2 磷酸氯喹的剂型与规格
目前,于中国临床试验注册中心正式注册且获得伦理委员会批准的关于SARS-CoV-2感染疾病的临床试验均使用磷酸氯喹片。磷酸氯喹片的规格为1片0.075或0.25 g;0.25 g相当于氯喹0.16 g。
4.3 磷酸氯喹的用法与用量
目前,第六版方案推荐磷酸氯喹用于治疗COVID-19的剂量为1次500 mg,1日2次,疗程≤10 d[2]。2020年2月26日,国家卫生健康委员会与国家中医药管理局办公室联合发布《关于调整试用磷酸氯喹治疗新冠肺炎用法用量的通知》(国卫办医函〔2020〕165号)(以下简称《通知》),进一步明确:体质量>50 kg者,1次500 mg,1日2次;体质量≤50 kg者,第1—2日,1次500 mg,1日2次,第3—7日,1次500 mg,1日1次;疗程均为7 d。虽然最新《通知》较第六版方案下调了磷酸氯喹剂量,但其在体质量>50 kg人群中的给药剂量仍高于其他适应证常用量。按照1次0.5 g,1日2次的给药方案,以半衰期为48 h模拟计算,连续给药7 d后患者体内残留的磷酸氯喹可达3 g。
目前,已有多项磷酸氯喹治疗COVID-2019的研究正在开展,其中2项研究提及了磷酸氯喹的具体剂量,分别为:(1)第1—2日,1 g/d;第3日起,0.5 g/d;总疗程14 d[21]。(2)第1—3日,1次500 mg,1日2次;第4—10日,1次250 mg,1日2次;总疗程10 d[22]。
综上,考虑COVID-19患者人群年龄偏大,结合磷酸氯喹的药动学特点,建议降低磷酸氯喹的给药剂量,可试用首日剂量1 000 mg,分2次给药,1次500 mg;第2日起,1次500 mg,1日1次,疗程5~7 d,具体视患者反应和转归情况而定;或参考上述临床试验中的给药方案。肾功能减退者、出现严重消化道反应者应减量,缩短给药疗程甚至停用。目前尚无对儿童的具体剂量推荐,建议对于COVID-19儿童患者应用磷酸氯喹时应谨慎。
4.4 磷酸氯喹的不良反应
磷酸氯喹的不良反应见表16[23-24]。
4.5 磷酸氯喹的药物相互作用
磷酸氯喹的药物相互作用见表17[23,25]。

表16 磷酸氯喹的不良反应

表17 磷酸氯喹的药物相互作用
5 阿比多尔
阿比多尔为血凝素抑制剂,可特异性抑制病毒与宿主细胞膜的融合而抑制病毒DNA、RNA合成,还可诱导干扰素的生成而发挥调节机体免疫的功能,具有广谱抗病毒活性[26]。
5.1 阿比多尔的人群选择
阿比多尔的人群选择见表18[2,27]。

表18 阿比多尔的人群选择
5.2 阿比多尔的剂型与规格
国内批准上市的阿比多尔主要为片剂(薄膜衣片剂和分散片)、胶囊剂,规格均为0.1 g。
5.3 阿比多尔的用法与用量
阿比多尔的用法与用量见表19[2,28]。
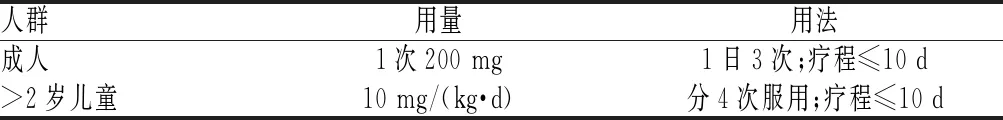
表19 阿比多尔的用法与用量
5.4 阿比多尔的不良反应
阿比多尔的不良反应少,主要表现为恶心、腹泻、头晕和血清氨基转移酶升高,该药在俄罗斯和我国应用多年,未见与药品相关的严重不良事件的报道[29-30]。
5.5 阿比多尔的药物相互作用
阿比多尔的药物相互作用见表20[30]。

表20 阿比多尔的药物相互作用
6 总结
5种用于治疗SARS-CoV-2感染的抗病毒药使用过程中需注意的内容各不相同:注意IFN-α给药方式的选择和使用过程中感染的防控;注意洛匹那韦/利托那韦与其他药物的相互作用;注意利巴韦林的用法与用量,大剂量应用时应加强不良反应监测;注意磷酸氯喹的用法、用量和治疗窗;使用阿比多尔时,应考虑与其他药物的相互作用等。联合用药时,更需在治疗期间密切监测相关指标。抗SARS-CoV-2治疗有效性和安全性的研究在持续进行,期待更多可靠证据。
抗SARS-CoV-2的药物治疗原则为尽早使用、可以联合使用,目前不推荐3个以上抗病毒药同时使用,注意合理用药。

