洛匹那韦/利托那韦药物相互作用研究进展
苏丹 张蕾 沈爱宗
摘 要 目的:了解洛匹那韦/利托那韦(LPV/r)药物相互作用的研究进展,为其临床安全、合理、有效使用提供参考。方法:以“洛匹那韦/利托那韦”“药物相互作用”“药物代谢酶”“细胞色素”“药动学”“药效学”“Lopinavir/ritonavir”“Drug-drug interaction”“Herb-drug interactions”“Drug-metabolizing enzymes”“Cytochrome”“Pharmacokinetics”“Pharmaco-dynamics”等为关键词,在中国知网、万方数据、维普网、PubMed、Micromedex等数据库中组合查询2000年2月-2020 年2月发表的相关文献,对复合型蛋白酶抑制LPV/r治疗人类免疫缺陷病毒感染等疾病时与其他药物联用时的相互作用进行综述。结果:LPV/r主要经肝脏细胞色素 P450(CYP)酶代谢,并可抑制转运蛋白P-糖蛋白(P-gp),对药物代谢酶和转运体有广泛的作用,在联合用药中LPV/r或CYP3A底物暴露量的增加可导致显著的不良反应,或致使LPV/r疗效丧失并产生耐药性。结论:临床上LPV/r与其他药物联合使用广泛,与经相关酶或转运体代谢的药物联用时需考虑其用药剂量的调整,充分考虑可能出现的药物相互作用或潜在风险,并结合患者的个体差异,选择相互作用较小的药物,同时加强相关药学监护。
关键词 洛匹那韦/利托那韦;细胞色素P450酶;P-糖蛋白;药物相互作用
洛匹那韦/利托那韦(LPV/r)是第一个上市的复合型蛋白酶抑制剂,是在2000年被美国食品和药物管理局(FDA)批准的由洛匹那韦与利托那韦组成的一种复合制剂[商品名:克力芝(Kaletra)][1]。LPV/r的配方为200 mg/80 mg的洛匹那韦与50 mg/20 mg的利托那韦(即洛匹那韦-利托那韦质量比为4 ∶ 1),其配伍机制是小剂量的利托那韦对细胞色素P450(CYP)3A4酶有强烈的抑制作用,从而增强洛匹那韦的生物利用度[2]。目前,LPV/r主要用于人类免疫缺陷病毒(HIV)感染/艾滋病(AIDS)、重症急性呼吸综合征(SARS)、中东呼吸综合征(MERS)、新型冠状病毒肺炎(COVID-19)等患者的治疗[3-5]。这些疾病的患者也往往伴随众多基础疾病,如高血压、糖尿病、慢性阻塞性肺疾病等,这使得临床上药物联合应用的情况十分普遍。药物相互作用是一种临床常见的影响药物疗效的因素[6]。LPV/r主要通过CYP酶代谢,可与经过这些酶代谢途径消除的药物发生相互作用;另外,LPV/r在药物吸收和转运过程中受转运体介导,因而与经过相关转运体途径分布的药物也可发生相互作用[6]。因此,笔者以“洛匹那韦/利托那韦”“药物相互作用”“药物代谢酶”“细胞色素”“药动学”“药效学”“Lopinavir/ritonavir” “Drug-drug interaction”“Herb-drug interactions” “Drug-metabolizing enzymes” “Cytochrome” “Pharmacokinetics” “Pharmaco-dynamics”等为关键词,在中国知网、万方数据、维普网、PubMed、Micromedex等数据库中组合查询2000年2月-2020 年2月发表的相关文献,就LPV/r临床使用中可能产生的药物相互作用作一综述,以期为提高LPV/r临床用药的安全性和有效性提供参考。
1 LPV/r的药物相互作用机制
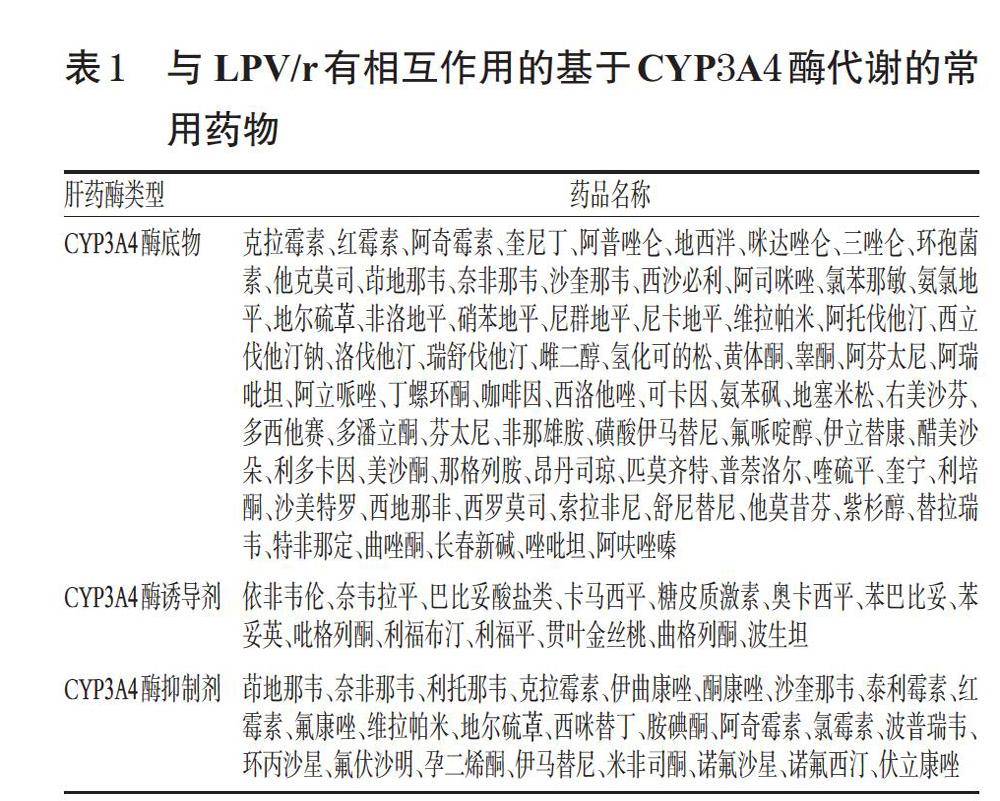
LPV/r是CYP异构体CYP3A酶的体外抑制剂,该药与通过 CYP3A 酶代谢的药物(如硼替佐米、氟康唑、利福布汀等)联用时可能会增加药物的血药浓度,进而导致药物作用时间延长和不良反应发生的增加[7]。与 LPV/r有相互作用的基于CYP3A4酶代谢的常用药物见表1。在临床用药浓度范围内,LPV/r不會抑制CYP2D6、CYP2C9、CYP2C19、CYP2E1、CYP2B6 或 CYP1A2 酶的活性[7]。已经证明,LPV/r在体内能够诱导其自身代谢,并且可以增加一些药物如丙戊酸、拉莫三嗪等的生物转化,这些药物通过CYP 酶系(包括CYP2C9和CYP2C19)与葡萄糖醛酸结合进行代谢,而LPV/r有可能降低这类合用药物的血药浓度从而影响药物的疗效[7]。P-糖蛋白(P-gp)是一种膜结合的细胞转运蛋白,抑制或诱导P-gp可影响药物的吸收率;利托那韦就是一种P-gp强抑制剂,对药物相互作用有很大的影响。Sato T等[8]研究发现,白蛋白水平较低的慢性病患者使用利托那韦,可增强基于有机阴离子转运多肽4C1(OATP4C1)介导的药物相互作用。
2 与LPV/r有相互作用的常用药物
2.1 抗病毒药物
2.1.1 核苷类反转录酶抑制剂(NRTIS) LPV/r可显著增加替诺福韦的血药浓度[9],使受试者工作特征曲线(ROC)下面积(AUC)升高32%、谷浓度(cmin)降低51%、达峰浓度(cmax)不变,而高浓度的替诺福韦可导致相关不良反应,引起肾小管损伤和慢性肾脏疾病[10]。阿巴卡韦/齐多夫定可导致葡萄糖醛酸苷化增强,LPV/r与之联用后可同时降低阿巴卡韦和齐多夫定的血药浓度,但两药血药浓度降低的临床意义尚未知[7]。
2.1.2 非核苷类反转录酶抑制剂(NNRTIS) LPV/r与依非韦伦(600 mg,qd)联用时,LPV/r的AUC或cmin降低,两者联用时LPV/r的剂量应增加至500 mg/125 mg,bid[11]。依曲韦林主要通过CYP2C9、CYP2C19和CYP3A酶代谢,LPV/r与依曲韦林联用时,CYP2C9、CYP2C19酶的表型会对依曲韦林的药动学产生影响,使其AUC下降35%、cmin下降45%、cmax下降30%[11]。LPV/r联用可导致利匹韦林的血药浓度升高、AUC升高52%、cmin升高74%、cmax升高29%,但联用时无需调整剂量[7]。
2.1.3 HIV趋化因子受体5(CCR5)拮抗劑 马拉韦罗是CYP3A4酶的底物,LPV/r与马拉韦罗联用时,由于LPV/r对CYP3A酶的抑制,会使马拉韦罗的AUC升高295%、cmax升高97%。与LPV/r(400 mg/100 mg,bid)联用时,应将马拉韦罗的剂量减至150 mg,bid[7]。
2.1.4 整合酶抑制剂 雷特格韦是AIDS抗病毒药物中的第一个整合酶抑制剂,可与整合酶的镁或镁的辅酶因子结合,阻止前嵌合复合体形成,从而抑制链转移反应。与LPV/r联用时,雷特格韦的AUC和cmax不变、c12 h降低30%,但洛匹那韦的药动学参数不变,故无需进行剂量调整[12]。
2.1.5 融合酶抑制剂 LPV/r与长效HIV-1融合酶抑制剂艾博韦泰联用,对艾博韦泰的暴露量影响较小,会降低LPV/r的血浆暴露量,但药物相互作用可能不会降低两药联合应用的药效[7]。
2.1.6 其他HIV蛋白酶抑制剂 LPV/r与福沙那韦联用后,可显著降低洛匹那韦的暴露量,其抗病毒的作用没有增强,而胃肠道不良反应事件和三酰甘油水平升高的发生率反而增加[13]。茚地那韦、阿扎那韦分别与LPV/r联用时,茚地那韦的cmax上升3.5倍,阿扎那韦的血浆浓度明显升高[7]。替拉那韦与利托那韦(500 mg/100 mg,bid)联用,可使利托那韦的AUC降低55%、cmax降低47%、cmin降低70%[8]。阿米那韦与利托那韦联用后,联合用药的cmax和AUC0-∞分别为单用阿米那韦(400 mg)的11%和28%[13]。
2.1.7 直接抗病毒药物(DAAs) 格卡瑞韦/派仑他韦用于治疗基因1、2、3、4、5或6型慢性丙型肝炎(HCV)感染的无肝硬化或代偿期肝硬化的成人患者具有良好疗效[14]。与利托那韦联用后,格卡瑞韦的AUC增加了4倍,而派仑他韦的浓度无变化[15]。艾尔巴韦/格拉瑞韦均为CYP3A酶和P-gp的底物,Feng HP等[16]研究发现,LPV/r显著增加了艾尔巴韦/格拉瑞韦的暴露量,艾尔巴韦几何均数稳态AUC0-2 h为 3.71[90%置信区间(CI):3.05~4.53]。因此,对于正在接受艾尔巴韦/格拉瑞韦治疗的HCV/HIV合并感染者,不宜使用HIV蛋白酶抑制剂。
2.2 抗菌药物
吡咯类抗真菌药是CYP3A4酶和P-gp的抑制剂,LPV/r可使该类药物的血浆浓度明显升高,因此联用时需减小抗真菌药的剂量[17]。利托那韦联合伊曲康唑或酮康唑可抑制疣状瓶霉的生长,但利托那韦与氟康唑联用时具有风险警示的禁忌[18]。小剂量的利托那韦可与伏立康唑联用,但应根据治疗药物监测(TDM)来调整伏立康唑的剂量[19]。酮康唑通过抑制P-gp可使利托那韦在脑脊液中的浓度升高,可用于中枢神经系统并发症的治疗,但一般不推荐LPV/r与高剂量的酮康唑(>200 mg/d)或伊曲康唑(>200 mg/d)联用。由于LPV/r可抑制CYP3A酶,故可预测LPV/r与克拉霉素联用时,克拉霉素的AUC会轻度增加,因此对于肾功能不全的患者应减少克拉霉素的用药剂量[7]。
利福平可诱导CYP3A酶,降低HIV/梅毒(TB)合并感染患者中洛匹那韦的浓度,因此对此类患者使用超剂量的LPV/r(800 mg/200 mg或400 mg/100 mg)是安全有效的[20]。也有研究者将利托那韦添加到LPV/r(4 ∶ 1)中以达到1 ∶ 1的比例,来克服HIV/TB合并感染患儿因联合使用利福平而导致的洛匹那韦浓度降低,然而这种调整可导致患儿丙氨酸转氨酶(ALT)/天冬氨酸转氨酶(AST)的升高及胃肠道功能絮乱;若必须使用,应在使用利福平后逐渐增加LPV/r的剂量[21]。由于利福布汀诱导CYP3A4酶的强度相对于利福平更小,与LPV/r联用可增加利福布汀的暴露量,故推荐利福布汀的剂量为150 mg,以每周3次、间隔相同天数的方式给药,同时应加强监测不良反应(如中心粒细胞减少症[22]、葡萄膜炎[23])。有研究者以HIV/TB合并感染患儿为研究对象,发现治疗多重耐药结核病的药物(如高剂量异烟肼、吡嗪酰胺、乙胺丁醇、乙硫异烟胺、特立齐酮、氟喹诺酮类药物和阿米卡星)对LPV/r的主要药动学参数水平无影响[24]。LPV/r可使贝达喹啉的AUC升高22%、cmax不变,一项单剂量贝达喹啉和多剂量LPV/r的相互作用研究结果显示,贝达喹啉的AUC增加了22%,说明LPV/r可显著增加贝达喹啉的暴露量[25]。
2.3 抗疟疾药物
Rattanapunya S等[26]研究了健康泰国成年人中青蒿琥酯-甲氟喹与LPV/r联用的药动学作用,发现青蒿素的cmax和全身暴露量增加了45%~80%,而双氢青蒿素与青蒿素的代谢率降低了72%;甲氟喹的cmax和系统暴露量减少了19%~37%,洛匹那韦的cmax显著降低了22%,但全身药物的暴露量无显著变化,患者耐受良好,未发生严重不良反应。目前,青蒿素-本芴醇是广泛推荐的治疗无并发症疟疾的药物,与洛匹那韦联用可使本芴醇的暴露量明显增加,但需加强用药安全的监测[27]。该研究对健康泰国成人中LPV/r与奎宁联用的药动学作用的研究结果显示,奎宁的AUC0-48 h、AUC0-∞、cmax分别降低56%、57%和47%,其中利托那韦对葡萄糖醛酸转移酶(UGT)的诱导以及洛匹那韦的蛋白置换可能是降低奎宁血药浓度的关键因素。
2.4 抗肿瘤药物
硼替佐米为CYP3A4酶的代谢底物,与LPV/r联用可造成硼替佐米的代谢障碍,从而导致转氨酶升高等不良反应的增加,这与其用药剂量及累积剂量呈正相关[29]。王延涛等[30]利用因果关系评估方法(Roussel-Uclaf)评价药物与肝脏损伤之间的相关性,分析了LPV/r与硼替佐米联用导致肝脏损伤的临床特点和预后情况,发现两药联用所致的药物性肝脏损伤以肝细胞损伤为主,同时还与ALT和总胆红素(TBIL)的升高及预后有关。利托那韦通过对癌细胞中CYP3A4酶的诱导来抑制多西他赛代谢,从而升高多西他赛的血药浓度,增强对雄激素非依赖性前列腺癌的疗效,提示利托那韦与其他抗肿瘤药物联用有利于治疗耐药性癌症,但会增加不良反应的发生[31]。长春新碱可通过P-gp转运及CYP3A5酶代谢,与LPV/r联用时可能会延迟长春新碱的清除,并诱导晚期耐药癌细胞(KBV20C)的凋亡,也可能引起显著的血液学或胃肠道不良反应(如麻痹性肠梗阻)[31]。与LPV/r联用时,维奈妥拉的血清浓度会增加,从而导致剂量起始和递增阶段出现肿瘤溶解综合征的风险增加;对于已经完成了剂量递增阶段,且每日服用稳定剂量维奈妥拉的患者,联用LPV/r时维奈妥拉的剂量可减少至75%,同时需密切监测患者与维奈妥拉毒性相关的体征[31]。
2.5 抗心绞痛和抗心律失常藥物
地高辛与LPV/r联用时,由于LPV/r对P-gp的抑制作用可导致地高辛的血药浓度显著升高,对于已经服用LPV/r的患者的地高辛血药浓度增加幅度较小,易发生肾功能损伤[32]。由于LPV/r对CYP3A酶的抑制作用,故与如雷诺嗪、决奈达隆、胺碘酮、苄普地尔、利多卡因(全身给药)、奎尼丁联用时,会导致这些药物的血药浓度升高,故联用时需谨慎,并建议对患者的血药浓度进行监测。
2.6 调脂药物
他汀类药物(如洛伐他汀、辛伐他汀、阿托伐他汀)的代谢明显受CYP3A4酶抑制,尤其是利托那韦可导致羟甲基戊二酸单酰辅酶A(HMG-CoA)还原酶的血药浓度升高,从而出现他汀类药物肝毒性和横纹肌溶等不良反应的发生[33-34],因此上述药物在临床上与LPV/r联用时应使用最低有效剂量。有研究表明,LPV/r和利托那韦均不能影响健康志愿者中非诺贝特的药动学水平,故非诺贝特联合LPV/r仍是HIV感染合并高血脂患者进行常规治疗的重要选择[35]。Dai L等[36]研究了LPV/r对北京地区HIV/AIDS初治患者血脂水平的影响,发现与依非韦伦的方案比较,LPV/r方案治疗的患者血脂异常(如高胆固醇血症、高三酰甘油血症或混合性高脂血症)的概率会增加,但低密度脂蛋白胆固醇水平未受明显影响。
2.7 抗凝血药物
利托那韦可诱导CYP1A2、CYP1A4、CYP2C9、CYP2C19酶,导致口服抗凝剂硝苄香豆素过度代谢,使其国际标准化比率(INR)下降,即使增加硝苄香豆素的剂量也不能恢复到联用利托那韦前的抗凝效果[37],因此需避免二者同时使用,必须联用时应密切监测INR。Xu R等[38]采用基于生理的药物动力学模型研究发现,利伐沙班与利托那韦联用时,利伐沙班的AUC会增加2.2倍,因此对于接受LPV/r治疗的患者不推荐使用利伐沙班。利托那韦和氯吡格雷分别是CYP3A4和CYP2C8酶的抑制剂,利托那韦可使氯吡格雷活性代谢产物的AUC0-4 h降低51%,平均血小板抑制率从51%降至31%;但在药物基因组学研究中发现,尽管CYP2C19酶的功能丧失降低了氯吡格雷的功效,但其对快速代谢型患者的功效并未改变[39]。
2.8 镇痛药物
由于LPV/r对CYP3A酶的抑制作用,可使一些镇痛药物的血药浓度升高,从而增加不良反应(如呼吸抑制、镇静)的发生。利托那韦和LPV/r能强烈抑制CYP3A酶介导的羟考酮去甲基化,使羟考酮的AUC显著增加[40]。LPV/r可改变替利定的序贯代谢,从而显著降低替利定对去甲替利定的代谢,导致去甲替利定暴露量增加2.0倍[41]。美沙酮主要经CYP3A4和CYP2B6酶代谢,CYP诱导剂可通过降低血浆中美沙酮的水平来缩短美沙酮作用时间,引起戒断综合征的发生[42-43]。Lozano R等[44]研究发现,联用利托那韦组患者的平均美沙酮剂量比未联用利托那韦组高50%(P<0.000 1),因此LPV/r和美沙酮等阿片类镇痛药物联用时应谨慎,以避免发生戒断综合征。
2.9 抗惊厥药物
从理论上讲,苯妥英、苯巴比妥和卡马西平均为CYP3A4酶的诱导剂,与LPV/r联用可使LPV/r在血浆中的浓度降低。有文献报道,LPV/r与苯妥英联用可通过诱导CYP酶发生双向药物相互作用:苯妥英可通过诱导CYP3A4酶加快洛匹那韦清除,而小剂量的利托那韦对CYP3A4酶的抑制作用不能抵消苯妥英的诱导作用,故洛匹那韦可诱导CYP2C9酶加快苯妥英清除[45]。LPV/r可通过诱导葡萄糖醛酸化而降低健康受试者血浆中拉莫三嗪的浓度,因此拉莫三嗪需使用初始剂量的200%,才能使健康受试者血浆中拉莫三嗪的浓度达到其单用时的血药浓度水平,而拉莫三嗪并未影响LPV/r的药动学水平[46]。有文献报道,LPV/r与丙戊酸的相互作用加剧了患者双向情感的障碍,分析原因为利托那韦介导的丙戊酸葡萄糖醛酸化,可导致丙戊酸浓度降低[47]。
2.10 抗精神病药物
喹硫平是一种新型抗精神病药物。有研究发现,喹硫平与LPV/r联用时,患者可出现昏迷等不良反应,分析原因是利托那韦能增加喹硫平的暴露量;若必须与LPV/r联用时,应降低喹硫平的剂量至当前剂量的1/6,并监测不良反应的发生[48]。有研究发现,短期内给予低剂量的利托那韦,可显著延长曲唑酮的消除半衰期,增加镇静、疲劳和功能障碍等不良反应的发生[49]。
2.11 皮质激素药物
有研究发现,吸入用、注射用或鼻腔内给药制剂氟替卡松丙酸酯、布地奈德、曲安奈德和全身性皮质类固醇(如地塞米松、泼尼松)等与LPV/r联用,可降低患者洛匹那韦的血药浓度,导致皮质激素药物的血药浓度上升、皮质醇的水平下降,患者可出现库欣综合征、肾上腺功能抑制和孤立性心肌炎等不良反应[50]。
2.12 免疫抑制药物
2016年版《欧洲肝病学会丙型肝炎治疗指南》指出:由于蛋白酶抑制剂潜在的药物相互作用,对于肝移植后需要接受免疫抑制治疗的患者,在优选方案中不包含利托那韦等蛋白酶抑制剂[51]。LPV/r的联用,可升高免疫抑制药物(如环孢素、他克莫司、西罗莫司)的血药浓度,但利托那韦对HIV感染的肾移植患者发生排斥反应的概率更高,故需监测免疫抑制药物的血药浓度[52]。
2.13 5型磷酸二酯酶(PDE5)抑制剂
与LPV/r联用,可升高PDE5抑制剂(如阿伐那非、西地那非、他达那非、伐地那非)的血药浓度。例如利托那韦(200 mg,bid)可使他达拉非的AUC增加124%,而不改变cmax,因此患者在使用西地那非或他达拉非联用LPV/r时需谨慎,并加强对低血压、昏厥、视觉变化和勃起时间延长等不良反应的监测[53]。
2.14 中药
一些中药成分如贯叶金丝桃、人参提取物、山萘酚、水飛蓟宾、大蒜素、猫爪草等可影响P-gp和CYP3A4酶的活性,与LPV/r联用可导致LPV/r的病毒学应答丧失,并使病毒对LPV/r或其他蛋白酶抑制药物产生耐药性,而且会导致胃肠道等不良反应的增加[54]。利托那韦可抑制大鼠中雷公藤甲素的清除(AUC增加5倍以上),改变雷公藤内酯醇和(5R)-5-羟基雷公藤内酯在大鼠体内的药动学水平[55]。有研究发现,LPV/r与麦角生物碱联用,可产生急性麦角中毒,造成血管痉挛、局部缺血,甚至截肢等不良反应[56-57]。孙涛等[58]研究发现,唐草片与LPV/r联用时对 HIV 感染者体内洛匹那韦的药动学水平无影响。
2.15 其他药物
LPV/r与非洛地平、硝苯地平、尼卡地平等联用时,可导致这些药物的血药浓度升高,导致急性肾功能不全、低血压和水肿等严重不良反应的发生[59]。阿夫唑嗪与LPV/r联用,可导致其血药浓度升高和毒性增加,引起患者出现低血压症状。文献报道,HIV感染的肺动脉高压患者联用利托那韦和波生坦,波生坦的谷浓度和cmax可升高至1 546.53 ng/mL和3 365.99 ng/mL[60];利托那韦可通过提高葡萄糖苷酸转移酶的活性,使炔雌醇的血浆浓度降低,导致妇女避孕失败,故在与LPV/r联用时推荐使用非激素避孕法[61]。
3 结语
目前,由于药物相互作用所致的药物疗效降低或不良反应增加,已成为临床上不容忽视的问题。本文从药物机制的研究出发,对LPV/r的药物相互作用进行综述,发现LPV/r与CYP酶代谢的药物和转运体介导的药物联用可产生相互作用,并导致以下结果:(1)LPV/r暴露量和CYP3A酶底物暴露量的增加,可造成严重不良反应;(2) LPV/r的疗效丧失并可能引起患者耐药。
但是,由于部分药物相互作用的研究主要为观察研究或个案报道,尚不能明确影响LPV/r作用的联合用药剂量,故LPV/r的药物相互作用机制及其影响还需要更多的研究进行佐证。同时,由于药物相互作用的原理复杂,而国内关于LPV/r的药动学和药效学的报道较少,且在不同种族间的作用会有差异,故相关药物的血药浓度难以预测。因此,在临床用药时医师应综合考虑药物性质及患者情况,掌握LPV/r与其他药物联用时的药物相互作用,为患者的合理用药提供指导,并减少不良反应的发生。
参考文献
[ 1 ] MANGUM EM,GRAHAM KK. Lopinavir-Ritonavir:a new protease inhibitor[J]. Pharmacotherapy,2001,21(11):1352-1363.
[ 2 ] BARRY M,MULCAHY F,MERRY C,et al. Pharmacokinetics and potential interactions amongst antiretroviral agents used to treat patients with HIV infection[J]. Clin Pharmacokinet,1999,36(4):289-304.
[ 3 ] MORANGUINHO I,BORREGO P,GONCALVES F,et al. Genotypic resistance profiles of HIV-2-infected patients from Cape Verde failing first-line antiretroviral therapy[J]. AIDS,2020,34(3):483-486.
[ 4 ] 国家卫生健康委办公厅,国家中医药管理局办公室.关于印发新型冠状病毒肺炎治疗方案(试行第六版)的通知[EB/OL]. (2020-02-18)[2020-02-19]. http://www.nhc.gov.cn/yzygj/s7653p/202002/8334a8326dd94d329df351- d7da8aefc2.shtml.
[ 5 ] MOMATTIN H,AL-ALI AY,AL-TAWFIQ JA. A syste- matic review of therapeutic agents for the treatment of the middle east respiratory syndrome coronavirus (MERS- CoV)[J]. Travel Med Infect Dis,2019. DOI:10.1016/j.tmaid.2019.06.012.
[ 6 ] 王添艳,柳亚敏,王玉敏,等.新型P2Y12受体拮抗剂抗血小板活性的影响因素研究进展[J].中国药房,2019,30(21):3018-3024.
[ 7 ] PASIPANODYA B,KUWENGWA R,PRUST ML,et al.Assessing the adoption of lopinavir/ritonavir oral pellets for HIV-positive children in Zimbabwe[J]. J Int AIDS Soc,2018. DOI:10.1002/jia2.25214.
[ 8 ] SATO T,MISHIMA E,MANO N,et al. Potential drug interactions mediated by renal organic anion transporter OATP4C1[J]. J Pharmacol Exp Ther,2017,362(2):271-277.
[ 9 ] HILL A,KHOO S,BACK D,et al. Should the dose of tenofovir be reduced to 200-250 mg/day,when combined with protease inhibitors?[J]. J Int Aids Soc,2014. DOI:10.7448/IAS.17.4.19583.
[10] MIZUSHIMA D,NGUYEN D,NGUYEN DT,et al. Tenofovir disoproxil fumarate co-administered with lopinavir/ritonavir is strongly associated with tubular damage and chronic kidney disease[J]. J Infect Chemother,2018,24(7):549-554.
[11] GREEN B,CRAUWELS H,KAKUDA TN,et al. Evaluation of concomitant antiretrovirals and CYP2C9/CYP2C19 polymorphisms on the pharmacokinetics of etravirine[J]. Clin Pharmacokinet,2017,56(5):525-536.
[12] MOGALIAN E,STAMM LM,OSINUSI A,et al. Drug- drug interaction studies between hepatitis C virus antivirals sofosbuvir/velpatasvir and boosted and unboosted human immunodeficiency virus antiretroviral regimens in healthy volunteers[J]. Clin Infect Dis,2018,67(6):934- 940.
[13] ADELOYE T,SAHGAL O,PURI A,et al. Amenamevir:studies of potential CYP3A-mediated pharmacokinetic interactions with midazolam,cyclosporine,and ritonavir in healthy volunteers[J]. Clin Pharmacol Drug Dev,2018,7(8):844-859.
[14] GANE E,LAWITZ E,PUGATCH D,et al.Glecaprevir and pibrentasvir in patients with HCV and severe renal impairment[J]. N Engl J Med,2017,377(15):1448-1455.
[15] KOSLOSKI MP,OBEROI R,WANG S,et al. Drug-drug interactions of glecaprevir and pibrentasvir coadministered with human immunodeficiency virus antiretrovirals[J]. J Infect Dis,2020,221(2):223-231.
[16] FENG HP,CARO L,FANDOZZI C,et al. Pharmacokine- tic interactions between the hepatitis C virus inhibitors elbasvir and grazoprevir and HIV protease inhibitors ritonavir,atazanavir,lopinavir,and darunavir in healthy volunteers[J]. Antimicrob Agents Chemother,2019. DOI:10. 1128/AAC.02142-18.
[17] GRANATO MQ,SOUSA IS,ROSA T,et al. Aspartic peptidase of Phialophora verrucosa as target of HIV peptidase inhibitors:blockage of its enzymatic activity and interfe- rence with fungal growth and macrophage interaction[J]. J Enzyme Inhib Med Chem,2020,35(1):629-638.
[18] PRIYANKA P,VARMA DM,IMMADISETTI K,et al. Recognition of possible risk factors for clinically significant drug-drug interactions among Indian people living with HIV receiving highly active antiretroviral therapy and concomitant medications[J]. Int J Risk Saf Med,2017,29(1/2):25-55.
[19] LI TY,LIU W,CHEN K,et al. The influence of combination use of CYP450 inducers on the pharmacokinetics of voriconazole:a systematic review[J]. J Clin Pharm Ther,2017,42(2):135-146.
[20] BOULANGER C,ROLLA V,AL-SHAER MH,et al. Evaluation of super-boosted lopinavir/ritonavir in combination with rifampicin in HIV-1-infected patients with tuberculosis[J]. Int J Antimicrob Agents,2020. DOI:10.1016/j.ijantimicag.2019.10.021.
[21] RABIE H,DENTI P,LEE J,et al. Lopinavir-ritonavir super-boosting in young HIV-infected children on rifampicin-based tuberculosis therapy compared with lopinavir-ritonavir without rifampicin:a pharmacokinetic modelling and clinical study[J]. Lancet HIV,2018. DOI:10. 1016/S2352-3018(18)30293-5.
[22] RAWIZZA HE,DARIN KM,OLADOKUN R,et al. Safety and efficacy of rifabutin among HIV/TB-coinfected children on lopinavir/ritonavir-based ART[J]. J Antimicrob Chemother,2019,74(9):2707-2715.
[23] LIN HC,LU PL,CHANG CH. Uveitis associated with concurrent administration of rifabutin and lopinavir/ritonavir (Kaletra)[J]. Eye:Lond,2007,21(12):1540-1541.
[24] VAN DER LAAN LE,GARCIA-PRATS AJ,SCHAAF HS,et al. Pharmacokinetics and drug-drug interactions of lopinavir-ritonavir administered with first- and second- line antituberculosis drugs in HIV-infected children treated for multidrug-resistant tuberculosis[J]. Antimicrob Agents Chemother,2018.DOI:10.1128/AAC.00420-17.
[25] PANDIE M,WIESNER L,MCILLERON H,et al. Drug- drug interactions between bedaquiline and the antiretrovirals lopinavir/ritonavir and nevirapine in HIV-infected patients with drug-resistant TB[J]. J Antimicrob Chemother,2016,71(4):1037-1040.
[26] RATTANAPUNYA S,CRESSEY TR,RUEANGWEERAYUT R,et al. Pharmacokinetic interactions between artesunate-mefloquine and ritonavir-boosted lopinavir in healthy Thai adults[J]. Malar J,2015.DOI:10.1186/s12936-015-0916-8.
[27] KREDO T,MAUFF K,WORKMAN L,et al.The interaction between artemether-lumefantrine and lopinavir/ritonavir-based antiretroviral therapy in HIV-1 infected patients[J]. BMC Infect Dis,2016. DOI:10.1186/s12879-016- 1345-1.
[28] RATTANAPUNYA S,CRESSEY TR,RUEANGWEERAYUT R,et al. Pharmacokinetic interactions between quinine and lopinavir/ritonavir in healthy Thai adults[J]. Am J Trop Med Hyg,2015,93(6):1383-1390.
[29] 王雪,董迪,甄健存.硼替佐米所致62例不良反應文献分析[J].中国医院药学杂志,2017,37(24):2467-2470.
[30] 王延涛,夏玉朝,余孝东,等.洛匹那韦-利托那韦与硼替佐米合用导致肝损伤的回顾性研究[J].中南药学,2019,17(11):1958-1962.
[31] FREISE KJ,HU B,SALEM AH. Impact of ritonavir dose and schedule on CYP3A inhibition and venetoclax clinical pharmacokinetics[J]. Eur J Clin Pharmacol,2018,74(4):413-421.
[32] YOGANATHAN K,ROBERTS B,HEATLEY MK.Life- threatening digoxin toxicity due to drug-drug interactions in an HIV-positive man[J]. Int J Std Aids,2017,28(3):297-301.
[33] BEDNASZ C,LUQUE AE,ZINGMAN BS,et al. Lipid- lowering therapy in HIV-infected patients:relationship with antiretroviral agents and impact of substance-related disorders[J]. Curr Vasc Pharmacol,2016,14(3):280- 287.
[47] SHEEHAN NL,BROUILLETTE MJ,DELISLE MS,et al.Possible interaction between lopinavir/ritonavir and valproic acid exacerbates bipolar disorder[J]. Ann Pharmacother,2006,40(1):147-150.
[48] SAMPSON MR,CAO KY,GISH PL,et al.Dosing recommendations for quetiapine when coadministered with HIV protease inhibitors[J]. J Clin Pharmacol,2019,59(4):500-509.
[49] GREENBLATT DJ,VON MOLTKE LL,HARMATZ JS,et al. Short-term exposure to low-dose ritonavir impairs clearance and enhances adverse effects of trazodone[J]. J Clin Pharmacol,2003,43(4):414-422.
[50] PEYRO-SAINT-PAUL L,BESNIER P,DEMESSINE L,et al.Cushings syndrome due to interaction between ritonavir or cobicistat and corticosteroids:a case-control study in the French Pharmacovigilance Database[J]. J Antimicrob Chemother,2019,74(1):3291-3294.
[51] 张影,张福奎.《2016年欧洲肝病学会丙型肝炎治疗指南》推荐意见[J].临床肝胆病杂志,2016,32(12):2248-2257.
[52] ROLLINS B,FAROUK S,DEBOCCARDO G,et al. Higher rates of rejection in HIV-infected kidney transplant recipients on ritonavir-boosted protease inhibitors:3-year follow-up study[J]. Clin Transplant,2019.DOI:10.1111/ctr.13534.
[53] 李航,张刚,王建,等.西地那非联合小剂量他达拉非治疗重度勃起功能障碍的临床观察[J].现代泌尿外科杂志,2020,25(5):428-430.
[54] 杨洋,曾卉,李方园,等.药代动力学过程中的中西药配伍禁忌[J].中药与临床,2018,9(5):45-49.
[55] XU Y,ZHANG YF,CHEN XY,et al. CYP3A4 inducer and inhibitor strongly affect the pharmacokinetics of triptolide and its derivative in rats[J]. Acta Pharmacol Sin,2018,39(8):1386-1392.
[56] CIFUENTES MD,BLANCO LS,RAMIREZ FC. Ergo- tism due to simultaneous use of ergot alkaloids and high activity antiretroviral therapy[J]. Rev Med Chil,2016,144(6):807-812.
[57] FERRY FR,DA SG,MOTTA RN,et al. Use of lopinavir/ritonavir associated with ergotamine resulting in foot amputation:brief communication[J]. Rev Inst Med Trop Sao Paulo,2014,56(3):265-266.
[58] 孫涛,王江蓉,陈军,等. HIV感染者中唐草片对洛匹那韦药动学的影响[J].中国现代应用药学,2016,33(9):1119-1123.
[59] BAEZA MT,MERINO E,BOIX V,et al. Nifedipine-lopinavir/ritonavir severe interaction:a case report[J]. AIDS,2007,21(1):119-120.
[60] CHINELLO P,CICALINI S,PICHINI S,et al. Sildenafil and bosentan plasma concentrations in a human immunodeficiency virus- infected patient with pulmonary arterial hypertension treated with ritonavir-boosted protease inhibitor[J]. Infect Dis Rep,2015.DOI:10.4081/idr.2015.5822.
[61] MCDONALD CR,CONROY AL,GAMBLE JL,et al. Estradiol levels are altered in human immunodeficiency virus-infected pregnant women randomized to efavirenz-versus lopinavir/ritonavir-based antiretroviral therapy[J]. Clin Infect Dis,2018,66(3):428-436.
(收稿日期:2020-04-26 修回时间:2020-07-22)
(编辑:罗 瑞)

