鼻渊舒口服液对CRS模型小鼠鼻窦黏膜IFN-γ及免疫检查点B7-H1/PD-1 mRNA表达的影响研究
付译节 李辉 朱天民 朱鑫 李璐 胡守亮


摘 要 目的:探討鼻渊舒口服液对慢性鼻-鼻窦炎(CRS)模型小鼠γ干扰素(IFN-γ)的影响,并基于协同刺激分子B7同源物l(B7-H1)/程序性死亡因子1(PD-1)免疫检测点探讨其可能机制。方法:将雄性C57小鼠随机分为正常组、假手术组、化学药对照组(克拉霉素,103 mg/kg)和鼻渊舒低、中、高剂量组(鼻渊舒口服液,3.1、6.2、12.4 mL/kg),每组20只。除正常组不作任何处理外,其余各组小鼠均开放上颌窦,假手术组不填充带菌海绵,模型组和各给药组填充带菌海绵以复制CRS模型。自造模后第8周开始,正常组、假手术组和模型组小鼠均灌胃生理盐水0.2 mL,各给药组小鼠灌胃相应药物,每日1次,连续14 d。观察小鼠的鼻部症状和一般情况,采用苏木精-伊红染色法观察小鼠鼻窦黏膜的病理变化;采用实时荧光定量聚合酶链式反应法检测小鼠鼻窦黏膜中IFN-γ、B7-H1、PD-1 mRNA的表达情况。结果:正常组、假手术组小鼠未见鼻部异常,鼻窦黏膜上皮及纤毛完整,两组IFN-γ、B7-H1、PD-1 mRNA的相对表达量比较差异均无统计学意义(P>0.05)。模型组小鼠可见流涕且频繁挠鼻、喷嚏,鼻腔内有少量黄色分泌物,脱毛严重;其鼻窦黏膜严重缺损、纤毛脱落,黏膜下层腺体增生,可见淋巴细胞浸润;鼻窦黏膜中IFN-γ、B7-H1、PD-1 mRNA的相对表达量均较正常组显著升高(P<0.01)。与模型组比较,各给药组小鼠的鼻部症状、一般情况及鼻窦组织病理学变化均有不同程度的改善,化学药对照组和鼻渊舒中、高剂量组小鼠鼻窦黏膜中IFN-γ、B7-H1 mRNA以及各给药组PD-1 mRNA的相对表达量均显著降低,且鼻渊舒中、高剂量上述指标均显著低于低剂量组,而鼻渊舒高剂量组IFN-γ mRNA的相对表达量显著高于中剂量组。鼻渊舒低、高剂量组IFN-γ mRNA,低剂量组B7-H1 mRNA以及各剂量组PD-1 mRNA的相对表达量均显著高于化学药对照组(P<0.05或P<0.01);鼻渊舒中剂量组上述指标水平与化学药对照组相当(P>0.05)。结论:鼻渊舒口服液可改善CRS模型小鼠鼻窦黏膜的慢性炎症,其机制可能与通过抑制IFN-γ mRNA表达从而干预B7-H1/PD-1 mRNA过度表达有关。
关键词 鼻渊舒口服液;慢性鼻-鼻窦炎;γ干扰素;协同刺激分子B7同源物l;程序性死亡因子1;免疫检查点;小鼠;机制
ABSTRACT OBJECTIVE: To investigate the effects of Biyuanshu (BYS) oral solution on IFN-γ of chronic rhinosinusitis (CRS) model mice, and to investigate its potential mechanism on the basis of B7-H1/PD-1 immune checkpoint. METHODS: Male C57 mice were randomly divided into normal group, sham operation group, chemical medicine control group (clarithromycin, 103 mg/kg), BYS low-dose, medium-dose and high-dose groups (BYS oral solution, 3.1, 6.2, 12.4 mL/kg), with 20 mice in each group. Except for normal group without any treatment, other mice were all open maxillary sinus, sham operation group was not filled with sponge with bacteria, while model group and administration groups were filled with sponge with bacteria to induce CRS model. Since 8th week after modeling, normal group, sham operation group and model group were given normal saline 0.2 mL intragastrically, administration groups were given relevant medicine intragastrically, once a day, for consecutive 14 d. The nasal symptoms and general condition of mice were observed, and the pathological changes of mices nasal sinus mucosa were observed by HE staining; qRT-PCR was used to measure the mRNA expression of IFN-γ, B7-H1 and PD-1 in nasal sinus mucosa of mice. RESULTS: The normal group and sham operation group had no abnormal in nose, and the epithelium and cilia of the nasal sinus mucosa were intact; there was no significant difference in the relative mRNA expression of IFN-γ, B7-H1 and PD-1 between 2 groups (P>0.05). In model group, the mice were found to have runny nose, frequent scratching and sneezing, a small amount of yellow secretion in the nasal cavity, and serious depilation; the nasal sinus mucosa was seriously damaged, cilia was exfoliated, and the gland in the submucosa was hyperplasia, lymphocyte infiltration was also found; the relative mRNA expression of IFN-γ, B7-H1 and PD-1 were significantly increased compared with normal group (P<0.01). Compared with model group, the nasal symptoms, general condition and pathological changes of the nasal sinuses in each administration group were improved in varying degrees; the relative mRNA expression of IFN-γ and B7-H1 in chemical medicine control group, BYS medium-dose and high-dose groups, as well as the relative mRNA expression of PD-1 in administration groups were decreased significantly; above indexes of BYS medium-dose and high-dose groups were significantly lower than BYS low-dose group, while relative mRNA expression of IFN-γ in BYS high-dose group were significantly higher than BYS medium-dose group. The relative mRNA expression of IFN-γ in BYS low-dose and medium-dose groups, the relative mRNA expression of B7-H1 in BYS low-dose group, the relative mRNA expression of PD-1 in BYS groups were significantly higher than chemical medicine control group; mRNA expression of IFN-γ in BYS high-dose group was significantly higher than chemical medicine control group (P<0.05 or P<0.01). Above indexes of BYS medium-dose group were similar to those of chemical medicine control group (P>0.05). CONCLUSIONS: BYS oral solution can improve chronic inflammation in nasal sinus mucosa of mice, the mechanism of which may be associated with intervening mRNA overexpression of B7-H1/PD-1 by inhibiting mRNA expression of IFN-γ.
KEYWORDS Biyuanshu oral solution; Chronic rhinosinusitis; IFN-γ; B7-H1; PD-1; Immune checkpoint; Mice; Mechanism
慢性鼻-鼻窦炎(Chronic rhinosinusitis,CRS)是由环境因素、微生物感染、变态反应等多因素所导致的鼻腔和鼻窦黏膜慢性持续性炎症。目前,CRS的治疗措施虽有较大改进,但复发率仍较高,严重影响了患者的生活质量[1]。因此,研究CRS发病机制和相关药物作用机制成为鼻科领域的热点方向之一[1]。临床研究显示,鼻渊舒口服液治疗CRS的效果较好,但相关机制尚不完全清楚[2-3]。有研究发现,Th1细胞因子γ干扰素(IFN-γ)参与了CRS鼻-鼻窦黏膜炎症细胞活化及炎症损伤过程[4-6],且该因子参与调控的协同刺激分子B7同源物l(B7-H1)是机体防止免疫应答过度致炎症损伤扩大的免疫检查点的关键分子[7]。程序性死亡因子1(PD-1)是B7-H1的受体,两者结合后可进一步抑制活化的T淋巴细胞,延迟T细胞免疫应答,在CRS的发生过程中有重要作用[8]。基于此,本研究从IFN-γ及其调控的B7-H1/PD-1免疫检查点出发,初步探讨了鼻渊舒口服液对CRS模型小鼠上述因子mRNA表达的影响,为该药治疗CRS的免疫调节机制及其临床应用提供实验依据。
1 材料
1.1 仪器
BA310型病理显微图像分析系统[麦克奥迪(厦门)医疗诊断系统有限公司];NanoDrop ND-2000型超微量分光光度计、Micro 17R型冷冻离心机(美国Thermo Fisher Scientific公司);FTC 3000型实时荧光定量聚合酶链式反应(PCR)仪(加拿大Funglyn Biotech公司);RM2265型切片机(德国Leica公司);SAESHIN 207A-107型牙科打磨机(东莞耐信五金有限公司)。
1.2 药品与试剂
鼻渊舒口服液(成都泰合健康科技集团股份有限公司华神制药厂,批号:20121010,规格:每支装10 mL);克拉霉素片[阳性对照,重庆科瑞制药(集团)有限公司,批号:562002,规格:0.125 g];水合氯醛(成都科龙化工试剂厂,批号:20120611);TRIzol试剂(美国Thermo Fisher Scientific公司,批号:15596026);实时荧光定量PCR试剂盒(含TB GreenPremix Ex TaqⅡ等试剂,日本Takara公司,批号:RR086B);PCR扩增引物由生工生物工程(上海)股份有限公司设计、合成(序列见表1);苏木精-伊红(HE)染色试剂盒(上海碧云天生物技术有限公司,批号:C0105);氯化钠注射液(四川科伦药业股份有限公司,批号:H12111906,规格:500 mL ∶ 4.5 g,作生理盐水用);绵羊血清(郑州九龙生物制品有限公司);Luria Broth液体培养基(青岛高科园海博生物技术有限公司);其余试剂均为分析纯或实验室常用规格,水为蒸馏水。
1.3 动物
SPF级雄性C57小鼠140只,6~8周龄,体质量18~22 g,由四川大学实验动物中心提供,生产许可证号:SCXK(川)2018-026。所有小鼠均饲养于成都中医药大学SPF级实验动物研究室内。本研究动物实验方案遵循《关于善待实验动物的指导性意见》的相关要求[9]。
1.4 细菌
肺炎链球菌(ATCC 49619)由上海川翔生物科技有限公司提供。
2 方法
2.1 分组、造模与给药
所有小鼠适应性喂养1周后,按随机数字表法分为7组,即正常组、假手术组、模型组、化学药对照组和鼻渊舒低、中、高剂量组,每组20只。除正常组外,其余各组小鼠均参考文献方法[10]开放上颌窦:腹腔注射10%水合氯醛溶液麻醉并消毒后,于小鼠鼻背正中处作长约3 mm的横行切口,钝性分离皮下组织,暴露鼻背上颌窦腔骨质,在左右两侧用打磨机各打磨1个直径约1 mm的小孔。模型组和各给药组于此窦腔植入含肺炎链球菌菌液的医用膨胀海绵(将大小约1 mm3的海绵置于6×108 CFU/mL菌液中浸泡至饱和,菌液由含10%绵羊血清的Luria Broth液体培养基配制)后,常规缝合;假手术组不填充带菌海绵;正常组小鼠不作任何处理。
自造模后第8周開始,正常组、假手术组和模型组小鼠均灌胃生理盐水0.2 mL,化学药对照组小鼠灌胃克拉霉素103 mg/kg(以生理盐水为溶剂,剂量设置参考已有文献[11]并进行换算[12]而得),鼻渊舒低、中、高剂量组小鼠均灌胃鼻渊舒口服液3.1、6.2、12.4 mL/kg(剂量设置参考已有文献[3]并进行换算[12]而得),每日1次,连续14 d。
2.2 小鼠鼻部症状和一般情况观察
每日观察各组小鼠喷嚏、挠鼻、鼻腔分泌物等鼻部症状和皮毛、活跃状态等一般情况。
2.3 小鼠鼻窦黏膜病理学观察
末次给药后,将各组小鼠麻醉、处死,取鼻窦黏膜组织适量,于10%中性甲醛溶液中固定24 h后,常规脱水、透明、包埋、切片(厚度约5 μm),行HE染色,置于病理显微图像分析系统下观察鼻窦黏膜上皮细胞排列及淋巴细胞等炎症细胞浸润等情况。
2.4 小鼠鼻窦黏膜中IFN-γ、B7-H1、PD-1 mRNA表达情况检测
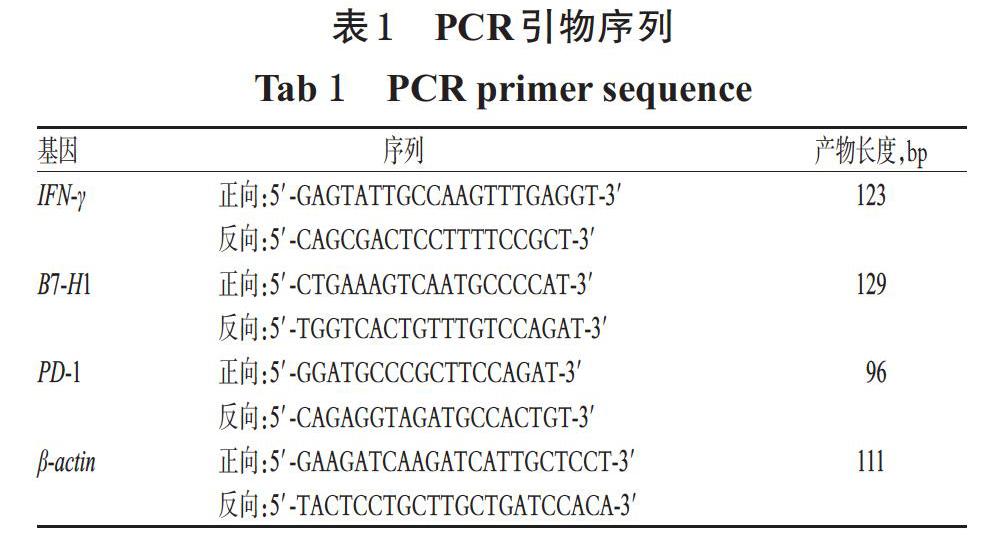
另取“2.3”项下各组小鼠鼻窦黏膜组织适量,用TRIzol试剂提取总RNA,经1%琼脂糖凝胶电泳鉴定RNA完整性、超微量分光光度计测定RNA浓度后,以总RNA为模板反转录为cDNA,再参考实时荧光定量PCR试剂盒说明书进行PCR扩增。反应体系(共25 μL): cDNA模板2 μL,TB GreenPremix Ex TaqⅡ 12.5 μL,10 μmol/L正/反向引物各1 μL,灭菌水8.5 μL。反应条件:94 ℃预变性120 s;94 ℃变性20 s,56 ℃退火20 s,60 ℃延伸30 s,共45个循环。以β-肌动蛋白(β-actin)为内参,采用2-ΔΔCt法以FTC-3000 v4.0软件计算各目标基因mRNA的相对表达量。上述试验重复3次。
2.5 统计学方法
采用SPSS 22.0软件对数据进行统计分析。计量资料以x±s表示,组间比较采用单因素方差分析。P<0.05为差异有统计学意义。
3 结果
3.1 小鼠鼻部症状和一般情况
造模前各组小鼠鼻部未见异常,皮毛光滑,精神状态良好。造模8周后(给药前),模型组和各给药组小鼠均可见流涕、频繁挠鼻、喷嚏,鼻腔内有少量黄色分泌物,脱毛严重;正常组和假手术组小鼠均未见鼻部异常,皮毛光滑。经药物干预14 d后,鼻渊舒低、高剂量组小鼠偶尔有喷嚏;鼻渊舒中剂量组和化学药对照组小鼠无喷嚏、挠鼻,鼻腔未见明显分泌物,脱毛处有新生毛发;模型组小鼠上述症状均未见改善。在实验期间,模型组和鼻渊舒低、高剂量组各2只,鼻渊舒中剂量组1只,假手术组、化学药对照组各3只(共计13只小鼠)因手术损伤或肺部感染死亡。
3.2 小鼠鼻窦黏膜病理学变化
正常组和假手术组小鼠鼻窦黏膜上皮及纤毛完整,黏膜下层偶见少量淋巴和杯状细胞。模型组小鼠鼻窦黏膜严重缺损、纤毛脱落,黏膜下层腺体增生,可见淋巴细胞浸润,提示CRS模型复制成功。鼻渊舒低剂量组小鼠鼻窦黏膜病理表现与模型组相似;鼻渊舒高剂量组和化学药对照组小鼠部分鼻窦黏膜有坏死脱落,部分黏膜下层存在淋巴细胞等炎症细胞浸润和腺体增生,但较模型组减轻;鼻渊舒中剂量组小鼠鼻窦黏膜与正常组相似,黏膜及纤毛较完整,黏膜下层淋巴细胞少见,详见图1。
3.3 小鼠鼻窦黏膜中IFN-γ、B7-H1、PD-1 mRNA表达变化
与正常组比较,假手术组小鼠鼻窦黏膜中IFN-γ、B7-H1、PD-1 mRNA的相对表达量差异均无统计学意义(P>0.05);模型组小鼠上述因子mRNA的相对表达量均显著升高(P<0.01)。与模型组比较,化学药对照组和鼻渊舒中、高剂量组小鼠鼻窦黏膜中IFN-γ、B7-H1 mRNA以及各给药组PD-1 mRNA的相对表达量均显著降低;鼻渊舒中、高剂量组IFN-γ、B7-H1、PD-1 mRNA的相对表达量均显著低于低剂量组,鼻渊舒高剂量组IFN-γ mRNA的相对表达量显著高于中剂量组。鼻渊舒低、高剂量组IFN-γ mRNA,低剂量组B7-H1 mRNA和各剂量组PD-1 mRNA的相对表达量均显著高于化学药对照组(P<0.05或P<0.01);鼻渊舒中剂量组上述指标与化学药对照组比较差异均无统计学意义(P>0.05),详见表2。
4 讨论
CRS是由多种因素导致的鼻腔及鼻窦黏膜慢性持续性炎症,患者治疗后的复发率较高[1]。鼻渊舒口服液由辛荑、薄荷、苍耳子、白芷、黄芪、黄芩、栀子等药材组成,具疏风清热、祛湿通窍等功效,且临床研究指出其单用或与其他药物联用均对CRS具有较好的疗效,但具体作用机制尚未阐明[2-3]。目前,在西医治疗方面,克拉霉素因其具有与皮质类固醇相似的抑制炎症细胞因子表达的作用,且不会引起免疫抑制,同时还能提高CRS患者的内镜和电子计算机断层扫描(CT)评分,现已成为临床治疗CRS的推荐用药[13-14]。基于此,本研究选用克拉霉素为阳性对照药物,以CRS模型小鼠为对象,初步探讨了鼻渊舒口服液治疗CRS的可能机制。
本研究结果显示,造模前各组小鼠鼻部均未见明显异常,且皮毛光滑、精神状态良好。造模后,小鼠出现流涕、频繁挠鼻、喷嚏等症状;模型组小鼠鼻窦黏膜缺损、纤毛脱落,黏膜下层腺体增生、淋巴细胞浸润,与Jacob A等[10]报道的CRS模型小鼠鼻窦黏膜病理表现一致,提示CRS模型复制成功。经药物干预后,各给药组小鼠上述症状均有不同程度改善;除鼻渊舒低剂量组外,鼻渊舒中、高剂量组和化学药对照组小鼠鼻窦黏膜缺损脱落、黏膜下层淋巴细胞等炎症细胞浸润和腺体增生等慢性炎症表现均有明显改善,提示中、高剂量鼻渊舒口服液和克拉霉素均可改善CRS模型小鼠鼻窦黏膜的慢性炎症,对该症具有一定的治疗作用。
IFN-γ是主要的Th1细胞因子,属Ⅱ型干扰素,除具有抗病毒、抗肿瘤细胞增殖的作用外,还具有广泛的免疫调节作用,可通过干扰与免疫有关的基因转录从而调控免疫应答,同时还能激活淋巴细胞、自然杀伤细胞、中性粒细胞等,促进巨噬细胞发挥吞噬及抗原提呈的作用[4]。既往研究发现,CRS患者鼻窦黏膜中的IFN-γ呈高表达,提示该因子可能参与了CRS发生时鼻窦黏膜炎症细胞活化及炎症损伤的过程[5-6]。本研究结果显示,模型组小鼠鼻窦黏膜中存在淋巴细胞浸润等炎症反应,其鼻窦黏膜中IFN-γ mRNA的相对表达量较正常组显著升高,提示IFN-γ可能参与了CRS模型小鼠鼻竇黏膜中淋巴细胞等慢性炎症细胞的活化。经药物作用后,化学药对照组和鼻渊舒中、高剂量组IFN-γ mRNA的相对表达量均较模型组显著降低;但鼻渊舒高剂量组显著高于中剂量组,低、高剂量组显著高于化学药对照组,提示中、高剂量鼻渊舒口服液可不同程度地抑制小鼠IFN-γ mRNA的表达,且中剂量鼻渊舒口服液的作用与化学药对照组相当。值得注意的是,鼻渊舒口服液在影响小鼠鼻窦黏膜中IFN-γ mRNA表达方面,各剂量的量效关系并不明显,有待后续研究进一步探讨。
有研究发现,为避免免疫应答过度导致炎症反应损伤扩大,机体形成了免疫检查点机制,以控制免疫反应的强度和持续时间、减少过度炎症反应对机体组织造成损伤[7]。B7-H1是协助T淋巴细胞免疫应答的一种协同刺激分子[15-16],其与PD-1构成B7-H1/PD-1免疫检查点,起着调节T淋巴细胞免疫应答的作用[7]。当T细胞活化时,B7-H1与细胞表面的PD-1结合,后者的免疫受体酪氨酸转换基序的Tyr被磷酸化,进一步召集蛋白酪氨酸磷酸酶,从而促使磷脂酰肌醇-3-激酶(PI3K)、脾酪氨酸激酶(Syk)等下游激酶发生去磷酸化,导致蛋白激酶B(PKB)、细胞外调节蛋白激酶(ERK)等通路的活化受到抑制,从而使得T细胞活化及炎症细胞因子分泌受阻,T细胞免疫应答被抑制,最终发挥调节炎症反应和免疫耐受的作用[17-20]。有研究发现,B7-H1/PD-1免疫检查点与慢性炎症的迁延有关:当慢性炎症发生时,效应T淋巴细胞等产生IFN-γ等细胞因子,后者可诱导B7-H1、PD-1等存在于T淋巴细胞及其效应细胞细胞膜上的协同刺激分子表达上调,激活B7-H1/PD-1免疫检查点,使T淋巴细胞免疫应答被抑制、病原不能被彻底清除,最终导致炎症迁延不愈[21-22]。张鲁平等[8]发现,B7-H1、PD-1在CRS患者鼻窦黏膜中表达增加,可能是CRS发生的重要环节。
本研究结果显示,模型组小鼠鼻窦黏膜中B7-H1、PD-1 mRNA的相对表达量均较正常组显著升高,提示CRS发生时,小鼠鼻窦黏膜中可能存在B7-H1/PD-1免疫检查点基因过表达,有抑制T细胞免疫应答、引起炎症迁延的可能。经药物作用后,鼻渊舒中、高剂量组B7-H1 mRNA和鼻渊舒各剂量组PD-1 mRNA的相对表达量均较模型组显著降低,且鼻渊舒中、高剂量组B7-H1、PD-1 mRNA的相对表达量均显著低于低剂量组,提示不同剂量的鼻渊舒口服液均可通过不同程度地抑制小鼠鼻窦黏膜中B7-H1/PD-1 mRNA的过表达来发挥对CRS的改善作用,且中、高剂量的作用更强。
有研究发现,在B7-H1编码基因启动子区存在IFN-γ调节位点[23-24],IFN-γ是诱导B7-H1表达的重要炎症因子,可通过诱导鼻黏膜上皮细胞、树突状细胞、巨噬细胞和基质细胞分泌B7-H1来调节鼻黏膜局部T细胞免疫[25-27]。本研究发现,模型组小鼠IFN-γ、B7-H1 mRNA的相对表达量均显著高于正常组,推测小鼠鼻窦黏膜中B7-H1 mRNA表达的升高可能与IFN-γ诱导有关;同时,在鼻渊舒不同剂量组中,IFN-γ、B7-H1 mRNA的表达均有不同程度的下降,推测鼻渊舒口服液抑制B7-H1/PD-1 mRNA过表达可能与其抑制IFN-γ mRNA表达有关。
综上所述,鼻渊舒口服液可改善CRS模型小鼠鼻窦黏膜的慢性炎症,这种作用可能与通过抑制IFN-γ mRNA表达从而干预B7-H1/PD-1 mRNA过表达有关。本课题组后续将对B7-H1/PD-1免疫检查点的上/下游调控因子和相关通路进行深入研究,拟进一步揭示鼻渊舒口服液治疗CRS的免疫调节机制。
参考文献
[ 1 ] SHI JB,FU QL,ZHANG H,et al. Epidemiology of chro- nic rhinosinusitis:results from a cross-sectional survey in seven Chinese cities[J]. Allergy,2015,70(5):533-539.
[ 2 ] 刘巨波,李献华,张君忠,等.长期小剂量鼻渊舒胶囊治疗慢性鼻-鼻窦炎疗效分析[J].中华中医药学刊,2012,30(4):822-825.
[ 3 ] 李祥东,安立,何跃平,等.鼻渊舒口服液在慢性鼻-鼻窦炎鼻内窥镜术围手术期的临床疗效与安全性探讨[J].现代诊断与治疗,2014,25(14):3137-3138.
[ 4 ] 黄小青,杨春. IFN-γ与乙型肝炎病毒感染相关性的研究进展[J].右江民族医学院学报,2018,40(6):603-606.
[ 5 ] 白银,奥彦云,徐丛,等.慢性鼻-鼻窦炎临床表型及炎性特征的初步分析[J].临床耳鼻咽喉头颈外科杂志,2017,31(2):107-110.
[ 6 ] 刘庆华,李瑞玉.慢性鼻窦炎中的鼻腔分泌物IFN-γ、IL-5和IL-17的表达及意义[J].临床合理用药杂志,2016,9(34):133-134.
[ 7 ] BOUSSIOTIS VA. Molecular and biochemical aspects of the PD-1 checkpoint pathway[J]. N Engl J Med,2016,375(18):1767-1778.
[ 8 ] 張鲁平,郑春泉.共刺激分子B7-H1及其受体PD-1在慢性鼻-鼻窦炎鼻窦黏膜中的表达[J].中华医学杂志,2010,90(6):390-393.
[ 9 ] 科学技术部.关于发布《关于善待实验动物的指导性意见》的通知[Z]. 2006-09-30.
[10] JACOB A,FADDIS BT,CHOLE RA. Chronic bacterial rhinosinusitis:description of a mouse model[J]. Arch Otolaryngol Head Neck Surg,2001,127(6):657-664.
[11] 李震,张瑞桐,苏光春,等.克拉霉素强化治疗用于慢性鼻窦炎患者的临床观察[J].中国药房,2017,28(30):4212- 4215.
[12] 章元沛.药理学实验[M]. 2版.北京:人民卫生出版社,1995:238-240.
[13] FOKKENS WJ,LUND VJ,MULLOL J,et al. European position paper on rhinosinusitis and nasal polyps[J]. Rhinol Suppl,2012,45(20):1-136.
[14] ZENG M,LONG XB,CUI YH,et al. Comparison of efficacy of mometasone furoate versus clarithromycin in the treatment of chronic rhinosinusitis without nasal polyps in Chinese adults[J]. Am J Rhinol Allergy,2011,25(6) :e203-e207.
[15] KANG S,ZHANG C,OHNO T,et al. Unique B7-H1 expression on masticatory mucosae in the oral cavity and trans:coinhibition by B7-H1-expressing keratinocytes re- gulating CD4+ T cell-mediated mucosal tissue inflammation[J]. Mucosal Immunol,2017,10(3):650-660.
[16] WEISBERG SP,CARPENTER DJ,CHAIT M,et al. Tissue-resident memory T cells mediate immune homeostasis in the human pancreas through the PD-1/PD-L1 pathway[J]. Cell Rep,2019,29(12):3916-3932.
[17] YOKOSUKA T,TAKAMATSU M,KOBAYASHI-IMANISHI W,et al. Programmed cell death 1 forms negative costimulatory microclusters that directly inhibit T cell receptor signaling by recruiting phosphatase SHP2[J]. J Exp Med,2012,209(6):1201-1217.
[18] PATSOUKIS N,BROWN J,PETKOVA V,et al. Selective effects of PD-1 on Akt and Ras pathways regulate molecular components of the cell cycle and inhibit T cell prolife- ration[J]. Sci Signal,2012. DOI:10.1126/scisignal.2002796.
[19] PAVELKO KD,BELL MP,HARRINGTON SM,et al. B7-H1 influences the accumulation of virus-specific tissue resident memory T cells in the central nervous system[J]. Front Immunol,2017. DOI:10.3389/fimmu. 2017. 01532.
[20] JUN W,RUIRONG Y,WENRU S,et al. PD-1,PD-L1 (B7-H1) and tumor-site immune modulation therapy:the historical perspective[J]. J Hematol Oncol,2017. DOI:10. 1186/s13045-017-0403-5.
[21] OTT PA,HODI FS. The B7-H1/PD-1 pathway in cancers associated with infections and inflammation:opportunities for therapeutic intervention[J]. Chin Clin Oncol,2013. DOI:10.3978/j.issn.2304-3865.2012.11.05.
[22] 昭日格图,张梅华,贺艳霞,等.口腔扁平苔藓外周血T细胞B7-H1/PD-1信號的表达及其作用[J].中国临床研究,2017,30(11):1479-1480.
[23] KALMARZI RN,FAKHIMI R,MANOUCHEHRI F, et al. The relationship between B7 homologous 1 with interleukin-4,interleukin-17 and interferon gamma in patients with allergic rhinitis[J]. Expert Rev Clin Immunol,2019,15(8):897-901.
[24] LI N,WANG J,ZHANG N,et al. Cross-talk between TNF-α and IFN-γ signaling in induction of B7-H1 expression in hepatocellular carcinoma cells[J]. Cancer Immunol Immunother,2018,67(2):271-283.
[25] QIAN J,WANG C,WANG B,et al. The IFN-γ/PD-L1 axis between T cells and tumor microenvironment:hints for glioma anti-PD-1/PD-L1 therapy[J]. J Neuroinflammation,2018. DOI:10.1186/s12974-018-1330-2.
[26] LUCAS ED,FINLON JM,BURCHILL MA,et al. Type 1 IFN and PD-L1 coordinate lymphatic endothelial cell expansion and contraction during an inflammatory immune response[J]. J Immunol,2018,201(6):1735-1747.
[27] CHEN L,FLIES DB. Molecular mechanisms of T cell co- stimulation and co-inhibition[J]. Nat Rev Immunol,2013,13(4):227-242.
(收稿日期:2020-02-05 修回日期:2020-06-05)
(编辑:张元媛)

