冠心病患者血清SAA、NO水平与心功能指标及临床预后的相关性分析
韩 娜,陈 礴,候海文
(青海省心脑血管病专科医院冠心病一科,青海西宁 810000)
冠心病是心血管系统的一种常见疾病,我国现有约2.9亿心血管疾病患者,其中冠心病患者有1 100万,每年因心血管疾病死亡的人数居各种疾病的首位[1],严重影响中老年人群的生活质量和身体健康。冠心病作为一种冠状动脉缺血性疾病,由1支或多支冠状动脉功能性痉挛或固定性狭窄引起,进而出现心肌缺血坏死,甚至引发心肌梗死、心绞痛及猝死等[2-3]。临床上认为冠心病的危险因素包括年龄、吸烟、高血压、糖尿病、高血脂和遗传等。血脂异常引发的炎性反应及血管内皮细胞损伤在冠心病的发生、发展过程中发挥着重要作用[4]。血清淀粉样蛋白A(SAA)作为一种敏感的急性时相反应蛋白,可诱导炎症细胞的聚集、黏附、浸润等过程[5]。一氧化氮(NO)是一种由血管内皮细胞合成的内皮源性舒张因子,可有效降低氧自由基的生成[6]。然而目前关于冠心病患者血清SAA、NO水平与其心功能指标及临床预后的相关研究较少,本研究进行了相关探讨,旨在为冠心病的诊断、治疗及预后评估提供参考。
1 资料与方法
1.1一般资料 选择2016年7月至2017年7月本院心血管内科收治的符合冠心病诊断标准[7],并由冠状动脉造影检查确诊为冠心病的患者98例为冠心病组,其中男58例,女40例;年龄39~75岁,平均(59.1±6.5)岁;心功能Ⅰ~Ⅱ级。另选取同期于本院体检健康者28例为对照组,其中男15例,女13例;年龄32~73岁,平均(54.6±5.2)岁。纳入标准:同意加入本研究,并签署知情同意书者;排除标准:合并严重感染性疾病、恶性肿瘤、中枢神经系统疾病、严重肝肾功能障碍等疾病者。两组患者性别、年龄等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。本研究经本院伦理委员会批准。
1.2方法
1.2.1SAA、NO检测 抽取所有研究对象空腹静脉血8 mL,混匀后静置30 min,以3 000 r/min离心10 min,取上层血清保存待测。采用胶乳增强免疫比浊法检测SAA水平,检测仪器为OTTOMAN全自动特定蛋白即时检测分析仪;采用硝酸还原酶法检测NO水平,试剂盒购自南京聚力生物医学工程研究所(批号:20160510),检测仪器为AU400自动生化分析仪(日本奥林巴斯公司)。
1.2.2心功能检测 采用多普勒彩色超声诊断仪检测两组研究对象入组次日的左心室射血分数(LVEF)水平,探头频率2~4 MHz,检测方法为心尖四腔切面单平面改良Simpson法,获取心脏切面图像后测量心室收缩末期容积和每搏输出量。LVEF=每搏输出量/心室收缩末期容积。
1.2.3观察指标 比较两组SAA、NO及LVEF水平;比较冠心病组不同心功能患者SAA、NO水平;分析冠心病组SAA、NO水平与LVEF水平的相关性;定期对冠心病组患者进行门诊随访,时间为1年,记录急性心肌梗死、心力衰竭、严重心律失常等心血管事件的发生情况及死亡情况,比较不同预后患者SAA、NO及LVEF水平;分析冠心病组SAA、NO水平与预后的相关性。
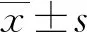
2 结 果
2.1两组SAA、NO及LVEF水平比较 冠心病组SAA水平高于对照组,NO、LVEF水平低于对照组,差异均有统计学意义(P<0.05)。见表1。
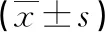
表1 两组SAA、NO及LVEF水平比较
2.2冠心病组不同心功能患者SAA、NO水平比较 冠心病组中LVEF≥50%的患者SAA水平低于LVEF<50%的患者,NO水平高于LVEF<50%的患者,差异均有统计学意义(P<0.05)。见表2。
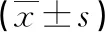
表2 冠心病组不同心功能患者SAA、NO水平比较
2.3冠心病组SAA、NO水平与LVEF水平的相关性 Pearson相关分析结果显示,冠心病组SAA水平与LVEF水平呈负相关(r=-0.417,P<0.05),NO水平与LVEF水平呈正相关(r=0.368,P<0.05)。
2.4冠心病组患者预后分析 冠心病组患者随访1年期间,无失访,发生心血管事件21例(21.43%),死亡9例(9.18%)。
2.5冠心病组不同预后患者SAA、NO及LVEF水平比较 冠心病组发生心血管事件患者SAA水平高于未发生心血管事件患者,NO、LVFE水平低于未发生心血管事件患者,差异均有统计学意义(P<0.05);冠心病组存活患者SAA水平低于死亡患者,NO、LVEF水平高于死亡患者,差异均有统计学意义(P<0.05)。见表3。
2.6冠心病组SAA、NO水平与预后的相关性 Pearson相关分析结果显示,冠心病组患者SAA水平与不良预后(心血管事件和死亡)呈正相关(r=0.528,P<0.05),NO水平与不良预后呈负相关(r=-0.391,P<0.05)。
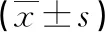
表3 冠心病组不同预后患者SAA、NO及LVEF水平比较
3 讨 论
冠心病是冠状动脉血管由于动脉粥样硬化病变导致血管腔阻塞或狭窄,出现心肌缺氧、缺血、坏死而引发的心脏疾病[8]。冠心病的特点包括病变动脉纤维化,胆固醇及炎症细胞浸润等[9],可影响心脏的正常泵血功能,严重者可引起不良预后[10]。临床上治疗冠心病的方法主要包括药物治疗、经皮冠状动脉介入治疗及冠状动脉旁路移植治疗等[11-12]。目前,冠心病的发病机制及危险因素尚不完全明确,但有研究认为冠心病是一种血管病变及炎性反应相关性疾病[13]。
SAA是由多基因编码的一类多形态蛋白,为急性时相反应蛋白,炎性反应发生5~6 h其水平可迅速升高达原水平的1 000倍[14]。研究发现,在巨噬细胞、单核细胞、血管平滑肌细胞和内皮细胞中均有SAA mRNA的合成和表达[15]。贾文辉等[16]研究发现,大动脉粥样硬化型脑梗死患者SAA水平明显高于健康者,且不稳定斑块组患者SAA水平高于稳定斑块组,表明SAA与动脉粥样硬化及斑块是否稳定密切相关。NO是一种由精氨酸受NO合成酶催化生成的自由基,具有修复血管病变,抗动脉粥样硬化的作用,是机体产生的内源性抗动脉粥样硬化的重要舒张因子,其水平的高低可影响内皮细胞功能[6]。沈云峰等[17]研究发现,冠心病患者血清NO合成酶和NO水平明显低于健康对照组,且多支冠状动脉狭窄患者水平更低,相关性分析显示,NO水平与冠状动脉狭窄程度呈负相关。
本研究结果显示,冠心病患者SAA水平高于健康体检者,NO水平低于健康体检者,且不同心功能的冠心病患者SAA和NO水平存在差异。SAA可诱导内皮细胞产生黏附因子,使血管内膜与巨噬细胞结合,从而参与早期动脉粥样硬化斑块的形成[18];此外,SAA还可与高密度脂蛋白胆固醇(HDL-C)形成SAA/HDL-C复合体,从而降低胆固醇的清除,将胆固醇转运到巨噬细胞内,增加斑块内胆固醇水平,降低斑块硬度,增加斑块不稳定性,参与动脉粥样硬化斑块的形成与发展[19]。内源性正常水平的NO可松弛血管平滑肌,扩张血管,从而调节各器官血流量、血管张力及血压,同时还可松弛心肌组织,使心肌舒张张力下降,降低对冠状动脉的压力,增加冠状动脉血流量;若NO水平降低,则可引起主动脉及冠状动脉血管壁增厚,进而参与冠状动脉粥样硬化的发生[20-21]。本研究LVEF≥50%的冠心病患者SAA水平低于LVEF<50%的患者,NO则相反;相关性分析结果表明,冠心病患者的SAA水平与LVEF水平呈负相关(P<0.05),NO水平与LVEF水平呈正相关(P<0.05)。提示冠心病患者的SAA、NO水平可能与心功能相关,对冠心病患者的SAA和NO水平进行分析有助于评估病情,并为临床治疗提供依据。
本研究发现,与未发生心血管事件的冠心病患者相比,发生心血管事件的冠心病患者SAA水平升高,NO、LVEF水平降低;与存活患者相比,死亡患者SAA水平升高,NO、LVEF水平降低,提示SAA、NO水平可能与冠心病患者的预后相关。相关性分析发现,冠心病患者的SAA水平与不良预后呈正相关(P<0.05),NO水平与不良预后呈负相关(P<0.05),表明冠心病患者SAA、NO水平可提示心血管事件和死亡等不良预后风险,这可能是由于冠心病患者血管内皮细胞损伤,导致各种炎症因子释放, 引起SAA水平升高,NO水平降低,进而影响患者心功能与预后。
综上所述,冠心病患者SAA、NO水平与心功能和预后密切相关,对于评估病情和预后具有较高的价值,有助于指导临床治疗,改善患者预后。

