男性不育症患者精浆外泌体miR-202-5p水平变化及临床意义*
卞玉莹,王 成,顾万建,倪吴花,张春妮△
(1.江苏大学医学院,江苏镇江 212013;2.中国人民解放军东部战区总医院临床检验科,江苏南京210002;3.江苏省中医院检验科,江苏南京 210029;4.温州医科大学附属第一医院生殖医学中心,浙江温州 325000)
男性不育症发病率逐年升高,已成为全球性的健康问题。男性不育症发病机制复杂,可由先天或继发性泌尿生殖系统异常、生殖腺感染、内分泌紊乱、精索静脉曲张、线粒体功能障碍或免疫学等因素引起,其中特发性不育症患者约占40%,其分子机制尚不完全明确[1]。最新研究表明,精浆含有大量外泌体,来源于男性生殖系统多种细胞,由于精浆外泌体微小RNA(miRNA)的水平会伴随外泌体起源细胞的变化而改变,因此其能够更精确地反映生殖器官的病理、生理变化,可作为潜在的生物标志物[2]。有报道显示,微小RNA-202-5p(miR-202-5p)是一种高表达于成年男性睾丸组织中的miRNA[3],在精子发生过程中发挥着重要的生理功能[4]。目前,关于miR-202-5p在男性不育症精浆外泌体中的变化情况未见报道;因此,本研究通过分析miR-202-5p在男性不育症患者精浆外泌体中的水平变化,初步预测了其在男性不育症发生、发展过程中潜在的分子机制,现将结果报道如下。
1 资料与方法
1.1一般资料 选取2015-2019年在解放军东部战区总医院、江苏省中医院及温州医科大学附属第一医院就诊的男性不育症患者107例为研究对象,年龄18~44岁,平均(29.8±6.5)岁。按照WHO诊断标准[5],包括非梗阻性无精症患者53例(精液标本经1 500×g,离心15 min后沉淀,镜检无精子≥2次),弱精症患者54例[精子密度>15×106/mL,a+b级精子<32%,总活力<40%]。所有不育症患者均为婚后夫妻性生活正常,未行避孕措施2年以上而未能生育者。同期募集健康男性53例为对照组,年龄19~53岁,平均(28.4±6.7)岁,精液常规分析各项指标均在正常范围内,均已正常生育。纳入标准:在采样期间均未服用过任何药物者;对本研究知情同意者。排除标准:泌尿、生殖、造血、内分泌系统疾病及其他慢性疾病和接受过放、化疗者。
1.2仪器与试剂 计算机辅助精液分析系统(WLJY-9000精子分析仪,北京伟力公司);B320A型低速离心机(河北白洋离心机厂);BS60型恒温水浴箱(北京市医疗设备厂);XW-80A型漩涡混合器(上海医科大学仪器厂);LightCycler®96实时荧光定量PCR(qRT-PCR)仪(瑞士Roche公司);2720型PCR仪(美国ABI公司);ExoQuick尿液外泌体分离试剂盒(美国SBI公司);磷酸盐缓冲液(美国Thermo Fisher公司);Trizol试剂(美国Life Technologies公司);miR-202-5p PCR引物和TaqMan探针(美国Thermo Fisher公司);反转录体系和qRT-PCR体系所用试剂(AMV反转录酶、dNTP、rTaq酶、buffer及MgCl2)均购自TaKaRa公司。
1.3检测方法
1.3.1标本采集 所有研究对象标本采集前禁欲3~7 d,自慰法取精液于干燥消毒的无菌容器中,置于37 ℃温育30 min,液化后进行精液常规检查。精液在取样2 h内,1 500×g离心10 min去除精子细胞得到精浆,-80 ℃保存。
1.3.2精浆外泌体提取 将精浆标本在4 ℃,3 000×g离心15 min,取100 μL上清液溶于150 μL 磷酸盐缓冲液,根据外泌体提取试剂盒说明书加入63 μL ExoQuick试剂,混匀后离心提取外泌体。
1.3.3精浆外泌体总RNA提取 按本课题组前期建立的方法[6],用Trizol法提取外泌体中的总RNA,每个精浆标本均在提取过程中加入20 μL外源性参照(人工合成源自植物金银花的miR-2911成熟体,序列为5′-GGC CGG GGG ACG GGC UGG GA-3′)用于校正RNA提取效率和误差,提取后的总RNA溶于25 μL不含RNA酶的焦碳酸二乙酯(DEPC)水,保存于-80 ℃待用。
1.3.4qRT-PCR检测 采用基于TaqMan探针的qRT-PCR[7]检测精浆外泌体miR-202-5p水平。反转录PCR反应体系10 μL:DEPC水3.5 μL,5×反转录缓冲液2.0 μL,10 mmol/L dNTP 1.0 μL,AMV 反转录酶 0.5 μL,miR-202-5p反转录引物1.0 μL,RNA标本2.0 μL。反应条件为16 ℃ 30 min,42 ℃ 30 min,85 ℃ 5 min,4 ℃保存,每个反应均为1个循环。qRT-PCR反应体系为20 μL:ddH2O 14.77 μL,10×PCR缓冲液2.0 μL,25 mmol/L MgCl21.2 μL,10 mmol/L dNTP 0.4 μL,rTaq酶0.3 μL,miR-202-5p上、下游引物和TaqMan 探针0.33 μL,cDNA 1.0 μL。反应条件:95 ℃ 5 min,1个循环;95 ℃ 15 s,60 ℃ 1 min,40个循环。数据处理采用相对定量2-ΔCt法,通过仪器配套的LightCycler®96分析软件对检测结果设定统一的阈值,分析获得的Ct值(表示每个PCR管内的荧光信号到达设定阈值时所经历的循环数),其中ΔCt = Ct(miR-202-5p)-Ct(miR-2911)。每个Ct值均为相应标本重复检测3次后所得均值。
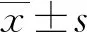
2 结 果
2.1精浆外泌体miR-202-5p水平比较 qRT-PCR结果显示,与对照组miR-202-5p水平[0.027(0.011,0.056)]比较,弱精症患者精浆外泌体miR-202-5p水平[ 0.048(0.023,0.137)]明显增加(P<0.05),无精症患者精浆外泌体miR-202-5p水平[ 0.008(0.004,0.014)]明显降低(P<0.05);无精症患者精浆外泌体miR-202-5p水平较弱精症患者明显降低(P<0.05)。
2.2ROC曲线分析 ROC曲线分析结果显示,精浆外泌体miR-202-5p诊断弱精症的曲线下面积(AUC) 为0.664(95%CI:0.562~0.766),诊断无精症的AUC为0.785(95%CI:0.698~0.872),对弱精症和无精症患者鉴别诊断的AUC为0.878(95%CI:0.816~0.940)。
2.3男性不育症患者精浆外泌体miR-202-5p水平与精液参数的相关性 Spearman相关分析结果显示,弱精症患者精浆外泌体miR-202-5p水平与a+b级前向运动精子比例呈负相关(r=-0.312,P<0.05),与不动精子比例呈正相关(r=0.308,P<0.05),而与精子浓度无相关性(r=0.102,P>0.05)。
2.4Logistic回归分析 Logistic回归分析结果显示,当以对照组为参考变量时,精浆外泌体miR-202-5p是弱精症(OR=2.728,95%CI:1.224~6.080,P<0.05)和无精症(OR=5.417,95%CI:2.148~13.660,P<0.05)发生的危险因素。
2.5miR-202-5p靶基因预测 3种生物信息学分析软件共同预测了128种miR-202-5p潜在的靶基因,见图1。通过Metascape[8]进行靶基因功能注释和富集通路分析,发现miR-202-5p靶基因明显富集于胚胎发育、组蛋白修饰、细胞分化、信号转导等与生殖和精子功能密切相关的蛋白调控通路,见图2。miR-202-5p预测靶蛋白间相互作用网络分析见图3。

注:图中数字为靶基因种类,3种生物信息学软件共同预测了128种靶基因。
图1 miR-202-5p靶基因的生物信息学预测

图2 miR-202-5p富集通路分析
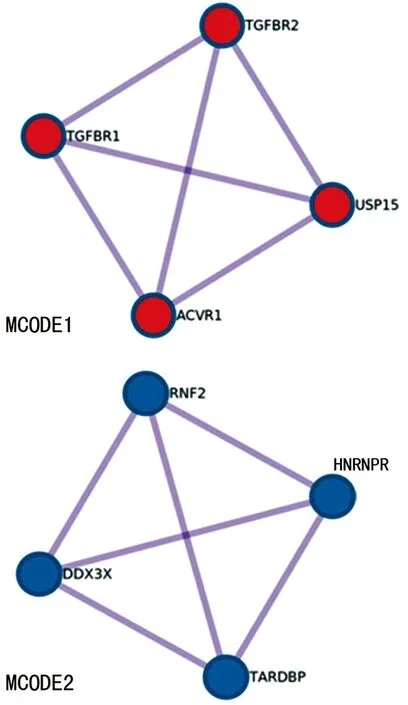
注:MCODE1为蛋白TGFBR2、TGFBR1、USP15、ACVR1相互作用网络;MCODE2为蛋白RNF2、DDX3X、TARDBP、HNRNPR相互作用网络。
图3 miR202-5p预测靶蛋白间相互作用网络
3 讨 论
外泌体可由多种不同类型细胞分泌并稳定存在于几乎人体所有体液中,包括血浆、血清、唾液、母乳、脑脊液、尿液和精液[9],其可被特定靶细胞吸收,从而在细胞间通讯和信息交流过程中发挥重要作用[2]。还有研究发现,外泌体中富含大量miRNA,能保护其不被水解[10]。目前,男性不育症患者精浆外泌体miRNA成为研究的热点。VOJTECH等[2]率先发现精浆外泌体含有大量miRNA,并显示出独特的miRNA表达谱。ABU-HALIMA等[11]研究发现,在弱精症患者精浆外泌体中miR-765和miR-1275的表达水平明显升高,而miR-15a的表达水平明显降低。此外,BARCELO等[12]比较了不同病理类型无精症患者间精浆外泌体miRNA表达谱的差异,发现5种miRNA(miR-182-3p、miR-205-5p、miR-31-5p、miR-539-5p和miR-941)可作为分泌型无精症患者潜在的生物标志物。上述研究均提示,精浆外泌体miRNA表达改变将有助于男性不育症分子标志物的开发及分子机制研究。
本研究发现,男性不育症患者和对照组精浆外泌体miR-202-5p水平存在差异,相较于对照组,弱精症患者精浆外泌体miR-202-5p水平明显增加,而无精症患者精浆外泌体miR-202-5p水平明显降低,提示精浆外泌体miR-202-5p有望成为男性不育症的辅助诊断指标。YANG等[3]通过测序发现,miR-202-5p在成人睾丸中明显富集;DABAJA等[13]研究发现,在睾丸组织中miR-202-5p主要定位于支持细胞,当生殖细胞存在时,miR-202-5p在支持细胞中高表达,这种生殖细胞依赖性表达提示miR-202-5p在支持细胞成熟、精子形成中具有调控功能;此外,QIU等[4]通过荧光原位杂交发现miR-202-5p在精子发生过程中始终存在。本研究推测无精症患者由于精子发生障碍,生殖细胞缺乏,导致精浆外泌体miR-202-5p水平下降;而弱精症患者由于精子功能发生改变,导致凋亡增加,从而使睾丸等生殖组织外泌体分泌增加,这可能是其精浆外泌体miR-202-5p水平升高的潜在机制。本研究ROC 曲线分析结果显示,精浆外泌体miR-202-5p对弱精症和无精症的鉴别诊断价值(AUC=0.878)较高,提示精浆外泌体miR-202-5p有望成为男性不育症的鉴别诊断指标。相关性分析结果显示,弱精症患者精浆外泌体miR-202-5p水平与a+b级前向运动精子比例密切相关,结合Logistic回归分析的结果,精浆外泌体miR-202-5p是弱精症和无精症发生的危险因素,提示其可能参与了精子发生和精子运动。
生物信息学分析结果显示,miR-202-5p的靶基因明显富集于精子功能及生殖等相关的蛋白调控通路,且参与调控细胞的增殖、分化与凋亡。miR-202-5p靶基因相互作用网络的几个关键蛋白(TGFBR2、DDX3X、RNF2、TARDBP)已被报道与不育症密切相关:YUAN等[14]研究发现,在隐睾症大鼠模型中通过激活TGFBR2信号通路诱导精原细胞凋亡,可降低睾丸的生长速度; CHE等[15]研究发现,miR-322的下调通过靶向DDX3X能促进小鼠精母细胞的凋亡;MAEZAWA等[16]研究发现,在精子发生过程中,大量对男性生育能力至关重要的生殖基因包括RNF2被协调激活;VARGHESE等[17]研究发现,TARDBP的异常表达与男性精子生成障碍有关。以上结果均表明精浆外泌体miR-202-5p的部分靶基因与男性生殖细胞形成及精子发生的机制密切相关,而本研究筛选出的未被证实的靶基因还有待进一步研究验证。
4 结 论
综上所述,精浆外泌体miR-202-5p在弱精症患者中高表达,在无精症患者中低表达,并与精子活力有较高相关性,是弱精症和无精症发生的危险因素;此外,miR-202-5p对男性不育症的诊断和鉴别具有一定临床价值。miR-202-5p可能参与了男性生殖的发生、发展,为男性不育症的分子机制研究提供了新的思路和理论依据。

