血清ctDNA、CA72-4及CEA水平与胃癌患者化疗疗效的关系研究*
刘 静,鄂纬建,常 璠,纪荣祖
(1.青海省西宁市第三人民医院检验科,青海西宁 810005;2.青海大学医学院附属医院检验科,青海西宁 810001)
胃癌是消化道最常见的恶性肿瘤,发病率和病死率均占我国恶性肿瘤的第2位[1]。2015年相关数据显示,我国每年胃癌新发病例数为67.9万,死亡病例数为49.8万,分别占全球的42.6%和45.0%[2]。但我国胃癌早期诊治率低于10%,约90%的胃癌患者确诊时已处于进展期,错过了手术治疗的最佳时机,此时手术后5年生存率低于30%[3-4]。化疗通常作为进展期胃癌的主要治疗手段,但目前缺乏预测化疗预后的敏感生物标志物[5]。虽然有研究表明,糖链抗原72-4(CA72-4)和癌胚抗原(CEA)是诊断胃癌灵敏度较高的生物标志物,但关于其对胃癌化疗疗效评价方面的研究较少[5-8]。近年来,有文献报道将循环肿瘤细胞DNA(ctDNA)应用于肿瘤放化疗疗效评价,ctDNA被称为“液态活检”,具有创伤小、可重复等优点[9-10]。本研究探讨了血清ctDNA、CA72-4和CEA水平与胃癌患者化疗疗效的关系及其在化疗疗效判断中的应用价值,现将结果报道如下。
1 资料与方法
1.1一般资料 选取2012年10月至2013年2月在西宁市第三人民医院接受根治性远端胃大部切除术,并进行术后化疗的早期胃癌患者30例作为研究对象。所有患者均经胃镜检查及病理活检确诊为早期胃癌,其中男19例,女11例;年龄35~78岁,平均(53±8)岁;TNM分期:Ⅰ期21例,Ⅱ期9例;肿瘤直径>5 cm者10例,≤5 cm者20例;分化型7例,未分化型23例。纳入标准:卡氏评分>60分;第1次接受化疗;能耐受全身静脉化疗且均能接受2个疗程以上治疗。排除标准:合并严重心、肝、肾等脏器疾病;既往接受过化疗;对化疗药物过敏;合并肿瘤转移;治疗依从性差。本研究经西宁市第三人民医院伦理委员会批准,获得患者及其家属知情同意并签署知情同意书。
1.2化疗方案 所有患者术后第4周给予DCF改良方案化疗。第1天静脉滴注多西他赛(江苏恒瑞医药,批号:171109AF)75 mg/m2;第2天静脉滴注奥沙利铂(南京制药厂有限公司,批号:201711112)130 mg/m2;第1~14天口服替吉奥胶囊(山东新时代药业有限公司,批号:023170308)80 mg/(m2·d),分早晚服用,然后停药7 d再进行第2个疗程。21 d为1个疗程,连续治疗2个疗程。
1.3血清ctDNA、CA72-4和CEA检测 分别于术后化疗前和化疗疗程结束时收集患者清晨空腹静脉血5 mL,3 500 r/min离心10 min,分离得到血清,-20 ℃保存待测。
1.3.1采用RT-PCR检测血清ctDNA水平 量取血清750 μL,加入750 μL磷酸盐缓冲液,混匀,95 ℃孵育10 min,16 000×g 离心10 min,取上清液,-80 ℃保存,备用。将PCR反应液(Super green 1.0 μL,PCR正向引物0.5 μL,PCR反向引物0.5 μL,Master 10.0 μL,H2O 6.0 μL,DNA模板2.0 μL)加入PCR扩增板内,盖上透明膜,轻轻混匀,设置标准品孔和待测品孔。扩增条件:95 ℃ 5 min 1次,95 ℃ 10 s 45次,60 ℃ 20 s 45次,72 ℃ 20 s 45次。扩增结束后,检测 Ct值,以标准品的Ct值做标准曲线,代入待测品Ct值计算得到ctDNA水平。
1.3.2血清CA72-4、CEA水平检测 CA72-4和CEA ELISA试剂盒购自上海晶抗生物工程有限公司,检测过程严格按照说明书进行。设置标准品孔、待测品孔和空白孔,除空白孔外,标准品孔加不同水平的标准品50 μL,待测品孔加待测标本50 μL;标准品孔和待测品孔中分别加入辣根过氧化物酶标记的检测抗体100 μL,封板膜封板后37 ℃孵育60 min;弃去液体,吸水纸吸干后用350 μL洗涤液洗涤5次,吸水纸吸干;每孔加底物A、B各50 μL,37 ℃避光孵育15 min,每孔加终止液50 μL,于450 nm波长下检测各孔吸光度值。以标准品吸光度值和水平做标准曲线,代入待测品吸光度值,即可计算出待测品中CA72-4、CEA水平。阳性结果判断标准:ctDNA>87.12 μg/L为阳性,≤87.12 μg/L为阴性;CA72-4>4.25 μg/L为阳性,≤4.25 μg/L为阴性;CEA>2.41 μg/L为阳性,≤2.41 μg/L为阴性。
1.4疗效评价标准
1.4.1肿瘤标志物疗效评价标准 依据肿瘤标志物疗效评价标准[11],完全缓解(CR):升高的肿瘤标志物水平恢复正常且维持4周以上;部分缓解(PR):升高的肿瘤标志物水平下降≥65%,并维持4周以上;疾病稳定(SD):升高的肿瘤标志物水平下降<65%或肿瘤标志物水平升高<40%;疾病进展(PD):肿瘤标志物水平升高≥40%或从正常水平到超过正常水平,或升高的肿瘤标志物水平未降至正常值10倍以下。
1.4.2客观疗效评价标准 按照RECIST 1.1标准[12]评估患者疗效。CR:所有病灶均消失不见;PR:基线病灶最大径之和减少30%以上;SD:基线病灶最大径之和有减少但未达PR,或有增加但未达PD;PD:基线病灶最大径之和至少增加20%或出现新病灶。经化疗后客观疗效评价,本研究纳入的30例患者中,CR患者10例,PR患者9例,SD患者6例,PD患者5例。
1.4.3有效、无效判断 以上两种评价标准均根据疗效将CR、PR界定为有效,将PD、SD界定为无效。
1.4.4预后评价 化疗结束后对所有患者进行为期5年的随访,以5年生存人数和总生存率作为最终远期预后评价指标。
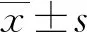
2 结 果
2.1不同客观疗效患者化疗前后ctDNA、CA72-4、CEA水平比较 化疗后CR和PR患者ctDNA、CA72-4和CEA水平与化疗前比较均明显降低(P<0.05);SD和PD患者中,ctDNA水平化疗前后差异无统计学意义(P>0.05),而CA72-4和CEA水平化疗后与化疗前比较均明显升高(P<0.05),见表1。

表1 不同客观疗效患者化疗前后ctDNA、CA72-4、CEA水平比较
2.2肿瘤标志物疗效与客观疗效评价一致性结果 ctDNA、CA72-4、CEA联合检测的疗效评价符合率为93.33%,明显高于各指标单独检测的符合率(P<0.05);且3项指标联合检测的Kappa值为0.71,吻合度较强,一致性较好;ctDNA、CA72-4、CEA单独检测的Kappa值分别为0.37、0.31、0.12,吻合度均较弱,见表2。

表2 肿瘤标志物疗效与客观疗效评价一致性结果

续表2 肿瘤标志物疗效与客观疗效评价一致性结果
注:与ctDNA+CA72-4+CEA比较,*P<0.05。
2.3ctDNA、CA72-4、CEA对胃癌化疗疗效的评估价值及与化疗预后的关系 ROC曲线分析结果显示,以客观疗效评价结果为标准,ctDNA、CA72-4、CEA联合检测评估胃癌化疗疗效的灵敏度为94.74%,特异度为90.91%,曲线下面积(AUC)为0.915,均高于3项指标单独检测,见表3。Kaplan-Meier生存曲线分析结果显示,ctDNA、CA72-4和CEA阴性患者总生存率均明显高于阳性患者(χ2=5.625,P=0.018;χ2=4.073,P=0.044;χ2=4.344,P=0.037),见图1。

注:A为CEA的Kaplan-Meier生存曲线;B为CA72-4的Kaplan-Meier生存曲线;C为ctDNA的Kaplan-Meier生存曲线。
图1 Kaplan-Meier生存曲线
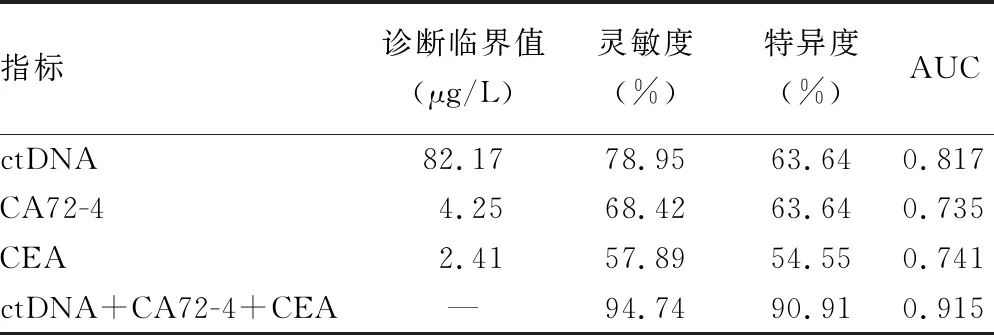
表3 ctDNA、CA72-4、CEA单独及联合检测对胃癌化疗疗效的评估价值
注:—为无数据。
2.4胃癌患者化疗预后的影响因素分析 单因素分析结果显示,肿瘤直径、分化程度、ctDNA、CA72-4和CEA对患者化疗预后有影响(P<0.05),见表4。将对化疗预后有影响的因素纳入多因素Cox回归分析,结果显示,ctDNA、CA72-4和CEA是影响胃癌患者化疗预后的独立因素(P<0.05),见表5。

表4 影响胃癌患者化疗预后的单因素分析

续表4 影响胃癌患者化疗预后的单因素分析
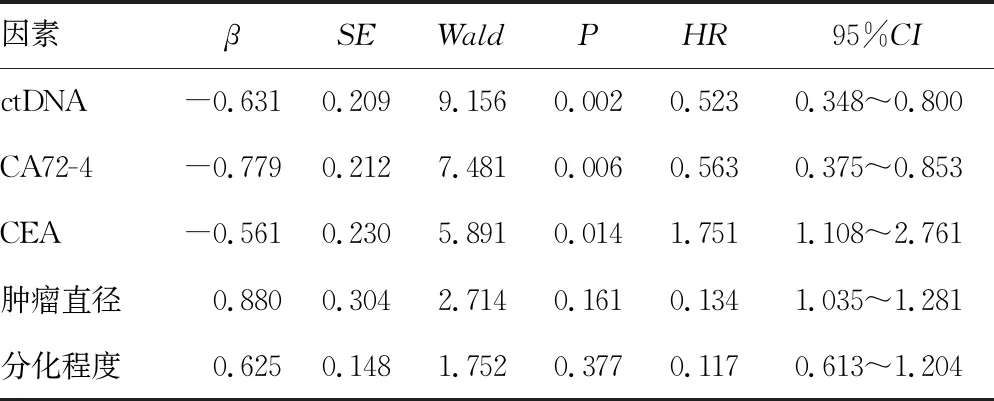
表5 影响胃癌患者化疗预后的多因素Cox回归分析
3 讨 论
肿瘤标志物是可以反映肿瘤生长转移的一类物质。研究显示,肿瘤标志物与肿瘤增殖和肿瘤细胞数量直接相关[7],提示通过检测肿瘤标志物表达水平可以评估肿瘤治疗效果和预后。理想的肿瘤标志物应具有高特异度、高灵敏度、便于检测等特点,然而单一肿瘤标志物特异度、灵敏度低,现在多建议采用多个标志物联合及动态检测[13]。
CEA是一种肿瘤细胞表面抗原,所有内胚层来源肿瘤均可见CEA表达异常,其主要用于消化道肿瘤检测。CA72-4是一种高分子糖蛋白类癌胚抗原,是检测胃癌的首选肿瘤标志物。有研究发现,胃癌患者化疗后CEA、CA72-4水平较化疗前明显降低,同时还发现胃癌患者CEA水平与分化程度呈负相关[14-16]。本研究结果显示,胃癌化疗后客观疗效为CR和PR的患者CEA和CA72-4水平较化疗前明显降低且恢复至正常水平范围内,而客观疗效为SD和PD患者的血清CEA和CA72-4水平较化疗前明显升高,提示CEA、CA72-4可以作为胃癌疗效评价的重要参考指标。本研究进一步分析了CEA和CA72-4评价化疗疗效的价值,将其与客观疗效评价结果进行比较,发现CEA和CA72-4评价结果与客观疗效评价结果的符合率分别为56.67%和66.67%,Kappa值分别为0.12和0.31,提示CEA和CA72-4单独应用评价胃癌化疗疗效价值较低,分析其原因可能与以下因素相关:CEA或CA72-4可以与血液中其他抗原相互结合,导致部分胃癌患者接受化疗后会出现短暂、可恢复的CEA水平升高[17],从而影响结果判断,导致与客观疗效的评价符合率较低,提示CEA和CA72-4水平的升高并不一定存在肿瘤进展或复发转移,可能是这部分患者对化疗的短暂反应。基于此,SORBYE等[18]也建议不应单独依据CEA或CA72-4水平来评价胃癌患者化疗疗效。
循环肿瘤细胞和ctDNA被认为是恶性肿瘤发生转移的重要标志物,对预后判断具有一定的指导意义[19]。有文献报道,ctDNA可以作为监测胃癌进展的生物标志物,是整体生存率及无进展生存率的预测因素之一[20]; 还有文献报道,ctDNA可以用于多种肿瘤包括乳腺癌、结直肠癌、胃癌等的预后和疗效评估[21-22]。本研究发现,胃癌化疗后客观疗效为CR和PR的患者ctDNA水平较化疗前明显降低且恢复至正常水平范围内,客观疗效为SD和PD的患者ctDNA水平较化疗前比较无明显变化,提示ctDNA水平可以作为胃癌化疗疗效评价的指标。进一步对ctDNA评价胃癌化疗疗效与客观疗效结果的一致性进行了分析,结果发现,二者疗效评价符合率为73.33%,吻合度较弱(Kappa值为0.37),分析其原因:肿瘤细胞被机体自然杀伤细胞吞噬而导致血液中残留的ctDNA水平较低;但ctDNA检测结果易受到采血时间、饮食、个体差异等因素影响,导致检测水平波动较大,从而影响对化疗疗效的评价[23-24]。
本研究将ctDNA、CA72-4和CEA 3项指标进行联合检测,结果显示,ctDNA、CA72-4和CEA联合检测评价的胃癌化疗疗效结果与客观疗效结果的符合率为93.33%,吻合度较强(Kappa值为0.71),提示3项指标联合检测在胃癌疗效评价中具有重要价值。
为了进一步评价ctDNA、CA72-4和CEA水平对胃癌化疗疗效的评估价值,本研究进行了ROC曲线分析,结果显示,ctDNA、CA72-4、CEA联合检测对胃癌化疗疗效评估的灵敏度、特异度和AUC均高于3项指标单独检测,提示3项指标联合检测可以有效评估胃癌化疗疗效,指导临床治疗。Kaplan-Meier生存曲线分析结果显示,ctDNA、CA72-4和CEA阴性患者总生存率均明显高于阳性患者,提示上述3项指标可以作为评价胃癌远期预后的重要参考指标。多因素Cox回归分析结果显示,ctDNA、CA72-4和CEA是影响胃癌化疗患者预后的独立因素。此外,由于本研究纳入的病例为早期胃癌患者,并未发现年龄、性别、肿瘤直径、TNM分期和分化程度对胃癌化疗疗效的独立影响。
4 结 论
综上所述,血清ctDNA、CA72-4和CEA联合检测对于早期胃癌化疗的远期疗效预测具有较高准确性,其疗效评价与客观疗效评价结果一致性较好。但是由于本研究纳入的病例数较少,结果的可靠性和科学性还需要后续积累样本量以进一步验证。

