急性缺血性脑卒中患者RDW、UA水平变化及应用价值研究
张 茜,周伟燕,王 萌,赖惠英,童 萍,刘文松,王泉儿,郭 健
(北京医院/国家老年医学中心/中国医学科学院老年医学研究院:1.检验科;2.国家卫生健康委临床检验中心;3.急诊科;4.临床生物样本管理中心,北京 100730)
据统计,急性缺血性脑卒中(AIS)的发病率和患病率分别占所有卒中患者的69.5%和77.8%[1],临床处理原则为早期诊断、早期治疗、早期康复及早期预防复发。AIS可导致神经功能严重损伤,对患者的生活质量产生严重影响;因此,积极探究AIS发病的相关危险因素,并予以早期临床干预和治疗,对改善患者预后,提高患者生存质量具有重要意义。近年来研究发现,外周血红细胞分布宽度(RDW)与AIS的发病率相关[2],同时也发现RDW可用于评估AIS病情的严重程度和预后[3-4]。有研究报道,血清高尿酸(UA)水平是心脑血管疾病发病的危险因素[5]。本研究探讨了RDW、UA水平与AIS发病的关系,以期为AIS的诊断提供科学的参考依据。
1 资料与方法
1.1一般资料 选取2018年7月至2019年10月就诊于本院的AIS患者138例作为病例组。按照TOAST病因学分型标准[6],分为大动脉粥样硬化型(LAA)50例(LAA组),心源性栓塞型(CE)18例(CE组),小动脉闭塞型(SAO)51例(SAO组),以及其他明确病因型(SOE)和不明原因型(SUE)共19例(因SOE和SUE的病例数均较少,因此合并为SOE+SUE组)。纳入标准:(1)符合《中国急性缺血性脑卒中诊治指南2018》中AIS诊断标准[7],并经CT或MRI证实;(2)在发病24 h内入院;(3)年龄≥18岁。排除标准:(1)伴有严重肝、肾功能不全,贫血或传染性疾病;(2)伴有蛛网膜下腔出血或脑出血;(3)临床资料不完整。另选取同期住院的假性卒中患者149例作为对照组。假性卒中为通过病史、神经影像学检查和实验室检查确诊为非卒中疾病造成的神经功能缺陷的一类疾病[8]。对照组包括癫痫10例,多发性硬化14例,晕厥12例,偏头痛12例,眩晕16例,中毒或代谢性疾病17例,脑部肿瘤24例,神经肌肉疾病14例,麻痹12例,分离性障碍3例,硬膜下血肿15例。
1.2方法
1.2.1资料收集 记录所有研究对象的人口统计学数据(年龄、性别)、血管疾病危险因素(高血压、高脂血症、糖尿病、既往卒中史、饮酒史、吸烟史)和入院当日实验室指标[白细胞计数(WBC)、血红蛋白(Hb)、平均红细胞体积(MCV)、平均红细胞血红蛋白含量(MCH)、平均红细胞血红蛋白浓度(MCHC)、RDW、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、肌酸激酶(CK)、UA和肌酐(CRE)]的基线数据。
1.2.2RDW检测 采用Sysmex XN-1000(日本希森美康公司)全自动血液分析仪检测全血标本,血常规检测试剂均为原厂配套试剂。
1.2.3UA检测 采用Roche Cobas c701(瑞士罗氏诊断公司)全自动生化分析仪检测血清标本,UA检测采用尿酸酶法,检测试剂为原厂配套试剂。
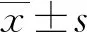
2 结 果
2.1病例组和对照组RDW、UA水平比较 病例组RDW、UA水平均高于对照组,差异有统计学意义(P<0.05)。见表1。

表1 病例组和对照组RDW、UA水平比较[M(P25,P75)]

表2 AIS不同病因学分型患者RDW、UA水平比较[M(P25,P75)]

注:o代表异常值。
图1 AIS不同病因学分型患者RDW水平比较

注:o代表异常值。
图2 AIS不同病因学分型患者UA水平比较
2.2AIS不同病因学分型患者RDW、UA水平比较 LAA组、CE组、SAO组、SOE+SUE组RDW和UA水平比较,差异均无统计学意义(P>0.05)。见表2 、图1~2。
2.3AIS发生的单因素分析 病例组和对照组年龄、性别、高血压、糖尿病、高脂血症、既往卒中史、吸烟史、WBC、CRE水平比较,差异均有统计学意义(P<0.05)。病例组和对照组饮酒史、Hb、MCV、MCH、MCHC、ALT、AST和CK水平比较,差异均无统计学意义(P>0.05)。见表3。
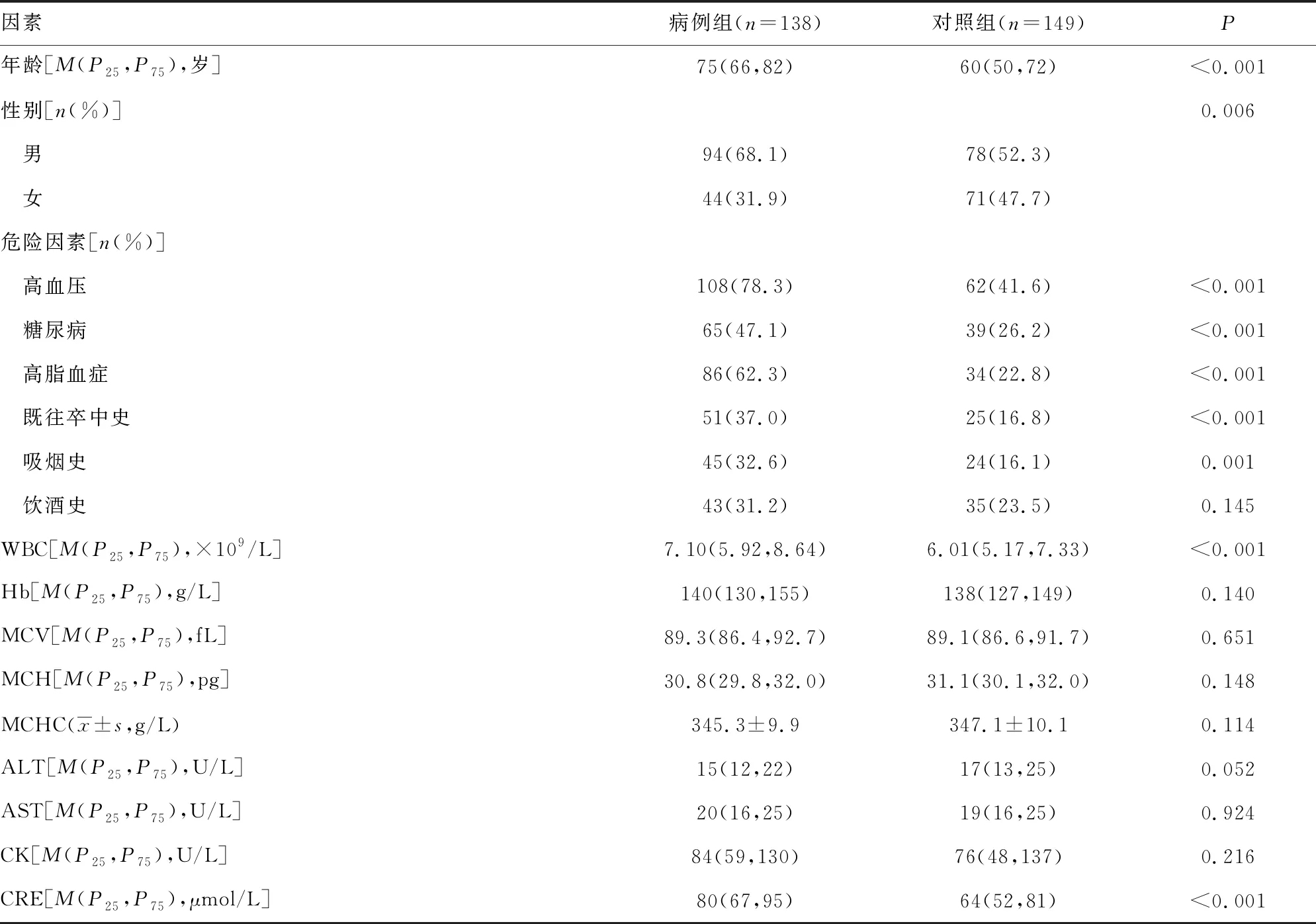
表3 AIS发生的单因素分析
2.4AIS发生的独立危险因素分析 以是否发生AIS为因变量,以单因素分析中差异有统计学意义的指标(性别、年龄、高血压、高脂血症、糖尿病、既往卒中史、吸烟史、WBC、CRE)及RDW和UA为自变量,进行多因素Logistic回归分析。结果显示,RDW、UA、年龄、吸烟史、高脂血症是AIS发生的独立危险因素(P<0.05)。见表4。

表4 AIS发生的独立危险因素分析
3 讨 论
RDW是反映红细胞体积异质性的一项指标,临床上铁、叶酸、维生素B12等缺乏引起贫血时,RDW会出现病理性升高[9]。此外,溶血性贫血、镰状细胞性贫血、骨髓增生异常综合征及输血治疗后也会出现RDW水平的升高[10]。近年来研究表明,RDW与冠心病、心力衰竭、心房颤动、脑卒中等心脑血管疾病的发生及预后密切相关[11]。一项关于RDW与人群AIS发病率关系的研究对26 879例无冠心病或者脑卒中病史的志愿者随访了15.2年,在调整脑卒中危险因素和血液学指标后,与低水平RDW组相比,高水平RDW组发生AIS的风险增加了32%[2]。此外,VAYA等[12]研究发现,与RDW≤14%的患者比较,RDW>14%的患者发生隐源性脑卒中的风险增加了1.5倍。国内王三涛等[13]研究发现,RDW是AIS发生的独立危险因素(OR=9.920, 95%CI=6.286~15.655)。本研究结果显示,RDW是AIS发生的独立危险因素(OR=4.789, 95%CI=2.542~9.024),与上述研究结果类似,进一步证实了RDW可能与AIS的发病有关。同时,本研究还发现AIS不同病因学分型患者RDW水平无明显差异,说明RDW水平不受AIS病因学分型的影响。关于RDW在AIS发病中的可能机制包括:(1)高水平RDW可能与慢性炎症有关,而慢性炎症是心脑血管疾病共同的病理学过程[14],炎症因子的上调会降低促红细胞生成素的合成,抑制骨髓中红细胞的成熟,并导致未成熟红细胞进入血液,引起红细胞大小异质性升高[15];LIPPI等[16]证实了RDW与炎症指标超敏C反应蛋白和红细胞沉降率存在明确的正相关。(2)RDW与AIS发病相关的另一种生物学机制可能为氧化应激,氧化应激导致的脑缺血再灌注损伤在脑卒中的病理过程中起着关键性作用[17];而氧化应激还会引起红细胞膜破坏,增加红细胞脆性,加快红细胞更新,导致RDW水平升高。(3)RDW水平可反映红细胞的凝集状态,当衰老红细胞比例增加时,MCV水平下降,RDW水平增加,衰老红细胞更易黏附于内皮细胞,从而促进血栓形成,而血栓是导致AIS发生的主要原因[18]。但目前RDW与AIS发病的病理生理机制尚未完全明确,仍需进一步研究证实。
UA是体内嘌呤代谢的终产物,主要在肝脏及小肠由黄嘌呤氧化酶代谢产生。目前,大量研究表明高水平UA与心血管疾病的发病风险和预后相关[5]。近年来,UA与AIS的关系已成为研究热点,但目前相关机制尚存在争议[19]。BOS等[20]研究发现,UA最高五分位组人群发生AIS的风险是最低五分位组人群的1.77倍(HR=1.77,95%CI=1.10~2.83)。TU等[21]报道了高水平UA可增加老年患者AIS的发病风险(HR=2.32,95%CI=1.56~3.45)。然而也有研究发现,UA水平与AIS的发生无明显关系[22]。李治鹏等[23]报道了AIS患者的血清UA水平低于健康者。本研究结果表明,病例组UA水平高于对照组(P<0.05),UA是AIS发生的独立危险因素(OR=1.005,95%CI=1.001~1.009)。同时,本研究还发现AIS不同病因学分型患者UA水平无明显差异,说明UA水平不受AIS病因学分型的影响。UA引起AIS发生的机制主要包括:(1)作为一种促氧化剂,高水平UA可促进低密度脂蛋白的氧化,促进氧自由基的生成,加快动脉粥样硬化斑块的形成[24]。(2)UA和一氧化氮(NO)直接反应生成6-氨基尿嘧啶,同时UA能够抑制内皮型一氧化氮合酶磷酸化,减少NO的释放[25];而内皮来源NO的减少可导致内皮功能障碍,易引起血小板的黏附、聚集及血管内膜的增生,考虑这是高UA水平引起心脑血管缺血事件发生的主要原因[26]。(3)高水平UA可促进局部和全身炎性反应,最新证据已表明UA通过NF-κB信号通路诱导全身炎性反应[27]。
本研究还发现年龄、高脂血症及吸烟史也是AIS发生的独立危险因素,考虑可将其与RDW、UA联合,建立疾病预测模型,但目前仍需进一步的研究证实联合诊断的价值。
4 结 论
RDW和UA水平在AIS患者中明显升高,是AIS发生的独立危险因素,且RDW和UA水平不受AIS病因学分型的影响,可用于AIS的诊断及指导临床进行早期预防和治疗。

