N-异丙基丙烯酰胺类纳米水凝胶在生物识别中的研究进展
康玲玲,张禾蓉,王 哲,王家伦,孟子晖,薛 敏
(北京理工大学 化学与化工学院,北京 102488)
0 引 言
纳米水凝胶(Hydrogel nanoparticles, NPs)是一类以水为分散介质,粒径为1~1000 nm的具有内部交联结构的纳米颗粒聚合物,其具有良好的生物相容性,结构可设计性,高保水性和生物可降解性[1]。由于其高分子侧链上一般含有亲水基团和疏水基团,使其可以在水中溶胀而不溶解;其独特的纳米特性,如渗透效应、界面效应、尺寸效应、表面效应、体积效应等[2],使其具有大量的活性位点可以偶联其他的功能组份。智能型纳米水凝胶是一类能够感知外界环境的变化,而产生体积相转变的凝胶体系,根据对外界环境的刺激变化可以分为温敏性[3-4]、pH敏感性[5-6]、磁敏感性[7-9]、光敏感性[10-11]和分子敏感性[12]等智能水凝胶。有的智能水凝胶还可以对多个刺激产生响应,比如温度和pH,这种智能型纳米水凝胶叫做多重刺激响应性纳米水凝胶[13-14]。其中最具代表性的是温敏性纳米水凝胶。
温敏性纳米水凝胶会随着外界温度的改变而产生体积的溶胀或收缩。这种变化是不连续的,在某一临界温度附近,温度发生细小改变,而体积却发生突跃变化,这种现象称为水凝胶的相转变。引起相转变的温度被叫做较低临界溶解温度(LCST)或较高临界溶解温度(UCST)。根据温敏性纳米水凝胶的相转变特点,可以分为正温度敏感纳米水凝胶与负温度敏感纳米水凝胶。前者在环境温度高于UCST时,随温度上升凝胶体积发生溶胀;而后者在环境温度高于LCST时随温度升高发生皱缩。在目前研究的温敏性纳米水凝胶中,尤其是以负温度敏感纳米水凝胶的研究最多,其温度响应性与氢键和疏水基团有关[15]。当溶液温度低于LCST时,凝胶的亲水基团与水分子间形成氢键,高分子链周围的水分子将形成一种由氢键连接的、高度有序化的溶剂壳层,即水合层,使处于水中的凝胶网络在低温下吸水;随着温度的上升氢键被破坏,分子链间的疏水作用加强,使水分子从凝胶网络中排出,凝胶产生相变,从而表现出温敏性。此时高分子由疏松的线团结构转变为紧密的胶粒状结构,发生了coil-globule转变[16]。其中研究最多的是由聚(N-异丙基丙烯酰胺)(PNIPAm)组成的纳米水凝胶,它的LCST在32 ℃左右[17]。PNIPAm纳米水凝胶之所以会出现临界溶解温度(LCST),是因为PNIPAm聚合物中同时存在亲水的酰胺基团和疏水的异丙基,其亲水、疏水相互作用力的平衡导致了聚合物溶液可逆的相分离或沉淀(图1)。若将温敏性单体NIPAm和其他可以提供正/负电荷以及亲水/疏水基团的单体共聚,制备得到的温敏性纳米水凝胶聚合物的LCST就可以通过改变加入的其他单体的种类和比例来调节[18-19]。如Debord等将疏水性单体N-叔丁基丙烯酰胺(tBAm)和电负性单体丙烯酸(AAc)加入到PNIPAm微凝胶体系中,通过调节各个单体之间的配比,使其LCST范围从8~32 ℃可调节[20]。
目前研究的由NIPAm为单体聚合而成纳米水凝胶已获得了广泛应用[21-25]。它在给药系统[26-28],蛋白质分离[29,30],医学诊断[31-32],生物传感器[33-35],生物材料[36-38]等生物医学领域中都显示出了良好的的应用前景。本文重点阐述了NIPAm温敏性纳米水凝胶在蛋白及多肽的识别、药物输送与释放和DNA分离等生物领域的应用研究和发展前景。也讨论了其当前主要存在的一些问题及今后的发展方向。
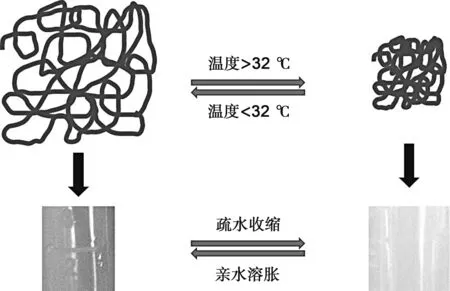
图1 PNIPAm纳米水凝胶coil-to-globule转变示意图Fig 1 Schematic diagram of coil-to-globule transition of PNIPAm hydrogel nanoparticles
1 蛋白识别
蛋白质识别被认为是高分子生物材料与体液或组织之间相互作用的最重要方面。目前蛋白质的识别主要用到的是抗体,利用抗体与抗原的特异性结合作用能高效地识别蛋白。然而抗体造价昂贵,结构不稳定,而且只能使用一次,这些因素对抗体的大规模应用起到了很大的阻碍作用。因此能够通过分子印迹或单体选择结合特定生物大分子的合成聚合物纳米颗粒作为抗体的替代品引起了人们极大的兴趣[39]。Yu Hoshino等[40]以NIPAm等单体在温和条件下采用分子印迹技术合成了蜂毒素印迹的纳米水凝胶颗粒(图2),其对生物毒素蜂毒素具有与天然抗体类似的高亲和力和选择性。之后他们还对该水凝胶进行了生物相容性测试[41],采用体内荧光成像技术观测到这些NPs在血液中捕获蜂毒素后,得到的蜂毒素·NPs复合物被肝脏共同清除出体内,降低了体内蜂毒素的毒性,从而大大提高了小鼠的存活率,这为寻找新的廉价的体内解毒剂提供了思路。
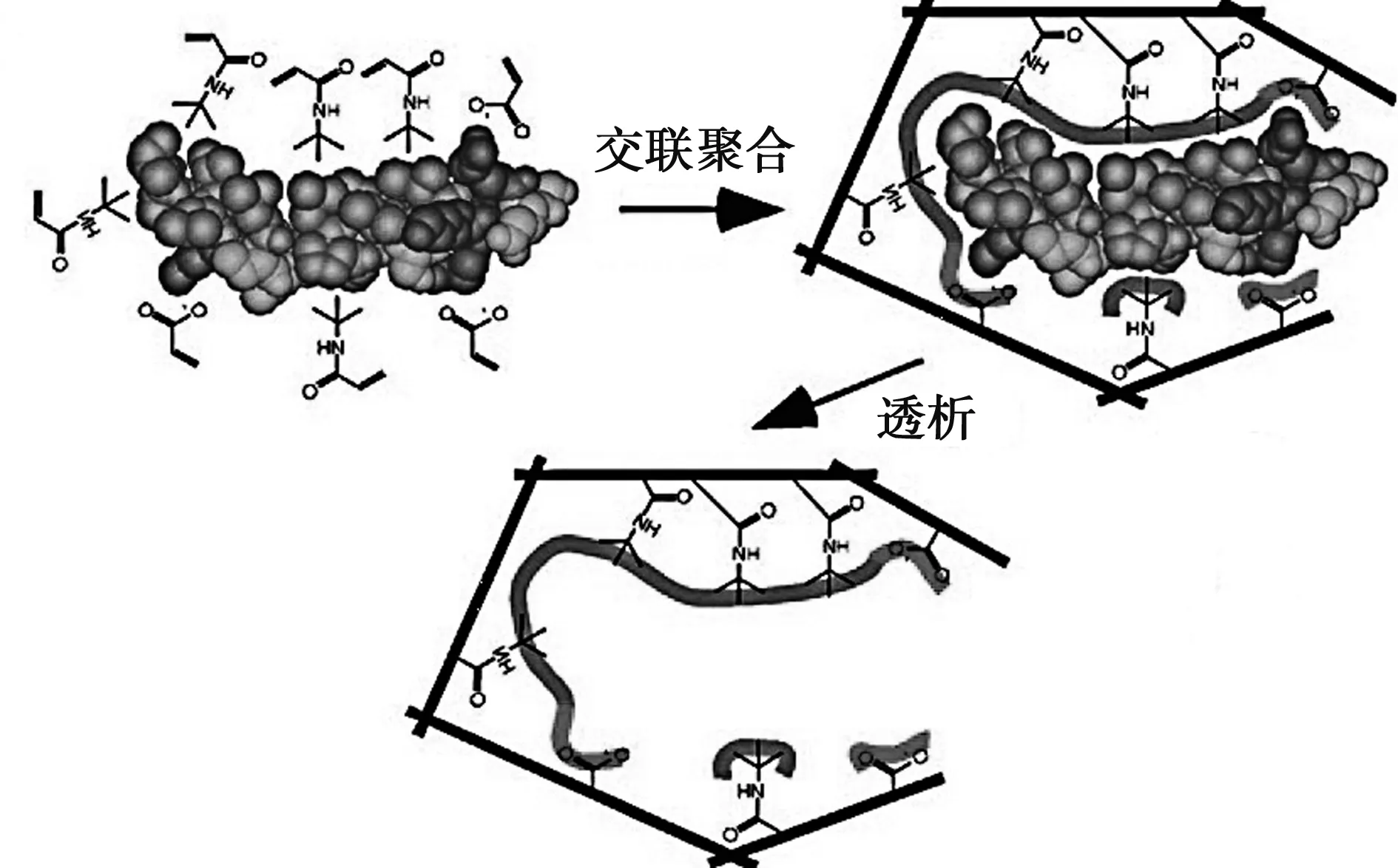
图2 分子印迹聚合物微球和蜂毒素作用示意图[40]Fig 2 Schematic of interaction between molecularly imprinted polymer and melittin [40]
然而其采用的分子印迹技术存在蛋白印迹困难,洗脱难度大,稳定性差等缺点[42- 43]。之后他们[44]以NIPAm作为温敏性结构单体,N-(3-氨基丙基)甲基丙烯酰胺盐酸盐(APM)作为正电性单体,丙烯酸(AAc)作为电负性单体的,N-叔丁基丙烯酰胺(tBAm)作为疏水性单体,丙烯酰胺(AAm)作为亲水单体,N,N’-亚甲基双丙烯酰胺(BIS)作为交联剂,通过沉淀聚合的方法合成了一系列的纳米水凝胶聚合物,且利用该聚合物的温敏性,可以通过改变温度来实现对蛋白质的吸附和解吸。并采用ELISA实验[45]以及亲和纯化[46]等方法筛选出对不同目标蛋白具有高亲和力的水凝胶,还研究了不同功能单体[47-48]、温度[49]和分子量[50]等因素对吸附作用的影响。Lee等[51]用该水凝胶来特异性捕获IgG蛋白,他们发现当单体配比为38%NIPAm,20%AAc,40%tBAm,2%BIS时,NPs对IgG具有最高的亲和力,而且该结合是PH敏感的,可以用作蛋白捕获剂。Koide等[52]通过设计功能单体,制备了一种对血管内皮生长因子VEGF165具有极高亲和力的聚合物纳米水凝胶颗粒,它能够抑制该信号蛋白与其受体(VEGFR-2)的结合,从而防止受体磷酸化,并阻止VEGF165依赖性生长和迁移。此外体内实验证明这些聚合物纳米水凝胶颗粒可以抑制VEGF介导的新血管形成,而且这种无毒的聚合物纳米水凝胶颗粒没有任何的脱靶效应,这为寻找非生物蛋白质亲和试剂提供了新的范例,对医疗研究有重要作用。Wong等[53]通过添加不同的功能单体来调控聚N-异丙基丙烯酰胺微凝胶的表面电荷,疏水性,pKa与吸附能力,并将优化后的微凝胶作为在温和条件下水解酰胺键的催化剂。同时以含有1-乙烯基咪唑功能单体的微凝胶为实例提出了水解酰胺键和确定官能团间理论平均距离的机理,这为功能化水凝胶应用于医疗与生物化学转化的酶模拟过程开创了新视野。Jeffrey等[54]通过选择功能单体合成了一种治疗蛇毒的高分子纳米水凝胶,与由来自毒液免疫的特定哺乳动物血浆中的IgG组成的天然抗蛇毒血清相比,合成的NPs可以隔离眼镜蛇中的主要蛋白质毒素。而且稳定,低成本的NPs可以在被蛇咬伤后立即皮下给药,以停止或减少局部组织的损伤程度,并减轻毒素的全身分布,该NPs可以作为一种广谱的抗蛇毒血清使用,并且不受生物疗法的限制。
本课题组[55]将NIPAm,tBAm,AAc等单体以BIS为交联剂在水中共聚得到一系列粒径分布均一的纳米水凝胶小球,通过优化NPs单体比例,使NPs对溶菌酶的吸附性能最佳,仅5 min即可达到吸附平衡。利用NIPAm的温敏性特征,可实现对溶菌酶的脱附,从而提高了材料的重复利用性。
免疫学研究发现,当抗体识别抗原时,抗体只能与抗原的一部分,即抗原决定基作用,也就是说一个抗原决定基(表位)能代表一个抗原。在目标蛋白的表位上加入重组标签,通过识别重组标签而识别表位从而识别整个蛋白。蛋白质种类繁多,可以通过对重组标签的识别来识别更多的蛋白质。Yoshimatsu等[56]将具有不同序列和长度的生物素化肽标签连接至抗生物素蛋白平台,并筛选对聚合物NPs的亲和力。结果表明,由优化的15个氨基酸残基组成的融合肽标签(tMel-tag)可以提供对非生物聚合物NPs的强亲和力,而且证明带标签的蛋白比没有标签的蛋白对NPs展现出更高的亲和性,可以利用NPs/ tMel-tag相互作用的亲和力和选择性来制备高纯度的重组蛋白。Li等[57]使用组氨酸标记的抗原决定基多肽作为模板制备了具有高模板利用率的表面印迹纳米水凝胶,该水凝胶利用Ni2+与组氨酸之间的金属螯合作用对抗原决定基多肽进行固定与解除,从而对目标蛋白达到很好的特定性识别能力。
针对目标多肽/蛋白表面的作用基团可以设计与之具有互补作用位点的聚合物[58]。通过优化功能单体的种类和比例,可以合成出与目标多肽或蛋白质表面多个位点具有亲和力和选择性的纳米水凝胶颗粒[59]。但目前的研究大多仅仅处于实验室阶段,其应用还有待进一步验证,相信在不远的将来,随着研究的不断深入,纳米水凝胶能够代替天然抗体满足医学临床的需要,突破生物医学领域的局限,发挥其独特的作用。
2 药物输送与释放
药物的输送与可控释放是目前智能纳米水凝胶研究最多的领域。传统给药方式存在生物利用度低、副作用高和给药频繁等问题。而纳米颗粒能进入人体血液循环体系或消化系统,越过生物屏障将药物输送到需要作用的部位[60-62]。纳米水凝胶作为药物输送载体具有生物相容性好、载药量高、保护药物不被破坏、表面可连接具有靶向作用的配体等优点[62-64]。药物负载的常规做法是将药物包埋在水凝胶或由其制成的微胶囊中,包埋药物的释放速度和释放量可以通过凝胶的溶胀程度来实现[65]。图3是利用水凝胶的收缩和溶胀来实现智能型药物释放系统的原理。浸含药物的凝胶粒子在身体正常状态下呈收缩状态,因为形成的致密表面层可以使药物包含在粒子内。当感受到疾病信息后,凝胶体积膨胀,使浸含的药物通过扩散释放出来,当身体恢复到正常时,凝胶又恢复到收缩状态,从而抑制了药物的进一步扩散[66]。
NIPAm温敏性纳米水凝胶具有LCST,它可以通过感知外界温度而对药物的装载与释放进行控制,从而将药物输送到人体作用位点。它的释药模式为:温度低于LCST 时水凝胶在药物溶液中溶胀以吸附药物;当温度高于LCST 时水凝胶收缩而释放药物。Hsiue等[67]利用PNIPAm的温敏性,在室温下将治疗青光眼的药物封装在交联的聚合物网络中,在眼部应用后(较高温度下),药物逐渐释放,而且其降低眼内压的作用是传统滴眼剂的6-8倍。Zhang等[68]在25 ℃下将模型药物5-氟尿嘧啶(5-FU)装入PNIPAm水凝胶中,然后将载药水凝胶装入透析袋中,构建了新型的热敏药物释放系统(DDS,图4)。与常规的负药物释放模式相比,这种新型的正药物释放模式,可以在升高的温度下快速释放药物,在降低温度时缓慢释放药物,该释药模型可以进一步控制药物的释放速率和释放量,Snežana等[69]制备了一种以NIPAm和2-羟丙基甲基丙烯酸(HPMet)为单体的温敏性水凝胶,在模拟生理条件下,通过高效液相色谱法验证了制备的聚(NIPAm-co-HPMet)水凝胶在非那西丁的控释中是一种良好的药物载体。Cheng等[70]通过化学交联法合成了由聚(N-异丙基丙烯酰胺)和羧甲基壳聚糖组成的水凝胶,用作持续长久释放顺铂(CDDP)的药物载体,减少了CDDP的治疗浓度和剂量带来的副作用。Andrei等[71]通过在PNIPAm水溶液中加入亲水的右旋糖酐(DXT),制备了具有改善保水性和药物释放特性的新型可注射温敏水凝胶制剂。为了改善NIPAm体系水凝胶的LCST,使其接近人体温度,更利于体内给药,Hamcerencu等[72]以BIS为交联剂,通过接枝交联反应合成了基于结冷胶马来酸酯(gellan maleate)/N-异丙基丙烯酰胺的热可逆水凝胶,其LCST接近36℃(生理温度),并对其进行了药物(肾上腺素和氯霉素)的体外包含和释放以及体内生物相容性实验,结果都表明该水凝胶可以作为一种可靠的眼用制剂。然而这些热响应性纳米水凝胶只能在温度较高的组织中蓄积,热靶向行为是被动和非特异性的。可以通过热疗和加入其它功能单体来调整纳米水凝胶的LCST来选择目标位置[73],达到靶向治疗的目的。
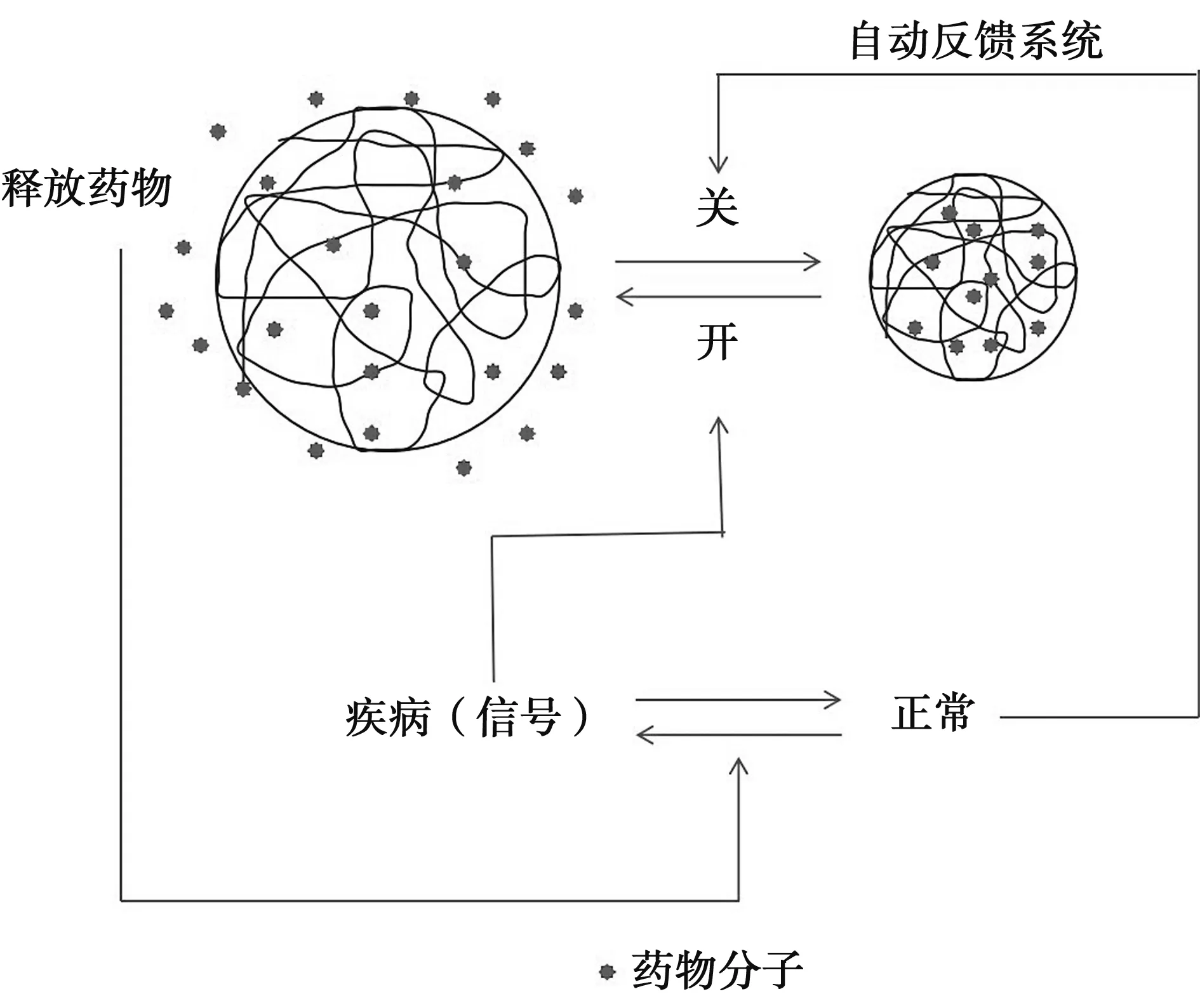
图3 智能型药物释放系统原理Fig 3 Principle of intelligent drug release system
纯的PNIPAm水凝胶本身机械强度较差,使它在药物载体中的应用受到限制。Zhang等[74]为了改善PNIPAm的力学性能,合成了一种具有互穿聚合物网络(IPN)结构的温敏PNIPAm水凝胶。使IPN-PNIPAm水凝胶的玻璃化转变温度(Tg)比纯PNIPAm水凝胶有所增加,其机械性能有了很大的提高。Chen等[75]以无毒的粘土和天然分子京尼平作为交联剂,用一锅自由基聚合光引发的方法,制备了一种新型的基于NIPAm的生物相容性好、机械强度高的双网络纳米水凝胶复合材料,通过调整水凝胶中的交联密度,保证了水凝胶的溶胀率和对阿司匹林的控释性能。
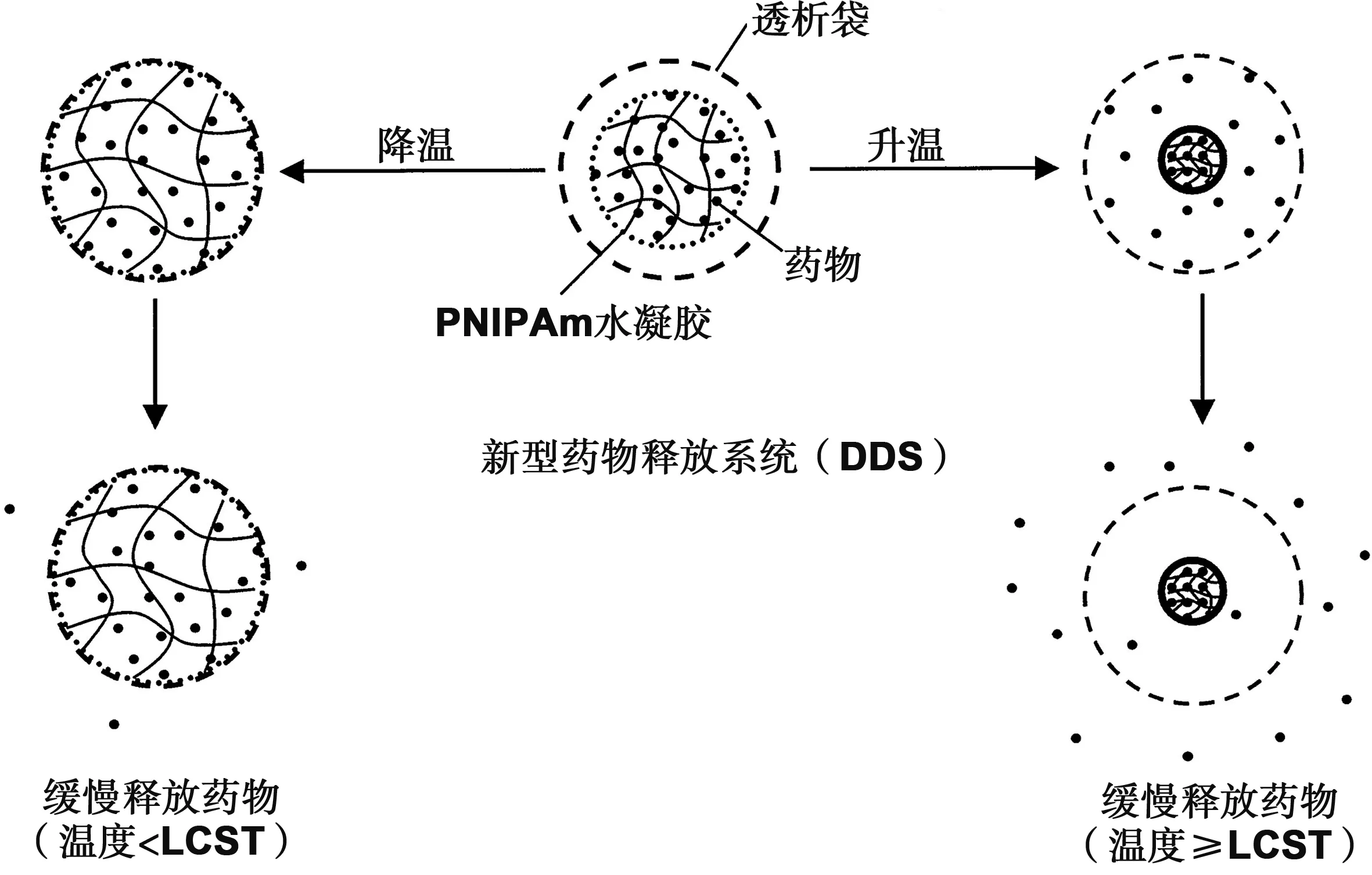
图4 通过调节外部温度产生正向药物释放的新型热响应药物释放系统(DDS)的示意图[68]Fig 4 Schematic illustrations of the novel, thermo-responsive drug delivery system (DDS) to give a positive drug release by modulating the external temperature[68]
近年来,可以对多个外界刺激产生响应的智能纳米水凝胶逐渐受到关注[76-77],用NIPAm与其他刺激响应性单体共聚,可以得到同时响应多个刺激的智能纳米水凝胶,达到对特定药物的定点释放。Ancla等[78]以NIPAm为主链单体,3-氨基苯硼酸为共聚单体,采用沉淀聚合法制备了具有葡萄糖刺激响应性的纳米水凝胶,该凝胶随着葡萄糖浓度增加而溶胀,可以作为胰岛素的输送载体,根据人体血糖浓度变化可控地释放胰岛素。Luo等[79]制备了具有温度和pH双重响应性的聚N-异丙基丙烯酰胺/羧甲基壳聚糖/多壁碳纳米管半互穿纳米杂化水凝胶(PNIPAm/CMCS/MWCNTs)。并用该水凝胶成功地捕获了亲水性抗肿瘤药物阿霉素(DOX),其可以负载蛋白质或亲水性抗癌药物用于肿瘤靶向治疗。Muratalin等[80]采用无皂乳液聚合(SFEP)技术将PNIPAm与与丙烯酸(AA),3-丙烯酰胺基苯基硼酸(3-APB),(3-丙烯酰胺基丙基)三甲基溴化铵(ATMA)以及1-乙烯基咪唑(VI)多种单体共聚,得到的微凝胶对温度,pH,葡萄糖和铜(Ⅱ)离子多重刺激敏感,其溶胀特性和接近人体温度的体积相变温度有望用于药物递送系统。
3 DNA分离
脱氧核糖核酸(DNA)是遗传信息的载体,基因的实体。“人类基因组计划”(Human Genome Project, HGP)的宗旨是测定人类染色体中核苷酸序列,从而绘制人类基因组图谱[81]。因此DNA的分离和序列分析是基因组计划的关键,也是基因研究的核心内容。目前使用毛细管电泳(capillary electrophoresis, CE)对DNA进行分离与测序的应用已经使用广泛[82-84],毛细管电泳是一类以高压直流电场为驱动力,毛细管为分离通道,依据样品中各组分之间淌度和分配行为的差异而实现分离的新型液相分离技术。凭借其高效、微量、高灵敏度及自动化等优点,毛细管电泳在对核酸、多肽、蛋白质等生物大分子的分离分析的生物医学领域展示出很好的优越性[85-87]。CE对DNA的分析是通过在毛细管柱中填充凝胶或聚合物溶液等筛分介质形成凝胶色谱柱,依据DNA片段大小和形状可以在电泳过程中实现筛分[88]。纳米材料[89]、二氧化硅纳米颗粒[90]、金纳米棒[91]等作为复合分离介质已成功用于分离DNA[92]。这种凝胶毛细管柱虽然分离效率较高,但是高粘度交联的聚合物会导致毛细管柱难以制备和维护。近年来报道的亲水性聚合物溶液筛分体系的应用,很好地解决了这个问题[88]。其中NIPAm体系的水凝胶聚合物溶液不仅具有自动涂覆毛细管内壁的能力,而且可以通过温度来调节水凝胶溶液的粘度使其更容易注入毛细管(图5),再利用NPs本身的交联网状性质对DNA实现很好的分离效果。
Sassi等[93]以PNIPAm凝胶微球制成的分离基质来分离DNA。这些微凝胶在温度高于LCST时皱缩,形成低粘度状态,在温度低于LCST时发生溶胀,它们在低温下缠结,可以获得良好的筛分性能。然而该凝胶在胶凝化时会变混浊,不利于CE分离。通过向PNIPAm主链上接枝带有侧链的水溶性骨架即可解决该问题[94]。Liang等[95]制备了一种聚NIPAm和聚环氧乙烷(PEO)接枝共聚的(PNIPAm-g-PEO)NPs,它具有网格大小均一的筛分网络结构,在毛细管电泳分离DNA时表现出良好的分离效果。此聚合物溶液可以在毛细管内壁形成动态涂层,从而抑制电渗流和DNA与毛细管壁的相互作用,并且容易将其灌入或冲出毛细管,提高了毛细管的使用效率和寿命。然而一般的基因测序温度为50~60 ℃,该凝胶的低黏度状态是在高于分离温度的条件下获得的,这不利于操作,因此具有反向收缩行为的聚合物也有许多研究。Sudor等[96]合成了一种PAm(聚丙烯酰胺)接枝PNIPAm的水凝胶用于DNA的分离,由于PNIPAm在低于LCST(约32 ℃)的水溶液中溶胀,而在高温状态下收缩沉淀。当将PNIPAm接枝在PAm骨架上后,PNIPAm能形成类似于胶束的聚集,并产生短暂交联,大幅度降低了NPs的黏度(图6),对DNA取得了很好的分离效果。
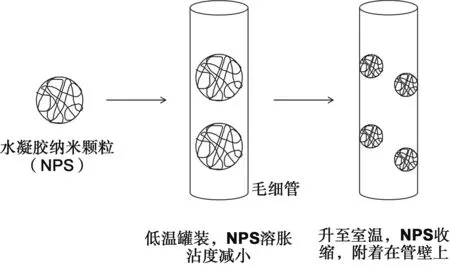
图5 利用NIPAm水凝胶的温敏性使NPs固定于毛细管内壁Fig 5 The temperature sensitivity of NIPAm hydrogel enables NPs to be fixed to the inner wall of the capillary
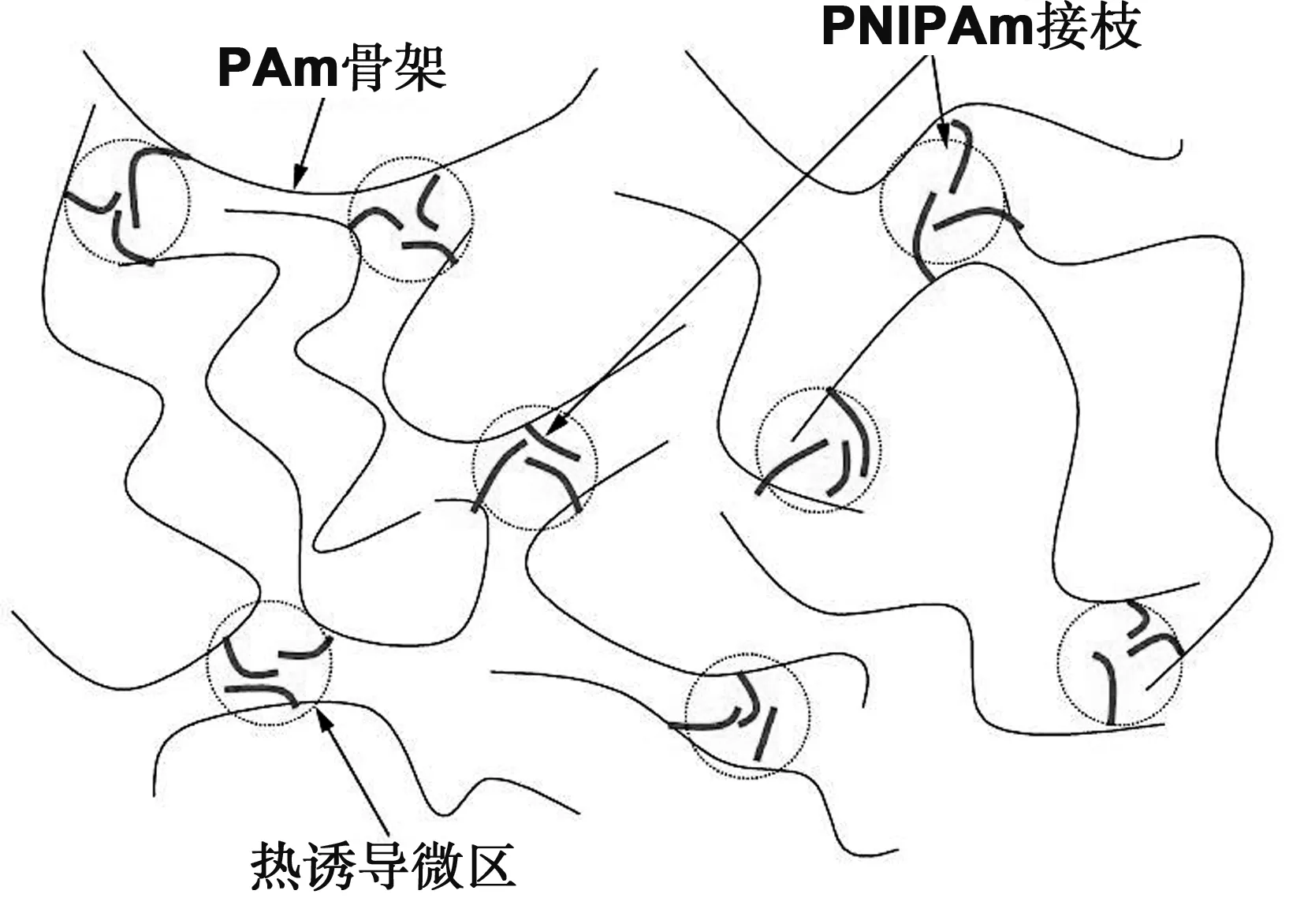
图6 LCST以上聚合物结构的简单示意图[97]Fig 6 Schematic diagram of polymer structure above LCST[97]
在CE分离时,如果温度过高,水凝胶的热增稠性能会使其发生团聚,本课题组[98]通过在PNIPAm的主链上引入亲水且带电的丙烯酸羟乙酯(HEAc)和丙烯酸(AAc)单体,设计并合成了一系列以NIPAm为基质的纳米水凝胶颗粒,解决了NPs作为CE分离介质分离DNA在较高温度下团聚的问题。我们还进一步探讨了单体用量、NPs粒径以及NPs在毛细管电泳中的浓度对DNA分离效果的影响,并在3 min内实现了对3个较短DNA片段(20、50和80 nt)的快速高效分离。
目前,利用NIPAm温敏性纳米水凝胶的聚合物交联网络结构用于毛细管电泳中不同DNA片段的分离与测序的报道尚不详尽,有很大的进一步研究的空间,今后可以通过改变温度来调整PNIPAm的交联网络大小,实现对不同大小的DNA分子的分离。也可以通过设计NPs的表面基团,利用NPs对不用DNA序列的吸附能力的差异,实现对相似DNA及其他生物大分子的分离。
4 结 语
NIPAm温敏性纳米水凝胶作为智能水凝胶的一种,利用它独特的温敏响应性能,在蛋白识别、药物输送与释放、DNA分离等生物领域中展示出极大的应用前景。目前的研究结果为合成抗多种毒性蛋白和多肽的人工抗体提供了指导;通过扩大功能性单体的多样性并优化单体的组合和比例,就可以获得能用于体内靶向给药的载体和用于毛细管分离DNA的介质。但是,它本身存在的缺陷,比如其单体种类仍比较单一,且对单体的配比数量要求比较严格,靶标蛋白的选择也存在局限性,响应速度较慢以及机械强度低等严重影响了它在生物医学领域中的实际应用。在其他领域,NIPAm温敏性纳米水凝胶的应用还比较少。但随着相应研究的不断深入,NIPAm纳米水凝胶有望突破目前生物研究的局限,广泛的应用在生物医学及其他领域中。

