TiS2纳米片多孔负极材料的制备及其电化学性能
罗 倩,黄 昊
(大连理工大学 材料科学与工程学院,辽宁省能源材料及器件重点实验室,辽宁 大连 116024)
0 引 言
锂离子电池具有能量密度高、无记忆效应、无环境污染等优点,广泛应用于便携式电子设备和电动汽车等领域[1-3]。锂离子电池负极材料是影响电池性能的关键因素之一,根据其与锂离子反应机制的不同,负极材料可以分为3种[4-7]:嵌入脱嵌型、合金化型、转化型电极材料。高比容量的Si、Sn等是典型的合金化型电极材料,但在充放电过程中有剧烈的体积变化,容量衰减快、循环稳定性差[7- 8]。常见的转换型负极材料有过渡金属氧化物、金属氢化物等几种,其储锂过程是一个多电子转移过程[5],因此有着相对高的比容量。然而,材料在充放电过程中存在严重的体积变化及结构重组,易造成电极片粉碎、活性物质分离,颗粒间的电化学接触变差,材料容量衰减较快[7- 8]。典型的嵌入脱嵌型电极材料为石墨类碳材料,也是目前商业化的负极材料,其具有优异的循环稳定性[8]。然而,其实际电化学比容量(约为330 mAh/g)已接近其理论值(372 mAh/g),容量提升空间受到限制[9]。因此,探寻新型高容量负极材料已成为锂离子电池领域的一个热门研究方向。
TiS2是典型的层状过渡金属硫化物,层内原子间存在强共价键,层间通过范德华力结合[10],层间距约为0.57 nm[11]。而锂离子的半径仅为0.076 nm, TiS2可以为锂离子的脱嵌提供充足的空间。此外,TiS2还具有高的电子导电率及锂离子扩散速率、在所有层状硫化物中质量最轻及成本最低等优点[12-14]。因此,TiS2用作锂离子电池负极材料有着良好的应用前景。
目前,TiS2的制备方法主要有固相烧结法和液相胶体法;传统固相法主要制备尺寸较大的TiS2,且制备过程中所需温度高,花费时间长[15]。陈仕玉等[9]用固相法制备微米级TiS2颗粒用作锂离子电池负极材料,测试结果显示电池容量衰减较快;减小颗粒尺寸后电池性能明显提高。因此,若能将材料减小到纳米尺寸,则其电化学性能会有更大的提升。液相胶体合成法虽然可以制备纳米级TiS2,但是在这种制备方法中使用的前驱体多为TiCl4和CS2,容易引入杂质元素,影响产物纯度[16]。
本文采用直流电弧等离子体法制备钛氢化合物纳米颗粒作为前驱体,经过400 ℃硫化得到TiS2纳米片多孔结构。直流电弧等离子体法保证了前驱体的化学纯度,且很好地保持了材料的纳米尺寸;硫化、去硫过程所需温度低,花费时间短。TiS2纳米片多孔结构用作锂离子电池负极,表现出循环稳定性好、充放电可逆性高、容量衰减慢等优点。
1 实 验
1.1 直流电弧等离子体法制备钛氢合物纳米粒子前驱体
以纯度为99.999%的钛块作为负极,以钨棒作为正极,置于直流电弧等离子体放电设备腔体内并抽真空至10-3Pa,通入0.03 MPa Ar和0.02 MPa H2,起弧蒸发钛块;30 min后断弧进行冷却以免电极温度过高导致钨棒熔化,冷却20~30 min后再次起弧蒸发块体;制备结束约5 h后打开空气进气阀通入少量空气进行钝化,约10 h后收集腔内粉体。
1.2 TiS2纳米片多孔结构的制备
在手套箱中将钛氢化合物前驱体与升华硫以质量比1∶4(硫过量)均匀混合并装入石英瓶内,放入反应釜中密封。将反应釜置于管式炉的恒温区,封闭管式炉,缓慢抽真空至-0.1 MPa,并通入约0.03 MPa Ar作为保护气,以10 ℃/min的速度加热至400 ℃,保温90 min,待完全冷却后取出反应釜。将反应釜中的粉体研磨后倒入石英舟中并再次放入管式炉恒温区进行去硫处理,抽真空至-0.1 MPa后通入保护气Ar,以每分钟约10 ℃的速度加热至200 ℃,保温120 min,期间每过20 min抽一次真空并通入保护气氩气,待保温结束,温度降至室温后取出粉体。
1.3 材料表征
采用InVia拉曼光谱仪分析材料分子组成,激发波长为532 nm;采用原子力显微镜(AFM, DI-Multimode NS3A-02)测试纳米片厚度;采用物理吸附仪(BET, AUTO SORB-1-MP)测试样品的孔特性;采用XRD-6000X射线衍射仪对粉体进行物相分析,扫描范围为10°~90°,扫描速度为4°/min;采用Tecnai G220 S-Twin透射电子显微镜(TEM)与SUPRA55场发射扫描电子显微镜(SEM)观察样品的微观形貌特征。
1.4 电池组装及电化学性能测试
按质量比8:1:1称取TiS2纳米粉体、粘结剂(聚偏氟乙烯,PVDF)和导电剂科琴黑放于研钵中均匀混合。逐滴加入N-甲基吡咯烷酮(NMP)溶液,混合搅拌得到糊状浆料,并均匀涂覆于铜箔上;将涂覆有活性物质的铜箔放入真空干燥箱内,100 ℃下干燥24 h。待干燥完毕,箱内温度降至室温时取出,冲裁成直径14 mm的电极片,以锂片为对电极,1 mol/L LiPF6/EC+DEC(体积比1∶1)为电解液,组装成CR2025纽扣电池,放置24 h活化后采用LAND CT2001A蓝电电池测试系统对电池进行恒流充放电测试与倍率性能测试,测试电压范围为0.01~3.00 V。
2 结果与讨论
TiS2纳米粉体制备工艺如图1所示。在直流电弧等离子体放电设备中以钛块为负极,钨棒为正极,起弧蒸发钛块,蒸发出的钛原子与腔体内电离的氢离子体相结合形成钛氢化合物纳米粒子。钛氢化合物纳米粒子与升华硫混合后于管式炉中进行硫化、去硫操作后,得到TiS2纳米粉体。

图1 直流电弧等离子体法及硫化工艺示意图Fig 1 Illustration of DC arc plasma and vulcanization method
2.1 材料形貌与结构表征
图2(a),(b)分别为前驱体钛氢化合物纳米粒子的SEM图与TEM图,从图中可以清晰看到前驱体微观形貌呈球形,平均粒径为50~60 nm,粒子表面存在一层厚度为1~2 nm的无定形氧化层,氧化层的出现是由于在制备结束后、粉体收集前,粒子经历了弱氧化(钝化)过程所导致的[17]。
TiS2纳米粉体的SEM与TEM表征结果如图3所示。SEM图(图3a,b)表明所制备的TiS2纳米粉体微观形貌呈纳米片状,纳米片沿空间任意方向生长形成多孔结构。图3(c)为TiS2的TEM图,进一步呈现了其纳米片状的微观形貌,并且在HRTEM结果(图3d)中可以看到明显的TiS2晶格条纹,晶面间距为0.2948 nm,与TiS2(100)晶面的晶面间距一致。TiS2纳米片的厚度可由原子力显微镜(AFM)测得(如图4a),由图可知,TiS2纳米片的厚度约为50~60 nm。多孔结构的孔特性可通过BET测试得到(如图4b),N2吸-脱附曲线为Ⅳ型等温线,样品孔径主要分布在2~50 nm的介孔范围内,表明材料孔结构呈介孔特性[18]。介孔材料丰富的孔洞及大的比表面积不仅有利于电解液充分浸润电极材料,而且能缩短锂离子扩散路径,加速锂离子扩散,提升电池的动力学性能[19]。

图3 TiS2纳米粉体的SEM图, TEM图, 高分辨TEMFig 3 SEM, TEM and HRTEM images of TiS2 nano-powder
图5为前驱体及TiS2纳米粉体的XRD表征结果。由图5 (a)可以看出,前驱体的XRD图谱中,出现的衍射峰分别对应着与TiH1.924的(111),(200),(220),(311),(222)晶面,与TiH1.924标准图谱(JCPDS 00-025-0928)中的特征峰一致,表明制备的前驱体为晶化完全的单一TiH1.924相。图5(b)为去硫后纳米粉体的XRD图,图中所呈现出的衍射峰分别对应着纯TiS2的(001),(101),(102),(110),(103),(201)晶面,与TiS2标准图谱(JCPDS 00-015-0853)中的主要特征峰一一对应,表明我们已经制备得到了纯度较高的TiS2纳米粉体。为了进一步了解样品的分子组成,我们对样品进行了Raman测试,结果如图6所示。图中在拉曼位移为149.1、388.7、510.8、623.4 cm-1位置处出现的4个峰为TiS2的特征峰,203.1 cm-1处的峰为单质S的特征峰[12],但这个峰的强度较其他峰小得多,说明最终制备得到的样品主要为TiS2,并且含有少量的S单质。
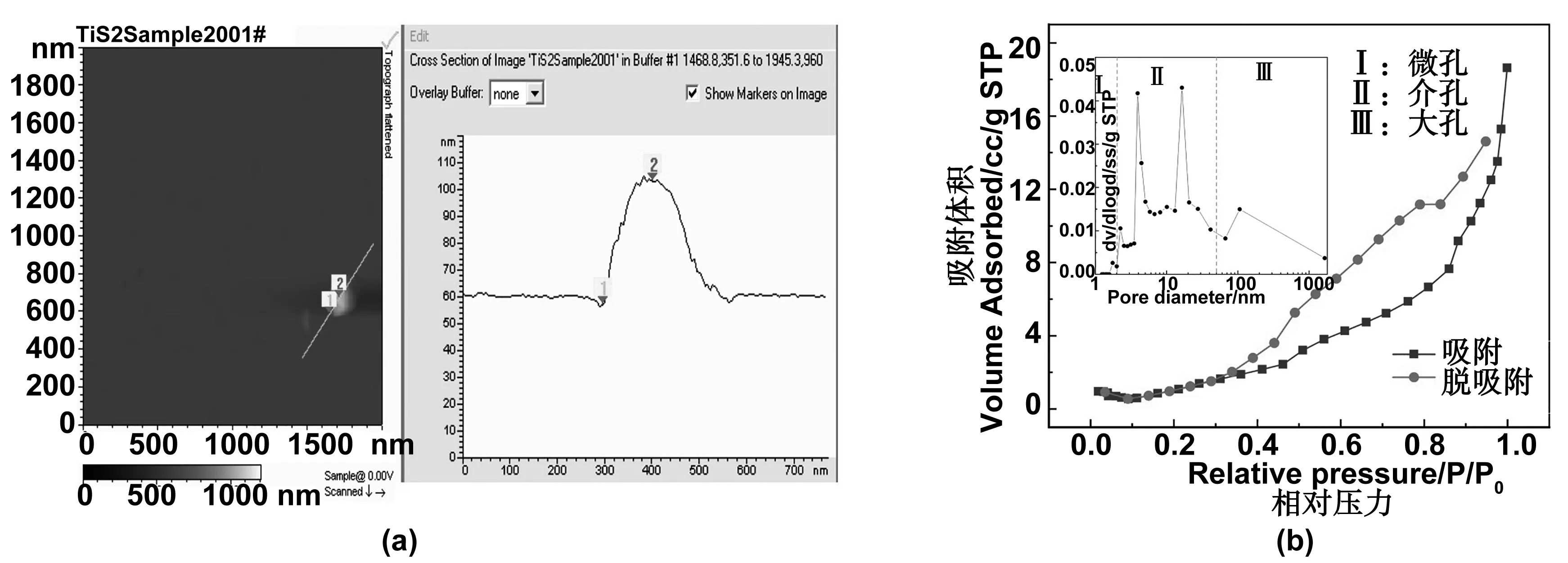
图4 (a) TiS2纳米片的AFM图(b)TiS2纳米粉体的BET测试曲线Fig 4 AFM image of TiS2 nanosheet and BET measurement curves of TiS2 nano-powder

图5 钛氢化合物纳米粒子XRD衍射图和TiS2纳米粉体XRD衍射图Fig 5 XRD pattern of titanium hydride compound nanoparticles and TiS2 nano-powder
2.2 TiS2纳米片多孔结构负极电化学性能表征
图7为TiS2作为锂离子电池负极材料的充放电机理图;充电时,电子由正极经外部电路到达TiS2负极,锂离子从正极材料脱出,进入电解液,穿过隔膜,到达TiS2电极并逐渐嵌入其层间,与传输到负极的电子结合发生反应。放电时则相反,电子从TiS2电极经外电路传输到正极,锂离子则从TiS2层间脱出,进入电解液,穿过隔膜,到达正极与电子结合,从而实现电能的储存与释放。
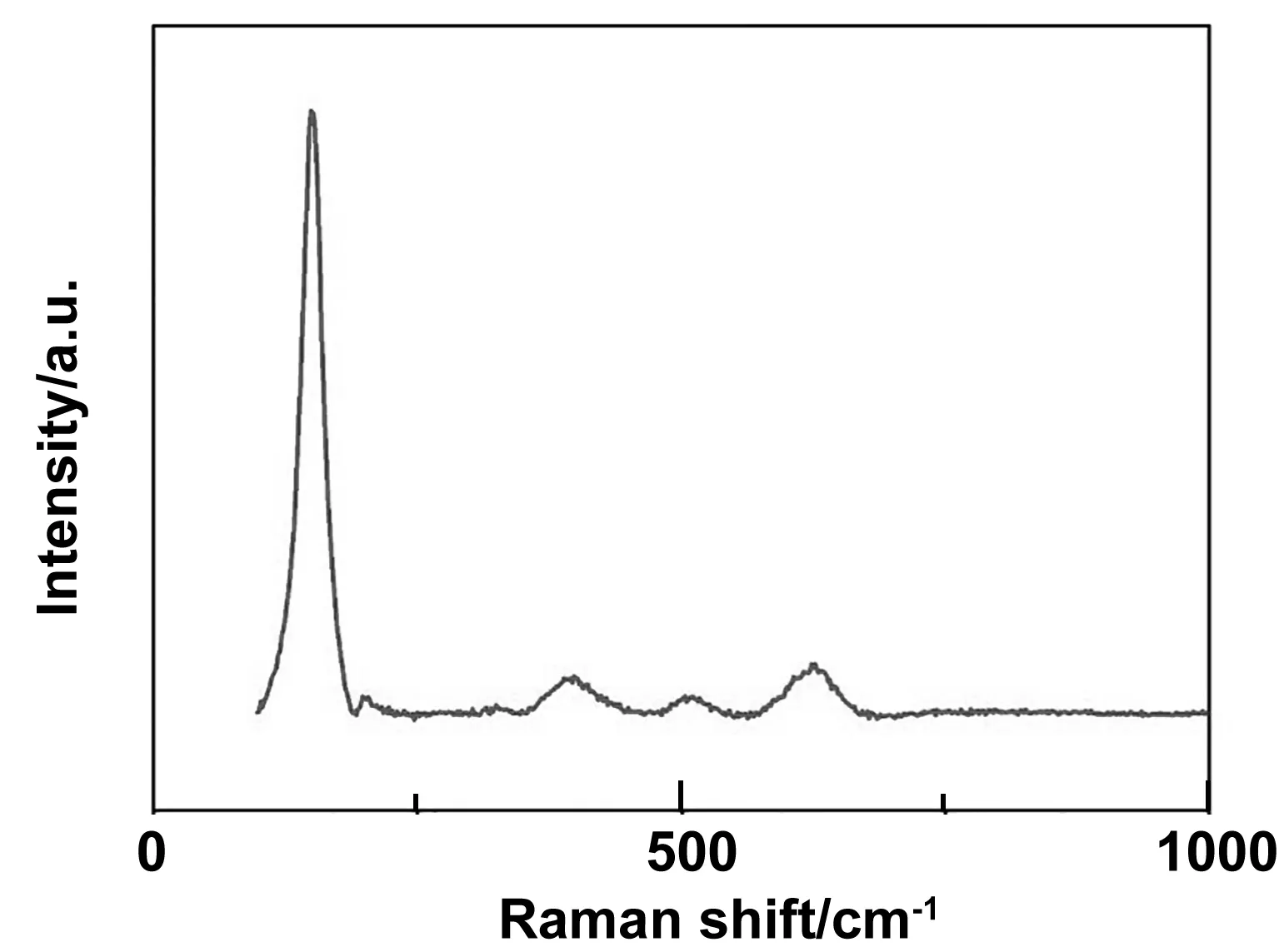
图6 TiS2纳米粉体的Raman图谱Fig 6 Raman spectra of TiS2 nano-powder
图8(a)为TiS2纳米片多孔结构负极材料在500 mA/g电流密度下的循环性能曲线。由图可知,电池在首次放电比容量为1 193.0 mAh/g,充电比容量为816.0 mAh/g,首次循环库伦效率为68.4%。随循环次数增加,电池比容量逐渐降低、库伦效率逐渐升高,并在30次循环后逐渐稳定。经50次循环后,电池比容量稳定在550 mAh/g左右,库伦效率稳定在98%左右。TiS2纳米片多孔结构负极表现出优异的循环稳定性与充放电可逆性。图8 (b)为纳米TiS2多孔结构负极在100、200、500 mA/g、1、5 A/g、100 mA/g的电流密度下测试的倍率性能曲线。由图可知,随着电流密度的增加,电池极化现象加剧,电池的充放电比容量逐渐减小,当电流密度达到5 A/g时,电池容量仍保持100 mAh/g的容量;当电流密度回复到100 mA/g时,电池容量能恢复到470 mAh/g左右,说明纳米TiS2多孔结构负极在经大电流密度充放电后容量保持率高,具有优异的倍率性能。

图7 TiS2负极的充放电机理图Fig 7 Mechanism of TiS2 anode during discharging/charging process
图9为TiS2纳米片多孔结构负极在500 mA/g电流密度下的充放电曲线,在首次放电过程中,在1.60、1.15、0.65、0.30 V附近有4个明显的电压平台,其中1.60、1.15 V 处的两个平台对应着不同程度的Li+嵌入TiS2纳米片[20]:TiS2+xLi++xe-LixTiS2;0.65 V附近的电压平台对应着SEI(固体电解质膜)的形成,SEI膜的形成是一个不可逆的过程,因此在之后的循环中该电压平台变窄最后消失,SEI膜的形成会消耗部分锂离子,造成电池首次充放电容量的不可逆衰减。0.30 V附近的电压平台对应中间产物LixTiS2的进一步嵌锂过程,发生转换反应:LixTiS2+(4-x)Li++(4-x)e-→2Li2S+Ti。充电过程中,在1.35、1.90、2.35 V附近存在出现了三个明显的电压平台,其中1.35 V处的电压平台对应着如下反应:2Li2S+Ti→TiS2+4Li++4e-;1.90 V附近的平台对应着嵌入反应的逆反应:LixTiS2TiS2+xLi++xe-;2.35 V处的电压平台则对应着反应[21]:Li2SS+2Li++2e-。从图中也可以看出,充放电曲线的对称性较好,随着循环进行,容量虽有衰减,但衰减幅度小, TiS2纳米片多孔结构负极呈现出优异的循环稳定性与充放电可逆性。
3 结 论
利用直流电弧等离子体法,在H2和Ar的混合气氛中制备得到TiH1.924纳米粒子作为前驱体,与升华硫均匀混合后置于真空管式炉中硫化、去硫后得到TiS2纳米片沿空间任意方向生长形成的多孔负极材料。TiS2纳米片多孔结构用作锂离子电池负极材料具有优异的电化学性能。电流密度为500 mA/g时,首次充放电比容量分别为1193.0和816.0 mAh/g,50次循环后放电比容量仍然保持在550 mAh/g左右,在5 A/g的高电流密度下仍维持有100 mAh/g 的容量,具有优异的循环稳定性、充放电可逆性和良好的倍率性能,是一种很有前景的锂离子电池负极材料。

