Six1基因甲基化在肝癌病情及预后评估中的价值
蒲 娇,张林颖,张小晶
空军军医大学第一附属医院西京医院肝胆胰脾外科,陕西 西安 710032
Six1基因为转录调控因子,可促进细胞增殖并减少其凋亡,介导恶性疾病的发生、发展[1-2]。资料显示,甲胎蛋白阴性肝癌组织Six1基因蛋白质表达水平显著高于癌旁肝组织,且其表达与肿瘤的TNM分期及脉管浸润相关,但对其机制无明确研究[3],基于基因表达的关系,推测低甲基化激活可能与Six1基因蛋白质表达增加有关。本研究检测肝癌患者及慢性肝炎患者Six1基因甲基化并分析其与临床病理因素关系,研究Six1基因甲基化在肝癌病情及预后评估中的价值。
1 资料与方法
1.1 临床资料选取2014年1月至2018年6月我院诊治的肝癌患者为研究对象,均符合以下标准:(1)经增强CT或MRI、甲胎蛋白、穿刺病理组织学及术后病理组织学确诊为肝癌;(2)无手术禁忌证;(3)无严重心、脑、肺疾病;(4)无其他肿瘤;(5)首次诊治;(6)知情同意。将同期慢性肝炎患者纳入对照。肝癌患者和慢性肝炎患者在性别、年龄、乙型肝炎史和肝功能异常方面差异无统计学意义(P>0.05),具有可比性,具体结果见表1。
1.2 细胞与试剂肝癌细胞系HepG2、C3A和SMMC-7721购自中国科学院典型培养物细胞库;胎牛血清(目录号C0227)、基因组提取试剂盒(目录号D0061)购自碧云天生物科技公司。甲基化检测试剂盒(目录号EM101)购自北京天根生化科技有限公司。DMEM高糖完全培养基(目录号PM150210C)购自武汉普诺赛生命科技有限公司。完全培养基为90%高糖DMEM+质量浓度为100 g/L胎牛血清,培养条件为37 ℃、体积分数为5% CO2培养箱。

表1 肝癌患者和慢性肝炎患者一般临床资料对比Tab 1 Comparison of general clinical data between patients with liver cancer and chronic hepatitis
1.3 Six1基因甲基化检测肝癌患者取肝癌组织和癌旁正常组织,慢性肝炎患者取穿刺活检组织,分别提取肝癌组织、癌旁正常组织、慢性肝炎组织和肝癌细胞系基因组DNA。重亚硫酸盐转化后采用甲基化特异性PCR法检测3种组织Six1基因甲基化,以Methprimer设计为引物设计,扩增反应体系体积设定为25 μl,引物序列见表2。反应条件:94 ℃预变性10 min,94 ℃变性60 s,61 ℃退火30 s,72 ℃延伸30 s,共30个循环,最后1个循环72 ℃延伸8 min。扩增产物经琼脂糖凝胶电泳后进行照相显像,U表示未甲基化,M表示甲基化。

表2 Six1基因甲基化检测引物序列Tab 2 Six1 gene methylation detection primer sequence
1.4 预后评估统计肝癌患者R0切除率、3年生存率及无进展生存期。
1.5 统计学分析采用SPSS 19.0统计软件进行分析。肝癌患者肝癌组织Six1基因甲基化率的差异比较采用χ2检验或Fisher精确概率法计算P值;计量资料采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 Six1基因甲基化对比慢性肝炎患者Six1基因甲基化率为97.5%(39/40),肝癌患者肝癌组织Six1基因甲基化率为27.5%(22/80),癌旁正常组织Six1基因甲基化率为97.5%(78/80),肝癌患者肝癌组织低于癌旁正常组织及慢性肝炎患者Six1基因甲基化率(P均<0.05),而癌旁正常组织Six1基因甲基化率与慢性肝炎患者差异无统计学意义(P>0.05)。
2.2 临床病理因素中Six1基因甲基化差异肝癌患者肝癌组织Six1基因甲基化在年龄、性别、HbsAg、病变部位、甲胎蛋白和病理类型方面差异均无统计学意义(P均>0.05),在肿瘤大小、分化程度、TNM分期、门脉癌栓及远处转移方面差异均有统计学意义(P均<0.05),无门脉癌栓、肿瘤大小<8 cm、高分化、Ⅰ期+Ⅱ期、无远处转移患者Six1基因甲基化率均高于有门脉癌栓、肿瘤大小≥8 cm、低+中分化、Ⅲ期+Ⅳ期、有远处转移患者(P均<0.05)(见表3)。
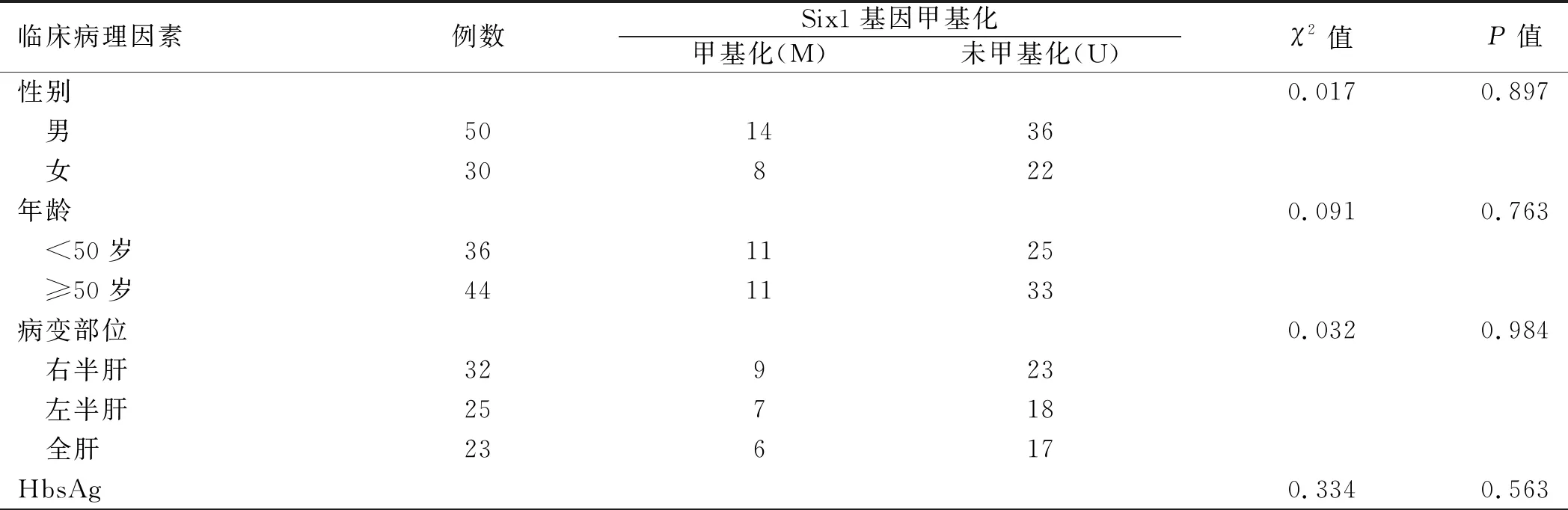
表3 不同临床病理因素中Six1基因甲基化比较Tab 3 Comparison of Six1 gene methylation in different clinicopathological factors
续表3

临床病理因素例数Six1基因甲基化甲基化(M)未甲基化(U)χ2值P值 阳性601545 阴性20713病理类型0.0190.887 肝细胞癌681850 其他1248甲胎蛋白0.0040.950 ≥400 μg/L451332 <400 μg/L35926分化程度4.1240.042 高分化381523 低+中分化42735肿瘤大小5.0190.025 <8 cm562036 ≥8 cm24222门脉癌栓5.5860.018 有25223 无552035远处转移4.2800.039 有18117 无622141TNM分期6.0350.014 Ⅰ期+Ⅱ期461828 Ⅲ期+Ⅳ期34430
2.3 预后对比肝癌患者中Six1基因甲基化患者R0切除率和无进展生存时间均显著高于未甲基化患者,3年死亡率显著低于未甲基化患者,差异均有统计学意义(P均<0.05)(见表4)。
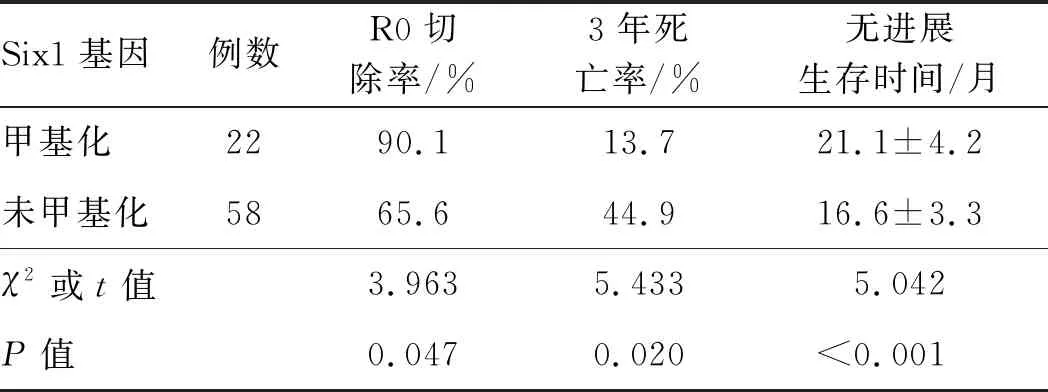
表4 肝癌患者Six1基因甲基化和未甲基化预后对比Tab 4 Comparison of prognosis of methylated and unmethylated Six1 genes in patients with liver cancer
2.4 肝癌细胞系Six1基因甲基化肝癌细胞系HepG2、C3A和SMMC-7721中Six1基因均检测到处于非甲基化状态,表明Six1基因处于非甲基化灭活状态(见图1)。肝癌细胞系HepG2、C3A和SMMC-7721培养状态如图2所示。
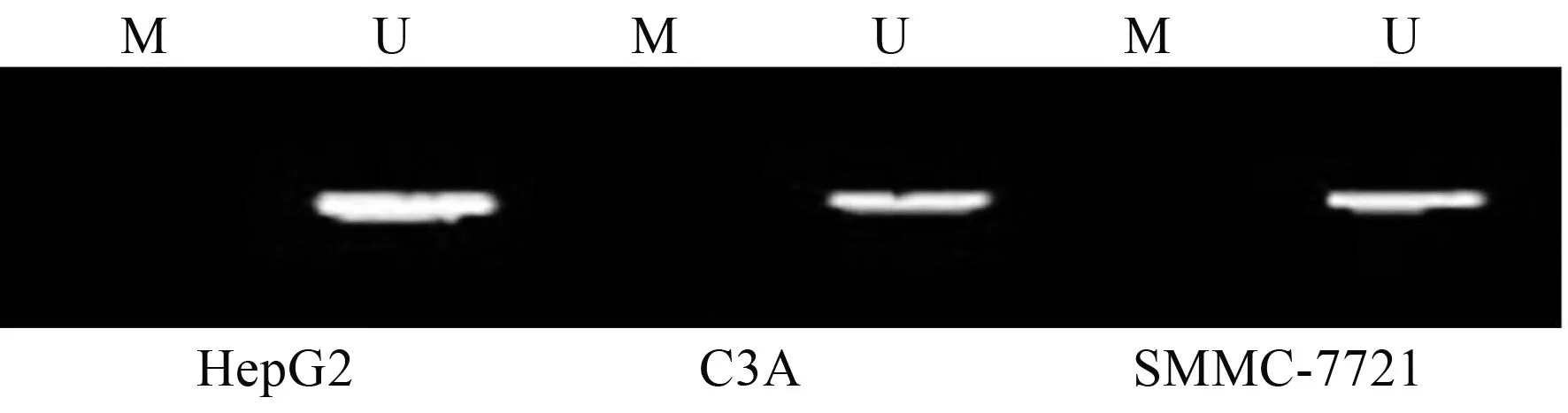
图1 肝癌细胞系HepG2、C3A和SMMC-7721中Six1基因 甲基化Fig 1 Six1 gene methylation in liver cancer cell lines HepG2, C3A and SMMC-7721

图2 肝癌细胞系HepG2、C3A和SMMC-7721培养状态(放大200倍) Fig 2 Status of liver cancer cell lines HepG2, C3A and SMMC-7721
3 讨论
肝癌的发病机制目前尚未完全明确,可能与多种因素有关,其中原癌基因表达异常是最重要的发病机制,包括基因突变、单核苷酸多态性及表观遗传学等基因水平异常,可导致原癌基因表达异常,其中表观遗传学是目前最常见的机制[4]。Six1基因属于转录调控因子,为E2F1的转录靶基因,转录激活于G1-S期,转录水平增加于S期,Six1可经激活Cyclin A1、Cyclin D1等靶基因开启靶基因转录,进而抑制其结合DNA,于有丝分裂后期降解[5]。研究发现,Six1过表达可减弱上述作用,缩短细胞周期,导致细胞增殖,致使肿瘤发生[6]。作为磷酸化蛋白,在酪蛋白激酶Ⅱ作用下,Six1可被磷酸化而丧失活性,致使G1-M期转变,特别是对DNA损伤的反应[7-8]。研究发现,在多种恶性肿瘤中,Six1基因蛋白表达水平明显降低,并与预后相关的TNM分期密切相关,其高表达往往预示肿瘤的预后极差,可能在肿瘤病情及预后评估中具有重要价值。
甲基化主要发生于真核生物的CpG富集的CpG岛,甲基化CpG自身结构或与甲基结合蛋白结合后可阻遏转录因子与启动子结合,从而抑制基因表达,产生甲基化灭活,当甲基化水平降低时可导致基因激活而发生肿瘤。研究发现,Six1基因启动子含有甲基化调控的CpG岛,在消化道肿瘤和泌尿妇产科等多种肿瘤中处于低甲基化激活状态[9-10]。基于基因表达的中心法则及Six1基因蛋白质表达在肝癌组织中显著升高的现象,推测Six1基因甲基化异常可能是导致其蛋白质表达异常的根本原因。本研究采用甲基化特异性PCR检测肝癌患者肝癌组织、癌旁正常组织和慢性乙型肝炎患者肝组织Six1基因甲基化并比较其差异,检测不同人肝癌细胞系Six1基因甲基化,发现肝癌患者肝癌组织Six1基因甲基化率显著低于癌旁正常组织和慢性肝炎患者肝组织,肝癌细胞系HepG2、C3A和SMMC-7721中Six1基因均检测到处于非甲基化状态,表明Six1基因处于非甲基化灭活状态,证实Six1基因低甲基化激活与肝癌发病机制密切相关。
本研究发现,肝癌组织Six1基因甲基化在肿瘤大小、分化程度、TNM分期、门脉癌栓及远处转移方面均存在差异,无门脉癌栓、肿瘤大小<8 cm、高分化、Ⅰ期+Ⅱ期、无远处转移患者Six1基因甲基化率均高于有门脉癌栓、肿瘤大小≥8 cm、低+中分化、Ⅲ期+Ⅳ期、有远处转移患者,进一步研究发现,肝癌患者中Six1基因甲基化患者R0切除率和无进展生存时间均显著高于未甲基化患者,3年死亡率显著低于未甲基化患者,差异均有统计学意义,这些证据表明,Six1基因低甲基化与肝癌患者的病情及预后紧密相关,Six基因低甲基化意味着患者病情严重且预后差。值得注意的是,本研究病例样本少且为单中心研究,Six基因低甲基化在肝癌病情及预后评估中的价值有待于进一步研究证实。

