腹泻型肠易激综合征神经调节剂的选择和疗效
陆 佳, 史丽丽, 方秀才, 朱丽明, 樊文娟, 杨爱明
中国医学科学院 北京协和医学院北京协和医院 1.消化内科;2.心理医学科,北京 100730
肠易激综合征(irritable bowel syndrome,IBS)是以腹痛伴有排便习惯和粪便性状改变为特点的最常见的功能性肠病之一,中国IBS患病率为6.5%,以腹泻型肠易激综合征(IBS with diarrhea,IBS-D)为主[1]。临床上针对IBS-D的常规治疗主要包括饮食、生活方式调整和对症治疗(包括解痉剂、止泻剂、益生菌等),总体有效率低[2]。焦虑、抑郁是IBS患者最常见的精神心理异常[3],可影响患者肠道症状的严重程度、生活质量和对治疗的反应[4-5]。神经调节剂(包括抗焦虑药和抗抑郁药)能够显著改善IBS[6],尤其是IBS-D患者的精神心理状态和肠道症状,对难治性IBS亦有效[7-10],但目前尚缺乏IBS患者神经调节剂治疗指征和药物选择的共识。汉密尔顿焦虑量表(Hamilton Rating Scale for Anxiety,HAMA)和抑郁量表(Hamilton Rating Scale for Depression,HAMD)广泛用于评定IBS患者的焦虑和抑郁状态[3],国内信度和效度检验均较好[11-12]。其结构因子可反映焦虑、抑郁的症状特点,作为心理干预或药物治疗前后疗效预测指标[13-14]。本研究通过总结分析IBS-D患者精神心理状态、肠道症状、神经调节剂选择和疗效,为临床优化治疗IBS-D提供参考。
1 资料与方法
1.1 一般资料连续入组2009年7月至2017年5月在北京协和医院消化内科门诊确诊IBS-D且纳入IBS数据库的患者。IBS-D诊断和分型依据罗马Ⅲ诊断标准[15]。所有患者近1年内经实验室和结肠镜等检查明确排除胃肠道器质性疾病、结缔组织病和代谢性疾病[16]。在充分知情后,患者签署知情同意书或口头表示同意将其临床资料纳入IBS数据库。本研究已获得北京协和医院伦理委员会审核批准(S-234)。
1.2 研究方法
1.2.1 所有患者在入组IBS数据库时完成了以下资料的收集:(1)消化道症状评估:由研究者以面对面问卷调查方式填写IBS-D症状发作规律调查表。将患者肠道主要症状(腹痛/腹部不适的发生频率和程度、发作时排便次数、发作时粪便性状和排便后症状改善程度)分级并计分,计算出每例患者肠道症状计分[5],分值越高,患者肠道症状越重。(2)心理状态评估:由3名经过培训的研究者采用交谈和观察的方式对所有患者进行HAMA和HAMD测评。根据评分判定无焦虑/抑郁、轻度焦虑/抑郁和中重度焦虑/抑郁状态[13-14]。HAMA量表包括精神性焦虑和躯体性焦虑2个结构因子[13];HAMD量表包括焦虑/躯体化、认知障碍、迟滞、睡眠障碍和体质量5个结构因子[17]。
1.2.2 神经调节剂疗效评估:在入组IBS数据库的患者中,医师基于以下原则为患者处方神经调节剂(主要是抗焦虑剂和抗抑郁剂):(1)合并焦虑和(或)抑郁的患者;(2)腹痛/腹部不适和(或)腹泻症状较重,常规治疗效果不佳的患者;(3)患者理解并愿意接受神经调节剂治疗。
在本分析中,对接受神经调节剂治疗且疗程≥2周的IBS-D患者,以每例患者首次就诊时报告的情绪、睡眠、腹痛/腹部不适和腹泻4种症状严重程度为基线,均定为10分。采用视觉模拟评分方法对患者治疗后随访时4种症状相对于基线的改善程度(按病历原始记录)进行分级并计分:改善0分为无改善(症状同前),改善1~3分为轻度改善(症状仍非常明显,显著影响日常生活),改善4~7分为中度改善(症状明显,部分影响日常生活),改善8~10分为显著改善或完全缓解(症状轻微或恢复正常)。
将接受神经调节治疗后情绪、睡眠、腹痛/腹部不适和腹泻4种症状中任一症状有轻度改善的时间定为起效时间,此时神经调节剂剂量为起效剂量;治疗后4种症状均达到最佳改善程度,且神经调节剂剂量稳定(即至末次随诊时用药剂量无增加)的时间为最佳疗程,此时药物剂量为最佳剂量。

2 结果
2.1 临床资料在纳入IBS数据库且接受了HAMA、HAMD评估的410例IBS-D患者中,消化内科和/或心理科医师为116例(28.3%)处方了神经调节剂,且疗程≥2周,以下称为神经调节剂治疗组;男62例,女54例(男女比为1.15∶1);19例(16.4%)患者无随诊记录(无法确定是否遵嘱用药和疗效),归为失访。294例未处方神经调节剂的患者接受常规治疗,包括匹维溴铵、奥替溴铵、益生菌等,以下称为常规治疗组。
2.2 接受神经调节剂治疗的IBS-D患者临床表现特点神经调节剂治疗组和常规治疗组相比,男女比例、年龄和IBS病程差异均无统计学意义(P>0.05)。神经调节剂治疗组合并中重度焦虑、抑郁(包括轻度抑郁和中重度抑郁)比例均显著高于常规治疗组(见表1)。
神经调节剂治疗组肠道症状计分和常规治疗组比,差异无统计学意义(P>0.05),但排便前腹痛/腹部不适频率更高、排便后腹痛/腹部不适症状更难以改善(见表1)。在神经调节剂治疗组,无焦虑和/或抑郁的患者占25.9%(30/116),常规治疗组占37.1%(109/294);在无焦虑和/或抑郁的患者中,神经调节剂治疗组排便后腹痛/腹部不适症状更难以改善(t=-2.620,P=0.010)。
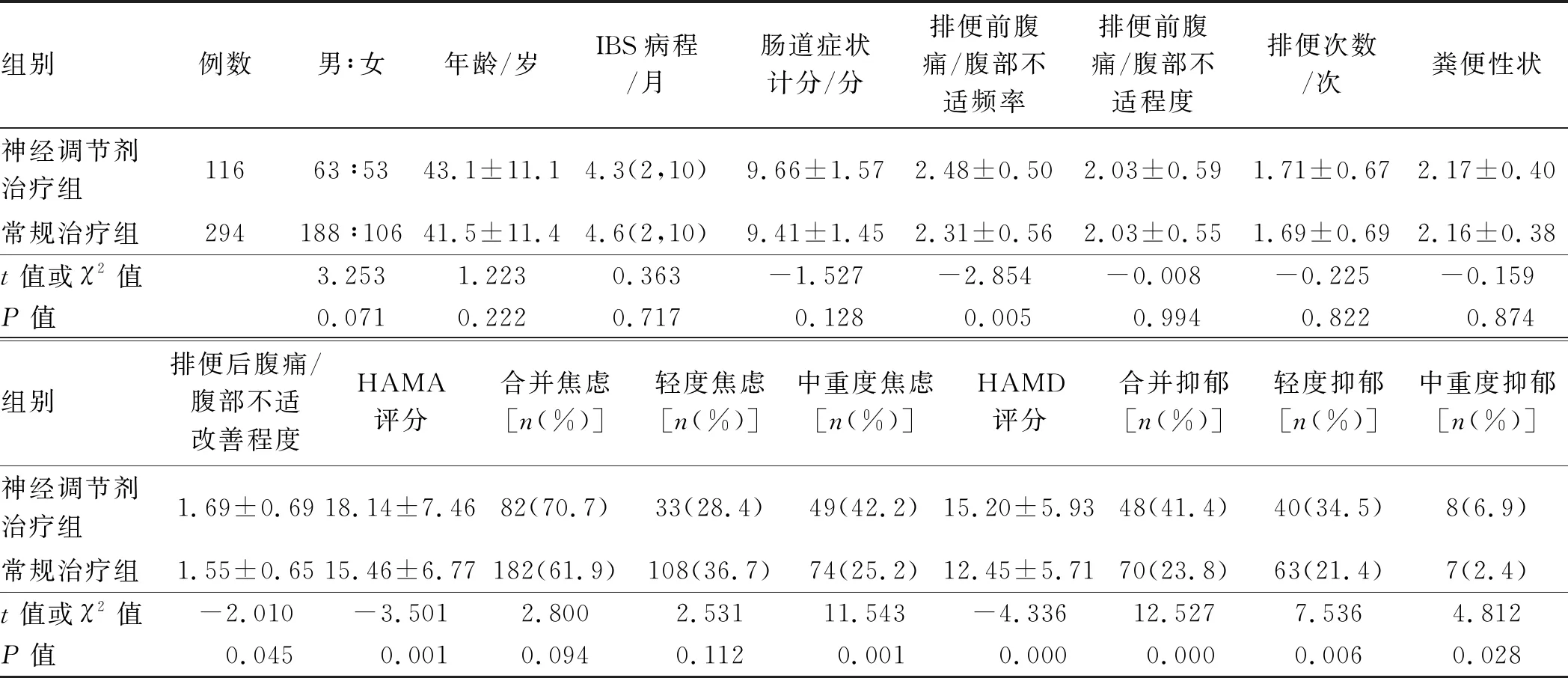
表1 IBS-D患者神经调节剂治疗组和常规治疗组临床资料比较Tab 1 Comparison of clinical data between neuromodulator treatment group and conventional treatment group in patients with IBS-D
2.3 IBS-D患者神经调节剂的选择和疗效在接受神经调节剂治疗,且随访资料完整的97例IBS-D患者中,有44例服用帕罗西汀、40例服用米氮平,共占78.4%(76/97);其他21例患者服用的药物有黛力新(10例)、盐酸舍曲林(4例)、艾司西酞普兰(5例)、文拉法辛(5例)和氟西汀(1例)。其中8例患者为联合用药,8例患者为序贯用药。
97例患者服用神经调节剂疗程为1~75个月,平均为4(2.0,9.3)个月,起效时间为(0.8±0.4)个月,最佳疗程为(3.5±2.8)个月。患者用药后情绪、腹痛/腹部不适、腹泻改善程度均与用药疗程呈正相关关系(r=0.344,P=0.001;r=0.322,P=0.001;r=0.381,P=0.000)(见图1)。97.9%(95/97)患者在用药2周至末次随诊过程中情绪、睡眠、腹痛/腹部不适和腹泻4种症状均有不同程度的改善,改善百分比分别为:89.1%(82/92)、89.3%(50/56)、86.6%(84/97)和90.7%(88/97),其中13.4%(13/97)患者所有症状均显著改善或完全缓解。有29例患者出现药物相关的不良反应,占29.9%(29/97),最常见不良反应有头晕、困倦、乏力及性欲减退。
2.3.1 帕罗西汀疗效及其与焦虑抑郁结构因子的关系:37例患者单用帕罗西汀治疗,剂量为20~40 mg/d,疗程为6.5(2,13.75)个月(1~41.5)个月;起效时间为(0.8±0.4)个月,起效剂量为(17.4±4.6)mg/d;最佳疗程为(4.3±3.3)个月,最佳剂量为(26.5±8.5)mg/d,45.9%(17/37)患者最佳剂量为20 mg/d。至末次随诊时,97.3%(36/37)患者情绪、睡眠、腹痛/腹部不适和腹泻4种症状均有不同程度的改善,显著改善的百分比分别为:61.8%(21/34)、57.1%(8/14)、64.9%(24/37)、43.2%(16/37);不良反应发生率为43.2%(16/37)。与症状未显著改善者相比,帕罗西汀治疗后情绪显著改善者基线认知障碍因子评分更低(t=-2.283,P=0.036),腹泻显著改善者基线精神性焦虑、迟滞因子评分更高(t=2.206,P=0.034;t=2.322,P=0.028)。
2.3.2 米氮平疗效及其与焦虑抑郁结构因子的关系:33例患者单用米氮平治疗,用药剂量为15~45 mg/d,用药疗程为3(2.5,6)个月(1~75)个月;起效时间为(0.8±0.4)个月,起效剂量为(14.8±7.1)mg/d;最佳疗程为(2.5±1.3)个月,最佳剂量为(23.9±21.1)mg/d,51.5%(17/33)患者最佳剂量为15 mg/d。至末次随诊时,所有(33/33)患者情绪、睡眠、腹痛/腹部不适和腹泻4种症状均有不同程度的改善,显著改善的百分比分别为:28.1%(9/32)、52.0%(13/25)、51.5%(17/33)、42.4%(14/33)。不良反应发生率为27.3%(9/33)。与症状未显著改善者相比,米氮平治疗后腹痛/腹部不适和腹泻显著改善者基线睡眠障碍因子评分均更高(t=2.881,P=0.008;t=3.179,P=0.003)。
2.3.3 单用帕罗西汀与单用米氮平患者心理状态比较:治疗前,单用米氮平的IBS-D患者HAMA、HAMD总分更高(P均<0.01),结构因子中精神性焦虑、躯体性焦虑、焦虑/躯体化、认知障碍、睡眠障碍、体质量因子评分更高(P均<0.05);治疗后,单用帕罗西汀者情绪显著改善比例高于单用米氮平者(P<0.01)(见表2)。
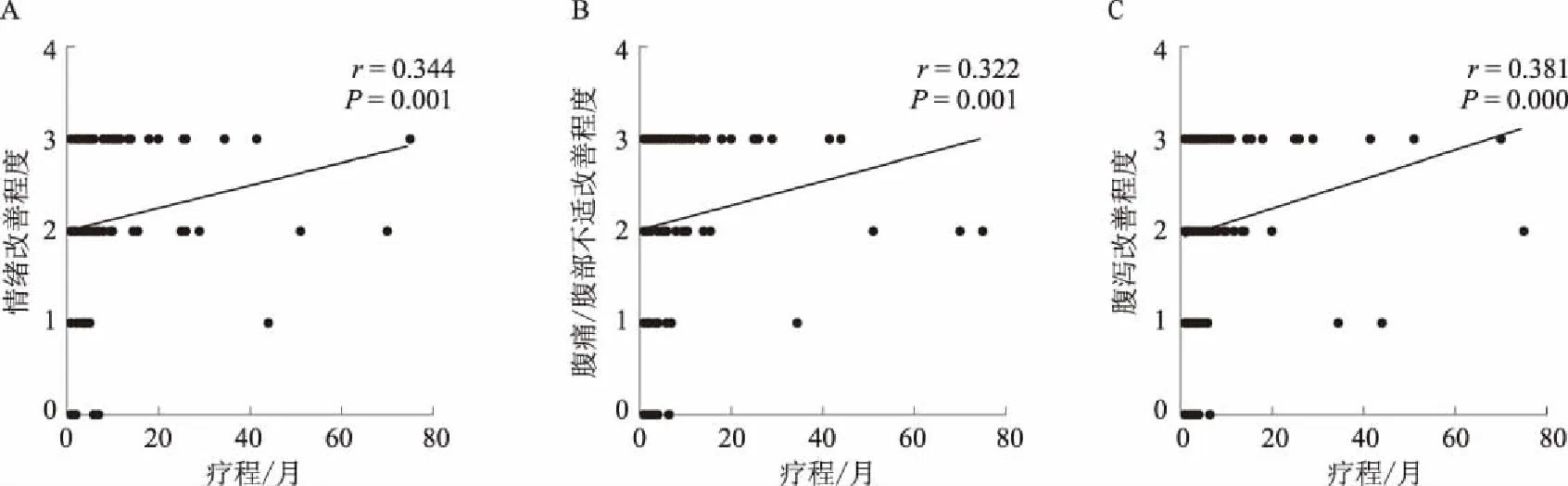
图1 97例IBS-D患者神经调节剂治疗疗程与用药后情绪、腹痛/腹部不适、腹泻改善程度的相关性分析Fig 1 Correlation analysis of neuromodulator treatment course and improvement of mood, abdominal pain/discomfort, diarrhea after treatment in 97 patients with IBS-D
表2 IBS-D患者单用帕罗西汀治疗组和单用米氮平治疗组治疗前心理状态和治疗后症状显著改善率比较
Tab 2 Baseline psychological status and significant improvement after Paroxetine and Mirtazapine therapy in IBS-D patients
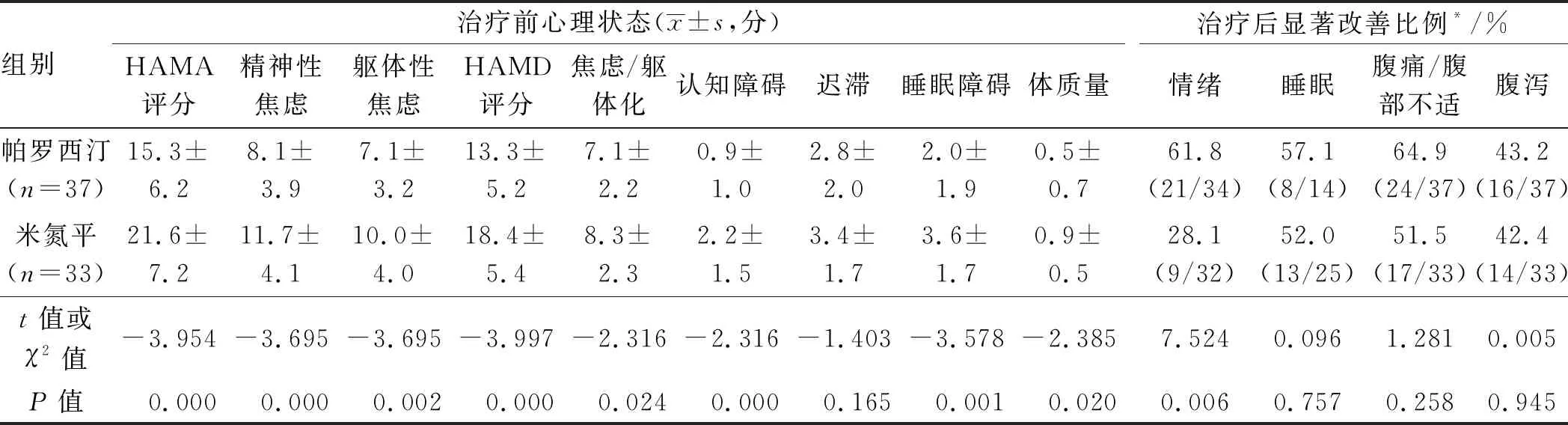
组别治疗前心理状态(x±s,分)HAMA评分精神性焦虑躯体性焦虑HAMD评分焦虑/躯体化认知障碍迟滞睡眠障碍体质量治疗后显著改善比例*/%情绪睡眠腹痛/腹部不适腹泻帕罗西汀(n=37)15.3±6.28.1±3.97.1±3.213.3±5.27.1±2.20.9±1.02.8±2.02.0±1.90.5±0.761.8(21/34)57.1(8/14)64.9(24/37)43.2(16/37)米氮平(n=33)21.6±7.211.7±4.110.0±4.018.4±5.48.3±2.32.2±1.53.4±1.73.6±1.70.9±0.528.1(9/32)52.0(13/25)51.5(17/33)42.4(14/33)t值或χ2值-3.954-3.695-3.695-3.997-2.316-2.316-1.403-3.578-2.3857.5240.0961.2810.005P值0.0000.0000.0020.0000.0240.0000.1650.0010.0200.0060.7570.2580.945
注:*:治疗后显著改善比例项括号中数据为显著改善的患者数占有此项障碍患者数。
3 讨论
本研究资料显示:临床医师为28.3%的IBS-D患者个体化处方了神经调节剂,绝大多数患者用药后情绪、睡眠、腹痛/腹部不适和腹泻4种症状有不同程度的改善,有效率显著高于文献报道的同类药物治疗IBS的随机对照临床研究(randomized controlled trial,RCT)[7-10],荟萃分析汇总有效率为50%~60%[7]。
既往研究多对比单一神经调节剂与安慰剂或常规药物治疗IBS的效果,本研究中心消化内科功能性胃肠病专病门诊医师和心理医学科专病医师根据患者肠道症状的特点和严重程度、心理和睡眠障碍,充分考虑各种药物的药效学特点选择神经调节剂,并在定期随诊中调整药物剂量,必要时采用联合用药或序贯用药,以期获得更满意的治疗效果。帕罗西汀属于5-羟色胺再摄取抑制剂(selective serotonin reuptake inhibitors,SSRIs),米氮平属于去甲肾上腺素能和特异性5-羟色胺能抗抑郁剂(noradrenergic and specific serotonergic antidepressant,NaSSA)。荟萃分析充分证明了SSRIs治疗IBS的有效性,与三环类抗抑郁药(tricyclic antidepressants,TCAs)相比,不良反应较少、安全性高,患者耐受性良好[7-8]。RCT研究中,SSRIs应用较多的为帕罗西汀、西酞普兰和氟西汀,其中帕罗西汀研究证据最为充分,证明了其对IBS患者腹痛、全身总体症状、合并精神心理异常和生活质量的有效改善[7-8]。HAMA结构因子中的精神性焦虑是焦虑的核心症状,研究发现,对于广泛性焦虑障碍(generalized anxiety disorder,GAD)患者,SSRIs对精神性焦虑的改善作用优于躯体性焦虑[18]。HAMD结构因子中的迟滞是抑郁的核心症状,是IBS-D患者生命质量下降的强预测因子,显著影响患者的社会功能和抗抑郁治疗效果[5,19]。本研究发现,IBS-D患者经帕罗西汀治疗后腹泻显著改善者基线精神性焦虑、迟滞因子评分较高,提示有明显精神性焦虑、迟滞表现的IBS-D患者选择帕罗西汀更有助于改善腹泻症状。米氮平治疗IBS的RCT研究较少,重性抑郁(major depressive disorder,MDD)的研究显示其起效快,能够显著改善食欲和睡眠[20]。睡眠障碍可促进IBS患者内脏高敏感,加重患者消化道症状的严重程度和频率[21]。本研究中IBS-D患者经米氮平治疗后腹痛/腹部不适和腹泻显著改善者基线睡眠障碍因子评分更高,与米氮平的药效学特点和临床经验一致[22]。另外,本研究发现,单用帕罗西汀者情绪显著改善比例高于单用米氮平者,提示帕罗西汀更有助于情绪的改善。以上研究结果提示,对IBS-D患者,有针对性选择神经调节剂能够显著提高疗效。
在已有的RCT研究中,神经调节剂用药剂量单一、用药疗程相对较短(4~12周)[6-8,23]。本研究中心采用从小剂量开始,根据患者症状改善和耐受情况调整用药剂量的原则,对出现不良反应如头晕、困倦、乏力但可耐受的患者,采用减小剂量、缓慢加量的策略,鼓励患者坚持用药,在最大程度上保证了用药疗程和疗效。多数SSRIs治疗IBS的RCT研究中,帕罗西汀用药剂量为20~40 mg/d[7-8,23],早期研究显示小剂量帕罗西汀(10 mg/d)对难治性IBS亦有效[24]。本研究资料证实,对多数IBS患者,小剂量神经调节剂即有效,因此尽可能采用最小有效剂量,以减少不良反应、提高用药依从性。本研究还发现,患者使用神经调节剂疗程差异大,起效时间为(0.8±0.41)个月,最佳疗程为(3.5±2.80)个月;患者用药后情绪、腹痛/腹部不适、腹泻改善程度与用药疗程均呈正相关,提示神经调节剂治疗需坚持至少3周始见疗效,且疗程>3个月才能达到最佳效果。目前对IBS患者的神经调节剂治疗疗程尚无共识意见,对于合并焦虑抑郁者,可参考抑郁症治疗原则[25],即抗抑郁药常在足量服用至少2~4周才见效,急性期治疗需6~8周;为了控制症状、防止复发,至少需巩固4~6个月;之后的维持期一般为6~8个月。
患者在初次使用神经调节剂治疗时会因药物增强体内5-HT、去甲肾上腺素或多巴胺能神经作用,出现口干、多汗、嗜睡、头晕、便秘等不良反应,是患者中断治疗的主要原因[8,23]。我们的体会是,从小剂量开始,1~2周内逐渐增加至目标剂量,可提高患者对药物的耐受性;治疗开始前充分沟通可能的不良反应,鼓励患者坚持用药,才能达到理想的治疗效果。
本研究表明,神经调节剂治疗对合并中重度焦虑或抑郁的IBS-D患者显著有效,对于排便前腹痛/腹部不适频率较高、排便后症状难以改善的难治性患者,即使未合并焦虑抑郁,加用神经调节剂亦能获得满意的治疗效果。目前尚缺乏神经调节剂治疗IBS指征的共识。对于合并GAD或MDD的难治性IBS患者,神经调节剂治疗比常规治疗效果更佳,其效果与心理评分下降相关[26-27]。在未合并焦虑抑郁的IBS患者,地西帕明亦显示出对中重度腹痛的良好治疗效果[10]。帕罗西汀能够有效改善存在重度腹痛或难治性IBS患者的腹痛症状和生活质量,尽管治疗后这部分患者心理量表的评分并无显著下降[28]。机制相关研究发现,帕罗西汀和阿米替林均能改善IBS患者的内脏高敏感[9,29],影响IBS患者的口盲肠转运时间[30];IBS模型大鼠结肠肌间神经元增加参与内脏高敏感形成,可能是神经调节剂影响内脏敏感性的机制之一[31]。以上研究结果提示,神经调节剂能够通过改善IBS患者的焦虑抑郁状态改善肠道症状;对于无焦虑抑郁的中重度症状或难治性IBS患者,亦可通过影响内脏敏感性和肠道动力改善患者的肠道症状。
本研究存在一定局限性:本研究为回顾性分析,研究中临床症状和治疗效果数据采集是对临床原始记录资料的分级计分;神经调节剂的选择是消化内科功能性胃肠病专病医师和心理科消化专病医师为患者选择的个体化治疗方案,对药物的种类、剂量、疗程、是否联合用药未做统一规定,多数患者在消化内科和心理科联合随诊;神经调节剂治疗组大部分患者为常规治疗无效后启动神经调节剂治疗,对少数患者为提高神经调节剂治疗的依从性,在启动治疗时医师处方了对症药物(主要是解痉剂),供短期使用或按需使用,本分析中未收集这部分数据。这组“真实世界”资料的总结分析结果对临床医师优化神经调节剂治疗IBS-D具有一定的参考价值。
综上所述,对合并中重度焦虑、抑郁或肠道症状较重的难治性IBS-D患者,可针对性选择神经调节剂。帕罗西汀和米氮平均能有效改善IBS-D患者的情绪和肠道症状,有明显精神性焦虑、迟滞表现且腹泻严重的IBS-D患者宜选择帕罗西汀,有明显睡眠障碍的患者宜选择米氮平治疗。神经调节剂治疗从小剂量开始,缓慢加量至目标剂量,达到巩固和维持用药疗程,能够获得满意的治疗效果。

