miR-497-5p靶向调控ENAH表达抑制肝癌细胞运动及EMT
慕刚刚, 于红刚, 李红艳
武汉大学人民医院消化内科,湖北 武汉 430060
肝癌是我国第四大恶性肿瘤,发病率和死亡率居高不下,肝癌早期发现困难,预后情况不容乐观,目前5年生存率只有10.1%[1-2]。对于肝癌发生的机制研究、靶向治疗分子的研究仍是目前研究的重点。
ENAH(Enabled homolog)是Ena/VASP蛋白家族一员,Ena/VASP调控细胞侵袭和转移过程中的形态改变、细胞黏附等[3],而ENAH主要作用于肌动蛋白的调控,参与肿瘤侵袭转移中癌细胞运动、细胞间黏附。ENAH在多种肿瘤中表达上调,如结直肠癌[4]、肝细胞癌[5]、宫颈癌[6]、胃癌及胰腺癌[7]等,且ENAH的过表达与肿瘤高侵袭性、恶性预后明显相关。ENAH是多个肿瘤信号通路的关键靶基因,如Wnt/β-catenin信号通路轴、PPARγ信号轴[8]。
上皮细胞-间充质转化(epithelial-mesenchymal transition,EMT)是肿瘤细胞高侵袭、转移的关键调控,可使肿瘤细胞减少细胞间黏附,以及获得更高的间质迁移能力,在肝癌的侵袭、转移、化疗耐药方面是关键调控。虽然ENAH在其他肿瘤中的作用得到关注,但在肝癌中的研究目前仍匮乏,特别是与肿瘤侵袭、转移密切相关的EMT作用机制缺乏。
微小RNA(miRNA)是一类保守的内源性非编码RNA,长度多为19~25个核苷酸,主要与靶基因mRNA的3′非编码区碱基互补配对并影响mRNA的稳定性和翻译。miRNA参与细胞的分化、增殖和凋亡等,而且在肿瘤的发生、进展调控中起关键作用,如调控肿瘤细胞骨架重排、细胞侵袭、血管生成。通过转染治疗性miRNA,阻断肿瘤细胞增殖、侵袭等信号通路,从而达到治疗肿瘤的目的。
本研究利用Oncomine、TCGA、Human Protein Atlas等在线肿瘤样本数据库,对肝癌中ENAH基因、蛋白表达差异进行分析,并研究miR-497-5p对ENAH的调控,及在肝癌侵袭、转移及EMT过程中的发生机制。
1 材料与方法
1.1 材料收集2018年1月至2019年1月武汉大学人民医院肝癌手术切除标本30例(癌组织、癌旁组织),提取组织RNA、蛋白进行后续研究。本研究通过武汉大学人民医院伦理委员会的批准。
1.2 细胞及试剂人肝癌细胞系HepG2购自中国科学院典型培养物保藏委员会细胞库,细胞培养在DMEM培养基(质量浓度为100 g/L小牛血清),37 ℃细胞培养箱。抗体:ENAH、β-cadherin、Sail、GAPDH购自Santa Cruz公司。Trizol reagent(Invitrogen,美国)、TaqMan Advanced miRNA cDNA Synthesis Kit(A28007)、TaqMan Fast Advanced Master Mix(4444556)(Applied Biosystems,美国)。miR-497-5p inhibitor和mimics通过生工生物合成。
1.3 Oncomine数据库癌症基因芯片数据库和整合数据挖掘平台,是通过对已发表的大样本临床肿瘤标本基因信息进行分析,可用于筛选肿瘤与正常组织间、肿瘤不同亚型间等的差异基因,以及肿瘤化疗药物敏感性、临床表型的差异基因、突变基因分析。本研究搜索设置:Analysis Type:Liver cancervsNormal Analysis;Data Type:mRNA;设定条件:over-expression。从Oncomine数据库筛选基因为ENAH后,设定条件为:Gene: ENAH。
1.4 Human Protein Atlas数据库人类蛋白表达图谱是通过对组织切片和细胞系的免疫组化染色,可进行肿瘤组织蛋白差异表达分析。本研究中,对ENAH蛋白在人肝癌组织中免疫组化结果进行分析。
1.5 String-DB数据库生物基因和蛋白相互作用分析的检索平台,大数据分析可预测的蛋白-蛋白相互作用生物数据库。设定分析条件:ENAH;Homo sapiens;medium confidence(0.400);max number of interactors to show:no more than 25 interactions,分析ENAH相关蛋白作用网络图、与ENAH共表达的蛋白列表,并进行GO分析。
1.6 免疫印迹将提取的新鲜临床肝癌组织、癌旁肝组织标本生理盐水反复清洗,经剪碎、研磨,裂解液充分裂解组织,并离心提取总蛋白,细胞经蛋白裂解提取试剂盒提取总蛋白。BCA法测定总蛋白浓度,取20 g总蛋白经SDS-PAGE电泳分离,再经电转移蛋白至PVDF膜,质量浓度为100 g/L BSA溶液封闭后用一抗4 ℃孵育12 h,通过HRP标记的抗体在室温孵育1 h,TBST液漂洗后经ECL法显色,X线胶片曝光。
1.7 RNA提取及测定肝癌及癌旁组织的收集:肝癌及癌旁组织术后离体后30 min内通过液氮保存,-80 ℃保存备用。提取样本组织进行超声匀浆,采用Trizol RNA提取试剂盒(12183555,Thermo Fisher公司),提取样本总RNA,DEPC水溶解,测定RNA纯度和浓度,并取1 μl RNA经凝胶电泳测定完整性,进行RNA纯化及后续RT-PCR。
1.8 qRT-PCR反应依据相关试剂盒说明书进行,采用Primer premier 6.0 软件设计引物,hsa-miR-497-5p引物:正向5′-CCTTCAGCAGCACACTGTGG-3′;反向5′-CAGTGCAGGGTCCGAGGTAT-3′;内参U6引物:正向5′-TCCCGCGGTCATCAGCA-3′,反向5′-CAAGCTATCACGTATGGTTC-3′。逆转录反应体系为:RNA 2 μl,引物 1 μl,dNTP mix 1 μl, U6 逆转录引物 1 μl,逆转录酶1 μl,RNA酶抑制剂0.5 μl,无酶水9.5 μl,设定条件:16 ℃ 15 min,42 ℃ 60 min,85 ℃ 5 min,4 ℃ 5 min。qRT-PCR采用SYBR法测定miR-497-5p的Ct值,U6为内参照,反应体系为:混合物(25 μl): 引物2 μl,ddH2O 8.5 μl,SYBR 12.5 μl,cDNA 2 μl,条件:95 ℃ 30 s,1个循环,95 ℃ 5 s,60 ℃ 30 s,40个循环。
1.9 Transwell侵袭实验采用插入式细胞培养器(Thermo ScientificTMNuncTM,140656),细胞经miR-497-5p inhibitor和mimics进行干预,取对数生长期细胞制备1×105个/ml浓度单细胞混悬液,向预铺BD基质胶的Transwell培养小室上室加入100 μl混悬液,并加入100 μl DMEM培养基,并将小室置入质量浓度为50 g/L胎牛血清的DMEM培养孔中。在培养箱中培养24 h,去掉上小室内DMEM,小室经4%多聚甲醛固定,结晶紫染色,倒置显微镜观察拍照并计算随机视野下穿透小室细胞的数目。
1.10 划痕实验细胞经miR-497-5p inhibitor和miR-497-5p mimics进行干预,取对数生长期细胞制备单细胞混悬液,在6孔板内加入1×105个/ml浓度细胞100 μl并添加1 ml DMEM培养基,培养细胞24 h形成致密单层细胞,并用10 μl的试剂枪头进行划痕处理。经低血清培养基培养24 h后显微镜下拍照、测量。
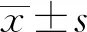
2 结果
2.1 Oncomine数据库分析肝癌中显著过表达差异基因通过设定筛选条件“Analysis Type:Liver cancervsNormal Analysis;Data Type:mRNA;设定条件:over-expression”。共有5个数据库[9-12]满足筛选。通过对比分析肝癌与正常肝组织的过表达差异基因,结合已发表文献,我们发现ENAH基因在肝癌中明显过表达(见图1)。
进一步在Oncomine数据库中设定ENAH基因为关键,筛选条件为“Gene:ENAH;Analysis Type:Liver cancervsNormal Analysis;Data Type:mRNA”。筛选肝癌样本中ENAH的具体表达情况,ENAH mRNA明显过表达差异数据集5个。我们发现ENAH mRNA在5个数据集中肝癌组织较正常肝组织有显著过表达:Chen liver (197,P=2.26E-25,fold change=2.297)、Roessler liver(43,P=3.06E-12,fold change=4.656)、Roessler liver 2(445,P=2.67E-81,fold change=3.866)、Wurmbach liver(75,P=6.23E-8,fold change=3.678)、Mas liver (115,P=2.67E-8,fold change=2.175)。对上述数据进行Meta对比分析,也证明ENAH mRNA在肝癌组织中较正常组织显著过表达:P=3.11E-8(见图1)。
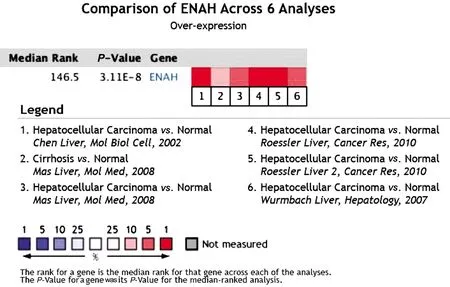
图1 Oncomine数据库中ENAH mRNA在肝癌数据中差异表达Meta分析Fig 1 Meta-analysis of ENAH mRNA in liver cancer by Oncomine database
2.2 Human Protein Altas数据库在线分析ENAH在肝癌组织中病理表达通过Human Protein Altas数据库,采用ENAH蛋白免疫组化抗体(HPA028696)行染色分析肝癌组织与正常肝组织的表达差异,大部分肝细胞癌、胆管细胞癌组织中ENAH表达呈现中、高等强度,正常肝组织未见明显表达染色。染色发现ENAH在肝癌细胞内主要分布在细胞质、细胞膜,这与ENAH主要调控细胞运动相关的肌红蛋白有关。进一步提取肝癌组织、癌旁组织总蛋白,通过免疫印迹方法我们发现ENAH蛋白在肝细胞癌、胆管细胞癌组织中呈现明显高表达,显著高于癌旁的正常肝脏组织(见图2)。
2.3 ENAH在肝纤维化组织中高表达肝纤维化是肝脏对各种损伤的病理改变修复, 持久、严重的损伤可导致肝细胞受损、正常肝小叶结构破坏、大量纤维疤痕形成,肝纤维化是肝癌的重要发病基础。在Onocomine数据库中设定筛选条件为“Gene:ENAH;Analysis Type:Liver cirrhosisvsNormal Analysis;Data Type:mRNA”,得到Wurmbach liver和Mas liver 两个肝纤维化标本数据库。对比分析肝纤维化标本与正常肝组织中ENAH mRNA表达,我们发现肝纤维化组织中ENAH mRNA表达明显升高(P<0.05),表明ENAH可能参与肝纤维化的发生调控(见图3)。
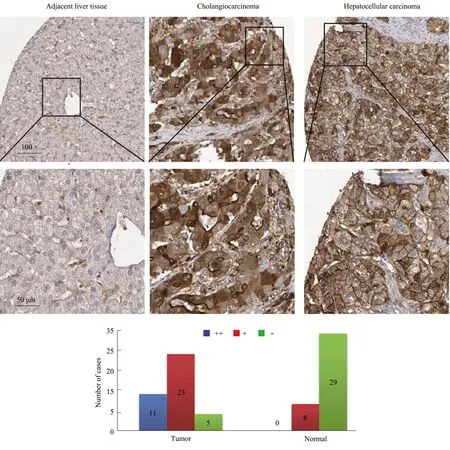
注:ENAH蛋白在肝细胞癌、胆管细胞癌、正常肝组织中的表达(免疫组化染色),并对免疫组化染色ENAH表达强度进行分析。
图2 Human Protein Atlas数据库中ENAH在肝癌组织及正常肝组织中表达分析
Fig 2 ENAH protein over-expressed in liver cancer tissues compared with normal liver tissues by Human Protein Atlas database
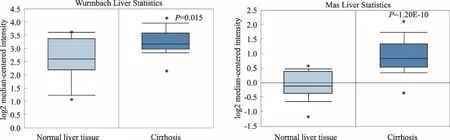
图3 Oncomine数据库分析ENAH高表达与肝纤维化相关Fig 3 The over-expression of ENAH correlated with liver fibrosis by Oncomine database
2.4 String-DB数据库分析ENAH蛋白相互作用网络String-DB通过已有基因、蛋白作用信息,可提供特定蛋白的信号调控网络。在String-DB数据库中设定筛选条件:Gene:ENAH;Organisms:Homo sapiens;minimum required interaction score:medium confidence(0.400);max number of interactors to show:no more than 25 interactors;Clustering method:kmeans clustering。检索分析得到ENAH蛋白相互网络,并进行功能聚类分析,蛋白网络图显示与ENAH有较密切关联的蛋白分布,依据不同功能区分。我们可以发现ENAH相互作用最紧密的如VASP、ABL1、ROBO1、VCL、CTNND1/CTNNA1/CTNNB1、ROCK1、CDC42、CDH1等,这些蛋白均与细胞侵袭、转移行为相关,具体包括细胞间黏附、黏着斑形成、细胞骨架极化、细胞骨架蛋白的定向改变等。这表明ENAH主要在肝癌细胞侵袭、转移中发挥作用。
进一步分析ENAH蛋白与其密切相关的蛋白的共表达情况。通过共表达分析,可见与ENAH共表达最密切的是PFN2、ROBO1、CTNND1、SLIT2、CTNNA1蛋白(见图4),这些蛋白均在细胞骨架极化、黏着斑形成、细胞间信号传导,这些均是肿瘤细胞高侵袭性的关键。
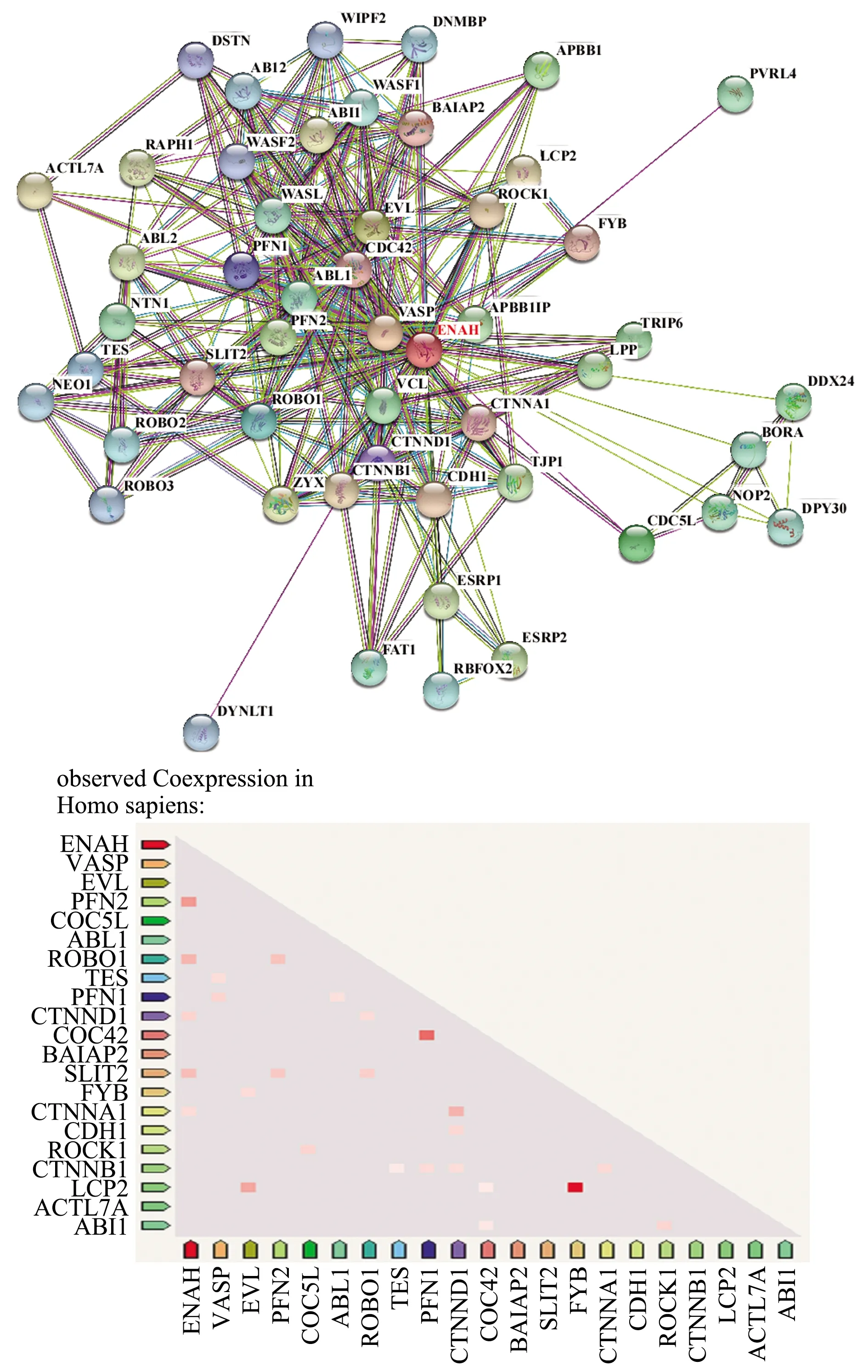
图4 String-DB数据库分析与ENAH蛋白表达 相关蛋白网络图、共表达分析Fig 4 The analysis of ENAH protein associated co-expression protein interaction networks by String-DB database
2.5 has-miR-497-5p调控ENAH的表达通过生物信息软件Targetscan 7.2预测ENAH基因的上游调控miRNA为has-miR-497-5p。通过提取新鲜肝癌组织、癌旁组织的RNA,RT-PCR测定has-miR-497-5p的表达。肝癌组织hsa-miR-497-5p的丰度低于癌旁肝脏组织,而对应的ENAH 呈现高表达趋势。肝癌细胞HepG2中给予has-miR-497-5p inhibitor和mimics进行处理,可见has-miR-497-5p inhibitor抑制了HepG2细胞的hsa-miR-497-5p的表达,而ENAH表达上调;而has-miR-497-5p mimics增强了hsa-miR-497-5p的表达,对应的ENAH表达受到抑制。
2.6 has-miR-497-5p通过ENAH抑制肝癌EMT、细胞极化在has-miR-497-5p mimics干预下,HepG2细胞的EMT相关标志物发生明显EMT倾向性改变,与对照组相比,has-miR-497-5p mimics抑制ENAH的表达,继而抑制β-catenin、Snail的表达,上调E-cadherin、Claudin-1蛋白表达(见图5),表明has-miR-497-5p mimics干预后HepG2细胞有发生EMT的可能。
进一步分析HepG2细胞侵袭运动相关的细胞极化及黏着斑改变,通过F-actin及FAK荧光染色分别标志细胞骨架蛋白、黏着斑形成。与对照组细胞比较,在has-miR-497-5p mimics干预后HepG2细胞表现出更加明显的侵袭、转移特性:细胞骨架、F-actin发生明显的极化改变,黏着斑呈现显著运动端胞膜聚集、黏着斑与F-actin在引导端耦合,上述结果表明has-miR-497-5p参与HepG2细胞的EMT、侵袭运动。
3 讨论
ENAH是Ena/VASP复合物(Enabled/vasodilator-stimulated phosphoprotein)一员,它可结合VASP、EVL蛋白构建肌动蛋白调控组,对抗肌动蛋白的加帽蛋白、捆绑肌动蛋白丝及丝状伪足的延伸[13]。ENAH通过Ena/VASP同源结构域定位于细胞运动引导端、黏着斑及伪足。在高侵袭性肿瘤细胞中,侵袭性伪足的形成、细胞外基质的降解均是细胞侵袭运动的关键,伪足形成及成熟受多种促生长因子的激活,主要包括EGF、Integrin信号通路轴。而ENAH通过偶联integrin α5亚基的胞质C末端,在成纤维细胞中调控细胞内、外的黏着斑复合物信号传导,最终促进细胞侵袭运动,另外ENAH过表达能够增加肿瘤细胞对EGF的敏感性、诱导细胞外基质(ECM)降解,进而促进肿瘤细胞侵袭、转移[14-15]。我们通过Oncomine在线数据库分析,发现ENAH在多种肿瘤中呈现明显高表达,而且与肿瘤侵袭特性EMT、肝纤维化明显相关。
Hu等[16]研究也证实ENAH在肝癌中呈现高表达,与肿瘤的分化、进展、预后明显相关,本研究也发现ENAH在肝细胞癌、胆管细胞癌中明显升高,而且与肿瘤EMT、肝纤维化明显相关。肝纤维化是继发于多种肝炎、肝脏慢性损伤的病理修复,主要表现为ECM的过度产生及沉淀,肝星状细胞(HSC)是其中主要参与者,在肝纤维化发生时HSC被激活并转变为肌成纤维细胞,HSC产生的大量如胶原、糖蛋白和蛋白聚糖等促纤维化的ECM蛋白,破坏肝脏结构,导致严重肝硬化。α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)是肌成纤维样细胞的主要特征之一,肝脏受到促纤维化因子刺激,活化的HSC会丢失维生素A并表达α-SMA,我们通过Oncomine、临床标本发现ENAH在肝纤维化中明显高表达,敲低ENAH后肝α-SMA有所下降,提示我们ENAH可能是肝纤维化调控的重要蛋白,有效阻断ENAH可能阻断、逆转肝纤维化的进展,这在其他研究中尚未提及。
图5 miR-497-5p抑制肝癌HepG2细胞ENAH表达、细胞运动、侵袭 A:RT-PCR测定肝癌组织(n=30)、癌旁正常肝组织(n=30)中miR-497-5p水平;B:miR-497-5p抑制HepG2细胞ENAH蛋白表达;C:miR-497-5p抑制HepG2细胞EMT;D~E:划痕实验验证miR-497-5p抑制HepG2细胞侵袭(放大40倍);F~G:Transwell实验验证miR-497-5p抑制HepG2细胞运动(放大100倍)
Fig 5 miR-497-5p inhibited ENAH expression, cell movement and invasion in liver cancer HepG2 cells A: RT-PCR assay for miR-497-5p levels in liver cancer and normal liver tissues; B: miR-497-5p inhibited ENAH expression in HepG2 cells; C: miR-497-5p suppressed HepG2 cell EMT; D-E: Scratch test verified that miR-497-5p inhibited HepG2 cell invasion; F-G: Transwell test indicated that miR-497-5p inhibited HepG2 cells invasion and motility
EMT是肿瘤细胞丧失细胞间的连接,转化为具有游走能力的间叶细胞,在肿瘤的侵袭、转移、化疗耐药性方面起关键的调控。EMT涉及一些上皮标志物的丢失,比如紧密连接蛋白、闭锁蛋白、E-钙黏蛋白、α及β-连环蛋白及细胞角蛋白等,同时伴随大量间质标志物蛋白的升高,如N-钙黏蛋白、波形蛋白、基质金属蛋白酶、整合素αvβ1、平滑肌肌动蛋白等。在肿瘤细胞中,EMT可被大量细胞因子和生长因子刺激,例如HGF、EGF、FGF2、IGF,它们的调控涉及一系列信号传导通路,如MAPK、PI3K、Wnt/β-catenin、Notch[17]。另外,EMT过程中多转录因子的高表达,如Snail-1/2、Zeb-1/2、Twist等,它们主要形成抑制复合物,与E-钙黏蛋白基因启动子结合,并阻断E-钙黏蛋白的转录表达[17]。本研究中我们发现ENAH受到抑制后,肝癌细胞的EMT受到抑制,相对的E-钙黏蛋白表达升高、Vimentin和Fibronetin蛋白表达抑制。有研究认为ENAH通过激活MAPK(ERK1/2)-Akt,NF-κB通路可促进肿瘤的增殖、转移,在结直肠癌、乳腺癌的研究中,也发现ENAH参与Wnt/β-catenin通路、Notch信号的转录调控,可能促进EMT的发生[18-19]。本研究中,ENAH可能通过调控Wnt/β-catenin等参与肝癌的EMT。
miR-497-5p是位于染色体17p13.1的miRNA,属于miR-15/16/195/424/497簇中的一员,其5′端包含高度保守的AGCAGC序列。文献报道,P53基因上调该家族miRNAs的表达,而启动子甲基化、MYC可引起它们的下调,在细胞分裂、血管生成、代谢等生物学功能中发挥非常重要的作用。研究发现,miR-497-5p在多种疾病的进展中发挥调控作用,包括冠状动脉疾病、特发性肺纤维化,以及恶性肿瘤,如结直肠癌、血管肉瘤、子宫内膜癌、HPV感染后宫颈癌等,miR-497发挥重要的抑癌基因的作用[20-23]。Li等[24]研究显示,miR-497/195表达与乳腺癌预后明显相关,乳腺癌细胞miR-497通过靶向调控Raf-1和Ccnd1的表达抑制癌细胞增殖和侵袭,而非小细胞肺癌中miR-497通过HDGF调控细胞集落形成、增殖[25]。另有研究证实,miR-497在卵巢癌及SKOV3细胞中低表达,过表达miR-497后可抑制PXN2蛋白表达,进而促进癌细胞凋亡、抑制肿瘤侵袭等。
本研究中,我们发现肝癌组织中has-miR-497-5p低表达,并抑制ENAH的表达,抑制肿瘤细胞HepG2的EMT、运动等。has-miR-497-5p-ENAH-EMT信号调控轴是研究肝癌细胞运动的新思路,ENAH及has-miR-497-5p可作为肝癌临床转移风险预后的参考指标。

