晚期肝细胞癌患者HBsAg水平与预后的关系
赵 涵,陈 铿,李凌华,张 影,李平红,刘惠媛,唐小平
广州市第八人民医院感染病中心,广东 广州 510060
肝细胞癌(hepatocellular carcinoma,HCC)是全球第六大最常见的癌症,其复发率高,预后差[1-3]。慢性乙型肝炎病毒(HBV)感染是亚洲乙型肝炎患者发生HCC的主要原因。目前HCC的治疗以手术切除为主,但由于患者多处于晚期,适合手术切除的患者较少。因此,放疗、靶向治疗、经动脉栓塞(TAE)、经动脉化疗栓塞(TACE)、生物治疗等姑息治疗方式是治疗不可切除肿瘤的有效手段[4-5]。在我院,近几十年来TACE已成为HCC患者的主要治疗手段。尽管HCC患者的治疗取得了一些进展,但患者的总体生存率仍然很低。
许多研究表明,HBV在肝癌行TACE治疗的患者中可能发生活化[6-7],因此,亚太肝病研究协会建议所有接受TACE治疗的肝癌患者均应接受预防性抗病毒治疗[8]。然而,这种策略往往是繁重和昂贵的,由于中国大多数肝癌患者的经济状况较差,先发制人的抗病毒治疗往往用于血清乙肝病毒脱氧核糖核酸(HBV DNA)水平>20 IU/ml的患者。因此,在这些HBV DNA检测不出的患者中,确定预测HBV再活化的因素仍是必要的。
近年来,乙型肝炎表面抗原(HBsAg)的定量越来越被认为是评估病毒复制的一种标志物,并可作为HCC的预后指标[9-12]。因此,本回顾性研究旨在探讨HBV DNA检测不出的晚期HCC患者中,HBsAg水平是否与总生存期(OS)和TACE后HBV的再活化有关。我们目前的研究发现,在低HBV载量的患者中高HBsAg和无抗病毒治疗是TACE后HBV再活化的危险因素,接受抗HBV治疗的患者血清HBsAg水平较低。
1 资料与方法
1.1 研究对象我们对2013年12月至2018年12月在广州市第八人民医院登记的216例HBV相关HCC患者进行了连续系列调查。HCC的诊断和分期根据中国2011年出版的原发性肝癌诊疗规范和巴塞罗那临床肝癌(Barcelona Clinic Liver Cancer,BCLC)分期规范系统确定[13-14]。
1.2 HBsAg、HBV DNA生化、血清学标志物及定量分析使用常规自动化分析仪进行生化测试。HBV和其他血清学标志物的检测采用chemilumines centase免疫分析法(雅培实验室,芝加哥,伊利诺伊州,美国)。采用商业试剂盒检测血清丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)和白蛋白(ALB)水平。男性和女性ALT和AST的ULN分别为40 U/L和37 U/L。HBsAg采用Architect HBsAg分析。采用内部标准法测定HBV DNA水平,定量分析,检测限较低,为20 IU/ml(罗氏,巴塞尔,瑞士)。
1.3 相关定义和随访血清HBV DNA水平较TACE启动前(1~2个月)升高20 IU/ml以上被定义为HBV再活化[12]。有抗病毒病史的患者继续服用原来的抗病毒药物。对于无抗病毒病史的患者,在确定HBV重新激活后,给予抗病毒治疗。
如果在计算机断层扫描(CT)中发现任何存活的肿瘤,则每4~8周进行一次TACE手术(按照原发性肝癌诊断标准进行),除非发生肝外病变。每隔4~6周,对可能有活动性肿瘤病变的患者进行一次CT或磁共振造影(MRI)扫描。在TACE治疗前会测定血清HBV DNA水平,TACE治疗后随访1~2个月。
前2年每3个月随访1次,第2年至第5年每6个月随访1次,共随访5年或直至患者死亡,有3例患者失访。OS定义为自第一次TACE开始至患者死亡的时间,所有患者均通过电话联系,更新健康状况,最后随访日期为2018年12月1日。
1.4 统计学分析采用SPSS 19.0软件(SPSS Inc.,Chicago,IL,USA)进行统计分析。采用χ2检验计算HCC患者临床特征与血清HBsAg水平之间的关系,并以对照表形式显示。生存曲线采用Kaplan-Meier法绘制,Log-rank检验比较。采用Cox比例危险分析法进行单因素和多因素分析,探讨临床病理变量、血清HBsAg水平和HBV活化对生存的影响。采用Spearman相关系数分析评价血清HBsAg水平与HBV活化及抗HBV治疗的相关性[15]。所有P值均为双侧,P<0.05为差异有统计学意义。
2 结果
2.1 临床特征对216例HBV DNA阴性的晚期HCC患者进行连续评估,纳入研究。216例患者的生化、病毒学和人口学资料如表1所示。入组患者年龄23~76岁,平均年龄49岁。男202例(93.5%),女14例(6.5%)。中位随访时间为13个月(5~50个月)。47.2%患者的血型是AB型。216例患者中,60例(27.8%)HBeAg阳性,171例(79.2%)有肝硬化,149例(69.0%)ALT水平≥41 U/L,40例(18.5%)HBV DNA激活(TACE后)和74例(34.3%)血清HBsAg含量≥1 500 IU/ml。216例患者中,101例(46.8%)在诊断为HCC后给予预防性抗病毒治疗。

表1 216例HCC患者的基本资料Tab 1 Clinical characteristics of 216 patients with HCC
续表1

指标例数(%)HBeAg 阴性156(72.2) 阳性60(27.8)HBsAg水平 ≤500 IU/ml62(28.7) 501~999 IU/ml49(22.7) 1000~1499 IU/ml31(14.3) ≥1500 IU/ml74(34.3)在TACE治疗后病毒活化(1~2个月) 是40(18.5) 否176(81.5)ALT ≥41 U/L149(69.0) <41 U/L67(31.0)AST ≥37 U/L159(73.6) <37 U/L57(26.4)TBIL ≥19 μmol/L62(28.7) <19 μmol/L154(71.3)GGT ≥50 U/L146(67.6) <50 U/L70(32.4)ALB ≥34 g/L152(70.4) <34 g/L64(29.6)WBC ≥4×109 L-1119(55.1) <4×109 L-197(44.9)Clild-Pugh评分 A级153(70.8) B级63(29.2)AFP ≥400 μg/L140(64.8) <400 μg/L76(35.2)肿瘤大小 ≤10 cm173(80.1) >10 cm43(19.9)肿瘤个数 单个188(87.0) 多个28(13.0)TACE次数 2次92(42.6) 3~4次92(42.6) 4~7次32(14.8)
2.2 血清HBsAg水平与抗病毒治疗、TACE(1~2个月)后病毒的活化、ALT水平显著相关血清HBsAg水平、临床变量与各风险生存时间的关系如表2所示。血清HBsAg水平与抗病毒药物治疗(P<0.001)、TACE(1~2个月)后病毒活化(P<0.001)和ALT水平(P=0.028)显著相关。性别、血小板(PLT)、白细胞(WBC)计数、总胆红素(TBIL)、谷氨酰胺酶(GGT)、白蛋白(ALB)、HBeAg、肝硬化及所有肿瘤相关特征两组间差异均无统计学意义(P>0.05)。
2.3 抗病毒治疗与HBV的活化和血清HBsAg水平相关随着血清HBsAg水平的下降,HBV再活化的发生率降低,结果表明,抗病毒药物的治疗与HBV再活化相关(r=0.327,P<0.001)。接受抗病毒治疗的患者与未接受抗病毒治疗的患者相比,HBV再活化降低(5%vs30.4%,P<0.001)。
然而,我们也观察到血清HBsAg水平与抗病毒治疗之间的关系(r=0.429,P<0.001)。与未接受抗病毒治疗的患者相比,接受抗病毒治疗的患者血清HBsAg水平较低(74.3%vs31.3%,P<0.001)。此外,随着血清HBsAg水平的下降,HBV再活化发生率呈显著下降趋势(r=0.252,P<0.001)。
2.4 HBsAg水平越高OS越短TACE周期和血清HBsAg水平是独立的预后因素:应用Kaplan-Meier分析和Log-rank检验计算临床病理特征的影响。与HBsAg水平高的HCC患者相比,HBsAg水平低的HCC患者OS更长(P<0.001)。总体中位生存期为12.5个月,而HBsAg水平高的患者生存期为9个月。整个队列在1年和2年的总生存率分别为52.8%和18.1%。HBsAg水平高的HCC患者的1年和2年累积生存率分别为35.2%和14.3%,而HBsAg水平低的HCC患者的1年和2年累积生存率分别为69.4%和21.6%。我们还评估了ALT水平、TACE循环的预后价值。结果表明,ALT水平越高,TACE周期越少,OS越短(P=0.020,P<0.001)。
我们进一步研究了亚组内HBsAg水平,发现HBsAg水平对预后的影响仍然存在。在抗病毒治疗组和未接受抗病毒治疗组中,比较高HBsAg水平患者与低HBsAg水平患者的生存率。Kaplan-Meier分析显示总体生存率差异有统计学意义(P<0.001,P=0.021)(见图1)。
单因素分析表明,肝硬化(P=0.006)、抗病毒治疗(P<0.001)、HBV再活化(P=0.011)、ALT(P=0.037)、TACE周期(P<0.001)、血清HBsAg水平(P<0.001)与HCC患者的OS显著相关。此外,通过多变量Cox回归分析,TACE周期(P<0.001)、血清HBsAg水平(P=0.002)是独立的预后因素(见表3)。
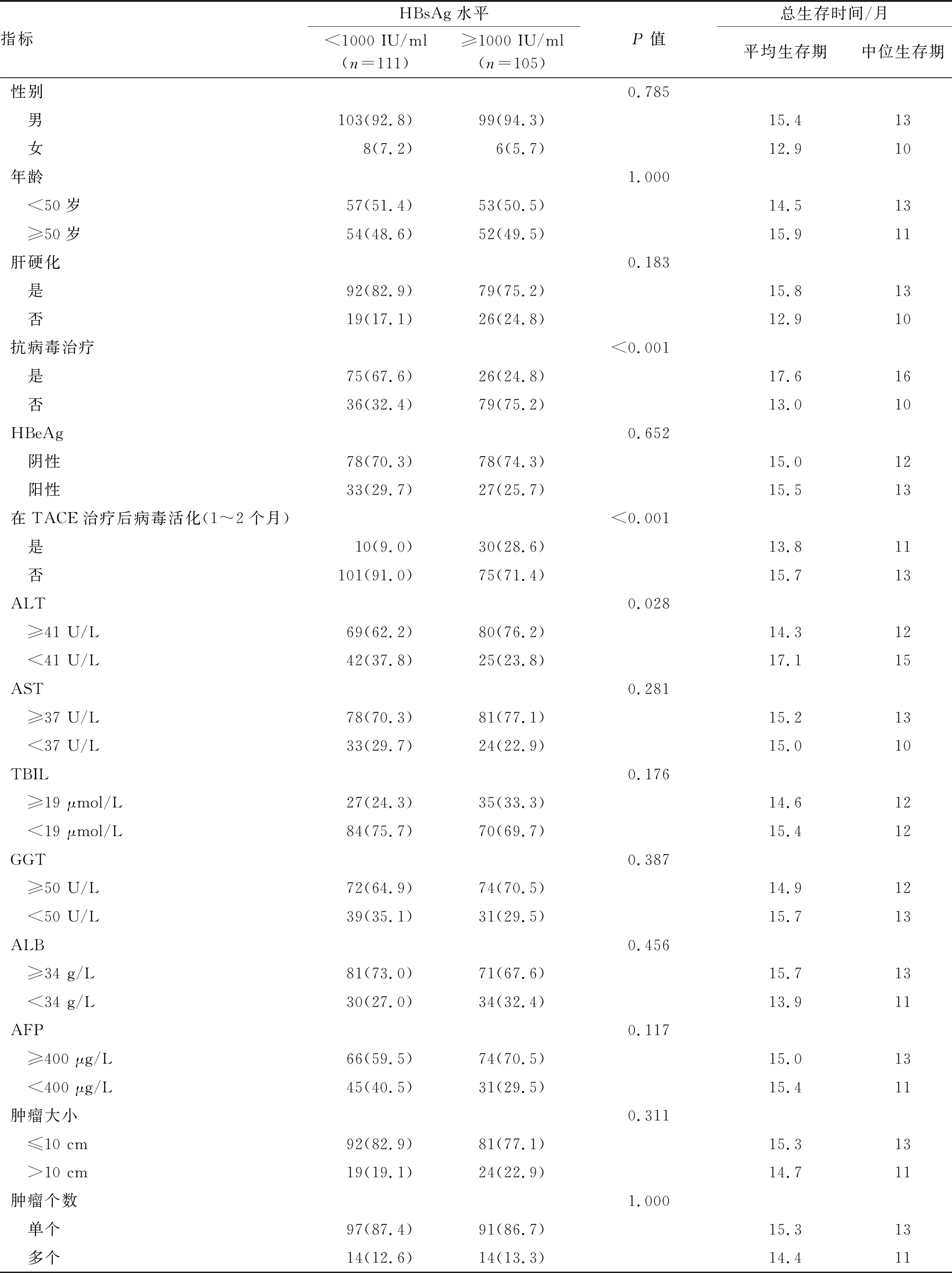
表2 216例HCC患者HBsAg水平、临床参数与生存时间的关系Tab 2 Correlation between the serum HBsAg level, clinicopathological variables and survival time of the 216 patients with HCC
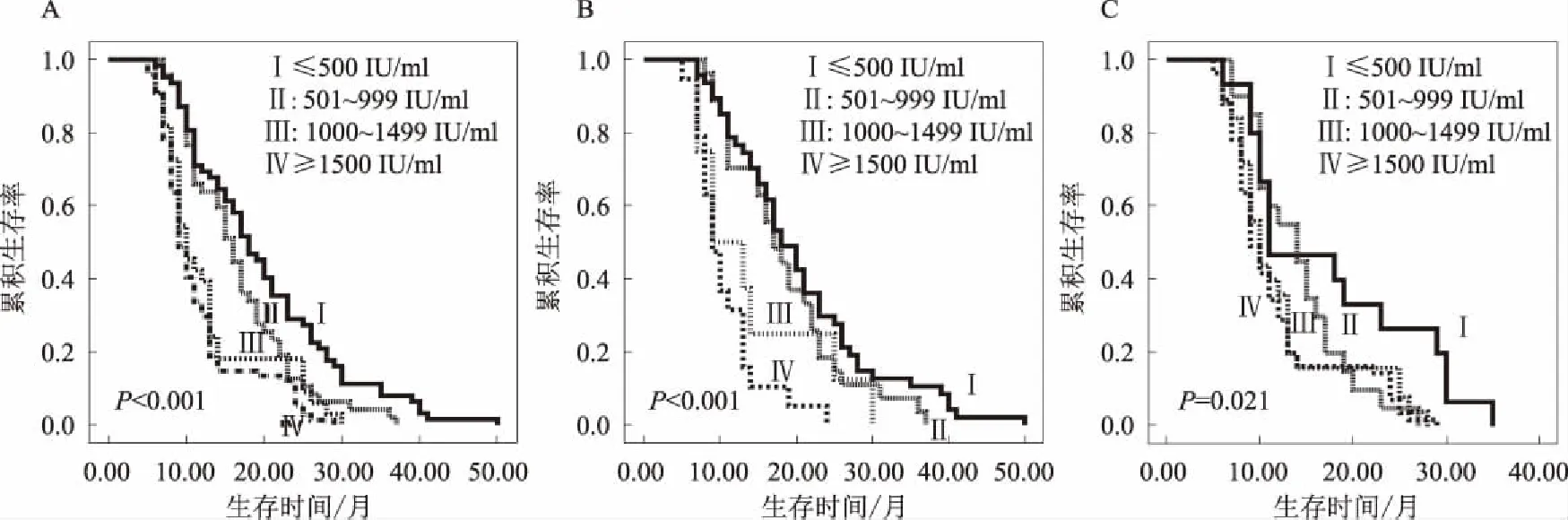
图1 低/高HBsAg水平HCC患者的Kaplan-Meier生存曲线 A:低/高HBsAg水平HCC患者的生存曲线;B:未抗病毒HCC患者 低/高HBsAg水平的生存曲线;C:抗病毒HCC患者低/高HBsAg水平的生存曲线Fig 1 Kaplan-Meier survival curve of HCC patients with low/high HBsAg level A: survival curve of HCC patients with low/high HBsAg level; B: survival curve of low/high HBsAg level in patients with non antiviral HCC; C: survival curve of low/high HBsAg level in patients with antiviral HCC
表3 216例HCC患者OS的单因素及多因素分析
Tab 3 Univariate and multivariate analyses of the OS of the 216 patients with HCC
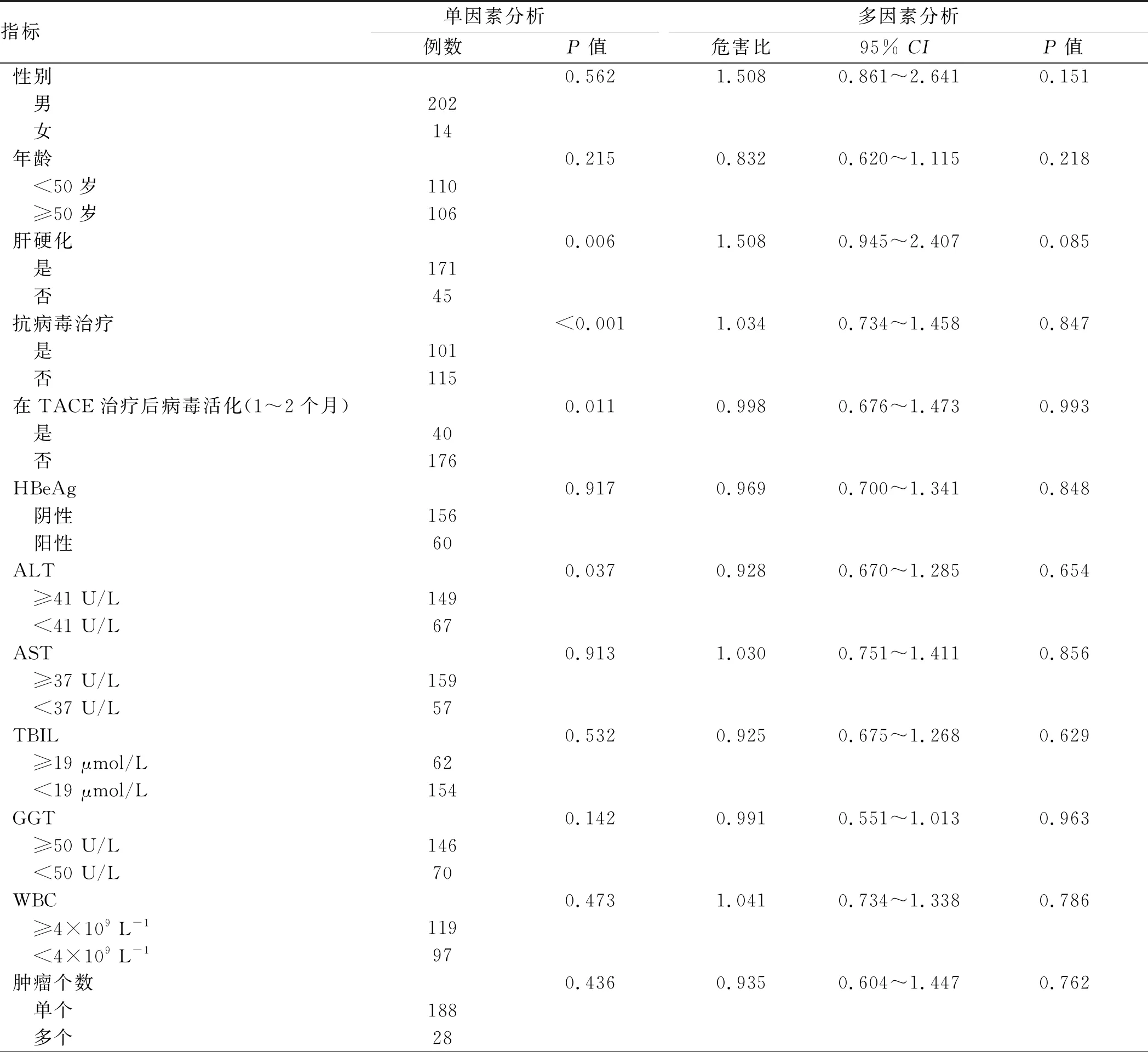
指标单因素分析例数P值多因素分析危害比95% CIP值性别0.5621.5080.861~2.6410.151 男202 女14年龄0.2150.8320.620~1.1150.218 <50岁110 ≥50岁106肝硬化0.0061.5080.945~2.4070.085 是171 否45抗病毒治疗<0.0011.0340.734~1.4580.847 是101 否115在TACE治疗后病毒活化(1~2个月)0.0110.9980.676~1.4730.993 是40 否176HBeAg0.9170.9690.700~1.3410.848 阴性156 阳性60ALT0.0370.9280.670~1.2850.654 ≥41 U/L149 <41 U/L67AST0.9131.0300.751~1.4110.856 ≥37 U/L159 <37 U/L57TBIL0.5320.9250.675~1.2680.629 ≥19 μmol/L62 <19 μmol/L154GGT0.1420.9910.551~1.0130.963 ≥50 U/L146 <50 U/L70WBC0.4731.0410.734~1.3380.786 ≥4×109 L-1119 <4×109 L-197肿瘤个数0.4360.9350.604~1.4470.762 单个188 多个28
续表3
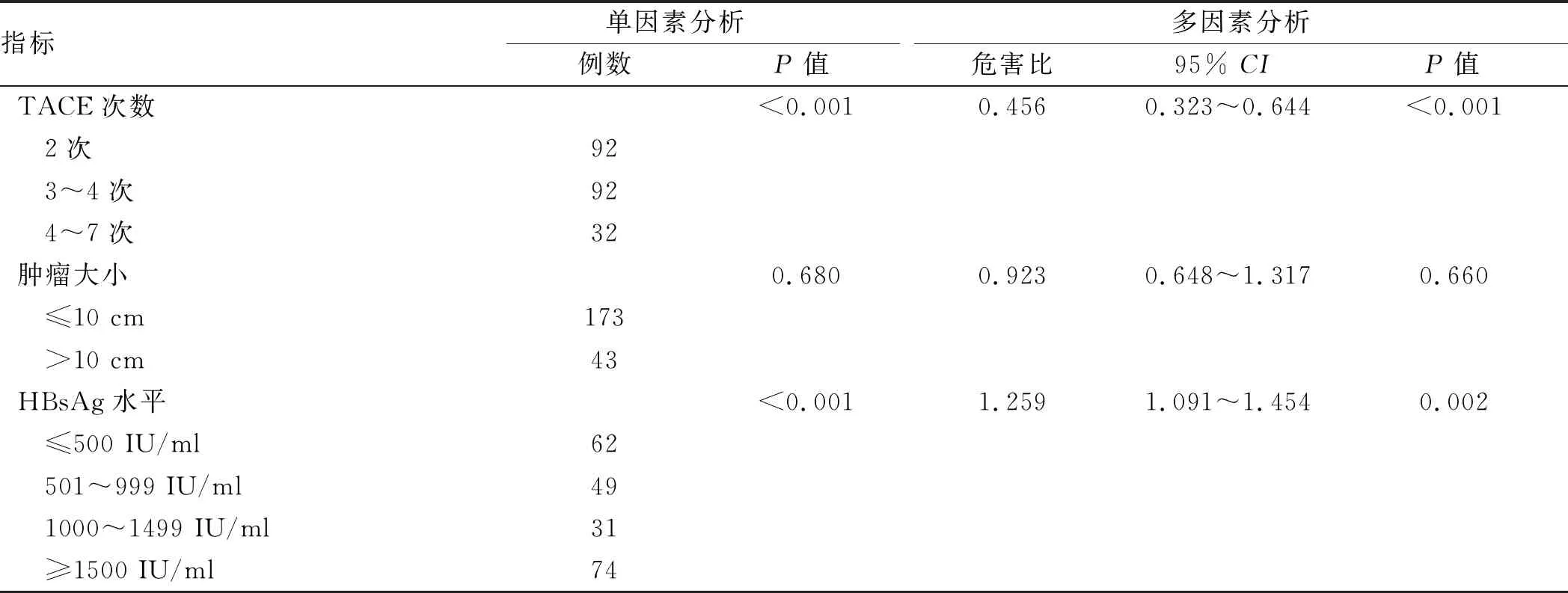
指标单因素分析例数P值多因素分析危害比95% CIP值TACE次数<0.0010.4560.323~0.644<0.001 2次92 3~4次92 4~7次32肿瘤大小0.6800.9230.648~1.3170.660 ≤10 cm173 >10 cm43HBsAg水平<0.0011.2591.091~1.4540.002 ≤500 IU/ml62 501~999 IU/ml49 1000~1499 IU/ml31 ≥1500 IU/ml74
3 讨论
HBV DNA水平>2 000 IU/ml已被广泛应用作为病毒活跃复制[16]的指标,HBV DNA<2 000 IU/ml的患者,尤其是HBV DNA检测不出的患者被认为是低风险。目前在HBV DNA检测不出的HCC患者中寻找一种能够预测HCC预后的标志物迫在眉睫。近年来有研究表明,高水平的HBsAg可能预示着HCC更具有侵袭性,并可作为低HBV载量HCC手术切除患者的预后指标[9-10]。然而,HBV DNA阴性经TACE治疗的晚期HCC患者中HBsAg水平的意义尚未见报道。
以前的几项肝癌相关研究显示,HBsAg水平有助于预测HBV阴性患者的疾病进展。Tseng等[17]发现,在中国HBsAg水平高会增加HBV DNA较低患者发生HCC的风险。Liu等[9]报道,HBV载量较低患者中,高水平的HBsAg与较差的生存率和HCC的早期复发有关。Zhou等[10]证明HBsAg水平可作为补充标志物补充HBV DNA水平,预测HCC复发,尤其是在HBeAg阴性、病毒载量较低的患者中。在慢性HBV感染的HCC患者中,活化可能自发发生,也可能在化疗后发生,但根据一些已发表的研究,几乎所有的活化病例均发生在治疗后的患者中,尤其是化疗后和TACE后[18-20]。核苷类似物能显著抑制HBV的复制[21],在许多国家的肝脏研究协会建议只要发现HBV DNA阳性的肝癌患者就要开始抗病毒,甚至一些建议所有肝癌患者不论HBV DNA阴性还是阳性均应在接受TACE治疗前预防性抗病毒[8,22-23]。在中国,中华医学会肝病学会建议HBV DNA>20 IU/ml患者应进行抗病毒治疗,尤其是在TACE前,同时HBV DNA检测不出的患者需要密切检查。我们也观察到一些接受抗病毒治疗的HBsAg水平高的患者。这可能是核苷类似物治疗期间(0.1 log IU/ml/年)血清HBsAg水平缓慢下降所致。此外,HBsAg水平比HBV DNA水平[24]更稳定,因此,HBsAg定量可以作为血清HBV DNA水平的替代指标用于慢性HBV[25]的治疗。这意味着HBV DNA检测不出的HBsAg水平高的患者应在TACE前预先接受抗病毒治疗。或已接受抗病毒治疗的其他HBsAg水平较高的患者,应另加抗病毒药物治疗。然而,我们只观察到少数病例,需要纳入更多的病例并进行一些前瞻性研究。
ALT水平通常被认为是宿主免疫和病毒复制相互作用的结果,是预测患者预后的重要因素之一。在近年来的研究中,如果对HBV DNA<2 000 IU/ml的患者随访1年,ALT水平正常,则被认为是不活跃的携带者。目前,有证据表明,定量HBsAg水平可以用来定义非活性载体[22]。之前的研究发现HBsAg定量高与ALT水平高有显著相关性[12,26]。与我们的研究结果一致。
多因素Cox模型分析表明,HBsAg水平是一个独立的预后因子,这意味着HBsAg水平可能是晚期HCC TACE治疗中HBV DNA检测不出的一个潜在的强有力的预后因子。HBsAg是肝细胞[27]中cccDNA转录的产物之一。肝组织cccDNA检测显示感染肝细胞的数量,但由于其复杂性,常规应用受到限制。据报道,血清HBsAg值与转录活性cccDNA相关,因此血清HBsAg水平更准确地反映了组织cccDNA,为治疗的病毒学应答提供了替代预测因子,尤其是对HBV DNA检测不出的患者[28-29]。既往有研究报道,肿瘤组织中cccDNA水平明显高于非肿瘤组织,cccDNA可能在HCC发生中发挥重要作用[29-30]。这可以解释高HBsAg水平可能有助于识别预后不良的晚期HCC患者。

