microRNA-486对低氧导致的原代大鼠心肌细胞损伤和凋亡的改善作用
张海涛,韦薇,齐弘炜,袁彪,汤楚中
(1.承德医学院附属医院心脏外科,河北 承德 067000;2.承德医学院附属医院血液检验室,河北 承德 067000;3.首都医科大学附属北京同仁医院心脏外科,北京 100730;4.中国人民解放军总医院第六医学中心心脏外科,北京 100048)
缺血性心脏病是最严重的心血管疾病之一,其病理生理机制以及心肌细胞缺血适应机制尚未完全阐明。有证据表明,微小RNA (microRNA,miRNA)可能在缺血性心脏病中发挥关键作用[1-2]。miRNA是一类在转录后基因调控中发挥功能的非编码小RNA,miRNA在缺血性心脏病发病机制和进展的过程中起关键的调节作用[3-4]。miR-486是心脏高丰度表达的重要miRNA之一,有研究[5]表明,miR-486在携带MRTF-A重组腺病毒转染的新生大鼠心肌细胞表达的多种miRNA中最为突出。而MRTF-A在心肌缺血期间,是调控心肌细胞纤维化的重要转录因子。因此,miR-486的表达调控与心肌缺血和预后有明显相关性,但是miR-486在心肌细胞中的作用目前尚不清楚。因此,本研究拟利用腺病毒介导的基因高表达和沉默技术,初步研究miR-486在心肌细胞缺氧损伤中的作用。
1 材料与方法
1.1 实验动物
1~2日龄的清洁级SD大鼠乳鼠15只,购于北京科宇动物养殖中心。
1.2 主要试剂和仪器
miRNA提取试剂盒、miRNA反转录试剂盒、miRNA-486荧光探针、实时荧光定量PCR仪 (美国应用生物系统公司),腺病毒ad-miR-486、腺病毒admiR-486-antago (上海汉恒生物公司),乳酸脱氢酶(lactate dehydrogenase,LDH) 试剂盒 (南京建成生物工程研究所有限公司),CCK-8试剂盒 (中国东仁化学科技有限公司),AnnexinⅤ/PI试剂盒 (武汉博士德生物工程有限公司),细胞培养箱、紫外分光光度计(美国赛默飞世尔科技有限公司),低氧培养箱 (英国Ruskinn公司),酶标仪 (美国分子仪器公司),流式细胞仪 (美国BD公司)。
1.3 乳鼠心肌细胞的分离培养
取出生1~2 d的SD大鼠乳鼠15只,消毒后在无菌条件下取出乳鼠心脏,除去心包等多余组织,将心室剪成约1 mm3均匀大小的组织块,并用0.125%胰蛋白酶在37 ℃水浴锅中重复消化4次 (每次约10 min)。吸取后3次消化的细胞悬液于离心管内,添加含有10%胎牛血清的DMEM培养基终止消化。离心后去上清液,将细胞悬液重新悬浮到含10%胎牛血清的DMEM培养基,均匀接种于75 mL的培养瓶中,于37 ℃培养箱(含5% CO2和95% O2)中培养,差速贴壁法去除成纤维细胞,调整细胞浓度后接种于培养板上,于37 ℃细胞培养箱 (含5% CO2和95%空气) 中继续培养,孵育36 h后进行实验。
1.4 实时荧光定量PCR检测细胞miR-486水平
制备单细胞悬液接种于6孔板,1×105/孔。当细胞生长达到80%融合时,将细胞分成6组,分别为常氧培养对照组、低氧培养6 h组、低氧培养12 h组、低氧培养24 h组、低氧培养36 h组、低氧培养48 h组,取各组细胞,吸弃培养基后,按照 ABI miRNA 分离试剂盒说明书操作,提取miRNA,紫外分光光度计测定miRNA浓度和纯度,采用U6作为内参,用特异性miR-486反转录引物和U6内参反转录引物进行反转录获取cDNA。用ABI公司的miR-486探针对原代心肌细胞中miR-486的表达进行测定。使用实时荧光定量PCR仪 (ABI 7900,美国应用生物系统公司) 进行实验,获得Ct值后,应用2-ΔΔCt法计算目的基因的相对表达水平。
1.5 细胞活力、损伤和凋亡程度的测定
将1.4中达到80%融合度的心肌细胞按照转染Ad-miR-486和Ad-miR-486-antago,分成6组,分别为常氧培养组 (C+N组)、转染ad-miR-486+常氧培养组(M+N组)、转染ad-miR-486-antago+常氧培养组 (I+N组)、低氧培养组 (C+H组)、转染ad-miR-486+低氧培养组 (M+H组)、转染ad-miR-486-antago+低氧培养组(I+H组),用无血清不含抗生素的DMEM培养液分别稀释待转染的ad-miR-486和ad-miR-486-antago。将脂质体Lipofectamine 2000与待转染试剂混匀,室温静置20 min后,加入相对应的各组细胞中。C+N组、M+N组、I+N组置于常氧培养箱 (37 ℃,含5% CO2和95%空气) 中孵育;C+H组、M+H组、I+H组置于低氧培养箱 (37 ℃,含1% O2、94% N2和5% CO2) 中孵育。48 h后,收集各组细胞进行下列指标的检测。
1.5.1 CCK-8法测定心肌细胞活性:随机选取各组心肌细胞,每孔培养基按照10 ∶1的比例避光加入CCK-8试剂,37 ℃下在培养箱内避光培养3 h,应用酶标仪于450 nm波长处测定光密度 (optical density,OD) 值,间接反映心肌细胞活力。计算细胞活力,细胞活力 (%)=(OD实验孔-OD调零孔)/ (OD常氧培养孔-OD调零孔) ×100。
1.5.2 培养液LDH活性的测定:吸取各组细胞上清液,按照LDH活性检测试剂盒说明,用酶标仪测定各组还原型辅酶Ⅰ在反应过程中340 nm处OD值,计算细胞培养液LDH活性。
1.5.3 流式细胞术检测心肌细胞凋亡:吸净各组细胞培养液,加入不含EDTA的0.25%胰酶消化至细胞形态为圆形时,轻轻吹打使细胞脱落,加入DMEM培养液终止消化后收集细胞,1 000 r/min离心5 min,PBS漂洗2次后,用300 μL的1×Binding buffer重悬,调整细胞浓度约1×105/mL,加入5 μL AnnexinⅤ-FITC和5 μL碘化丙啶,混匀后避光孵育10 min,用流式细胞仪测定细胞凋亡率。
1.6 统计学分析
2 结果
2.1 低氧培养心肌细胞miR-486表达水平的变化
从SD大鼠乳鼠中分离心肌细胞并培养扩增,依次于低氧培养箱 (37 ℃,1% O2、94% N2、5% CO2)中培养6、12、24、36、48 h后收取,抽提细胞RNA,利用实时荧光定量PCR测定miR-486表达变化。常氧培养对照组、低氧培养6 h组、低氧培养12 h组、低氧培养24 h组、低氧培养36 h组、低氧培养48 h组中,miR-486的表达水平分别为1.03±0.27、1.16±0.22、1.65±0.31、2.52±0.72、1.66±0.24、1.45±0.04。随着低氧培养时间的延长,miR-486的表达逐渐上升,至24 h达到峰值后逐渐下降,低氧培养12、24、36 h组miR-486表达量明显高于常氧培养对照组,差异有统计学意义 (P< 0.05)。
2.2 心肌细胞培养液LDH活性的比较
6组比较,心肌细胞培养液LDH活性的差异有统计学意义 (F=72.759,P< 0.01)。心肌细胞在常氧环境中培养,转染ad-miR-486和ad-miR-486-antago可略增加LDH释放量,但M+N组、I+N组与C+N组比较无统计学差异 (P> 0.05)。低氧环境中培养的心肌细胞 (C+H组、M+H组、I+H组) 较常氧环境中心肌细胞 (C+N组、M+N组、I+N组) LDH释放量明显增加(P< 0.05)。在低氧环境中转染了ad-miR-486的M+H组较C+H组、I+H组LDH释放量明显下降 (P< 0.05),且转染了ad-miR-486-antago的I+H组LDH释放量高于C+H组,差异有统计学意义 (P< 0.05),见表1。
2.3 心肌细胞活力的比较
6组比较,心肌细胞活力的差异有统计学意义(F=29.384,P< 0.01)。低氧环境中C+H组和I+H组较其他4组心肌细胞活力明显降低 (P< 0.05),且转染了ad-miR-486的M+H组较C+H组、I+H组心肌细胞活力明显升高 (P< 0.05),转染了ad-miR-486-antago的I+H组较C+H组心肌细胞活力明显下降 (P<0.05)。见表1。
2.4 各组心肌细胞凋亡率的比较
6组比较,心肌细胞凋亡率的差异有统计学意义 (F=80.302,P< 0.01)。常氧环境中转染admiR-486和ad-miR-486-antago可略增加心肌细胞的凋亡率,但M+N组、I+N组与C+N组相比,差异无统计学意义 (P> 0.05)。低氧环境中培养的心肌细胞 (C+H组、M+H组、I+H组) 较在常氧环境中心肌细胞 (C+N组、M+N组、I+N组) 凋亡率明显升高 (P< 0.05)。在低氧环境中转染了ad-miR-486-antago的I+H组心肌细胞凋亡率明显高于C+H组和M+H组 (P< 0.05),且转染了ad-miR-486的M+H组细胞凋亡率明显小于C+H组 (P< 0.05)。见表1、图1。
3 讨论
缺血性心脏病的主要病理过程是由于血管病变导致心脏血供障碍,进一步导致心肌细胞缺血、损伤和凋亡,最终导致心脏功能受损。而miRNA在这个过程中起重要作用,miRNA失调与缺血性心脏病的发生和发病机制有关[6-8]。研究[9]表明,通过提高大鼠心肌中miR-486的表达水平,可以改善大鼠心肌梗死后心脏功能。本研究通过对大鼠原代心肌细胞低氧培养,模拟了心肌急性缺氧损伤的过程,利用腺病毒介导的基因高表达和沉默技术,提高和降低了心肌细胞中miR-486的表达水平,并通过一系列实验证实低氧条件下miR-486能够降低LDH活性、增强心肌细胞活力、降低细胞凋亡率,从而改善低氧导致的心肌细胞损伤和凋亡。
本研究证实miR-486是心肌细胞中缺氧诱导的miRNA,通过实时荧光定量PCR证实在低氧状态下心肌细胞内miR-486表达显著提高,但其对心肌细胞低氧损伤过程的保护机制尚不明确。利用TargetScan网络生物信息学数据库分析,预测miR-486的靶基因可能含有PTEN、FoxO1、Sirt1。其中,PTEN作为H2O2诱导的大鼠心肌细胞凋亡的负调节因子[10],miR-486-5p可通过靶向抑制PTEN并激活PI3K/AKT信号通路来保护心肌细胞免于凋亡[11]。FoxO家族参与调节多种细胞功能,FoxO1通过转录控制丙酮酸脱氢酶激酶4的表达,调节心肌葡萄糖氧化速率[12],其抑制作用也显著抑制成肌细胞增殖和减少成肌细胞凋亡[13]。Sirt1失活在缺血再灌注诱导的细胞凋亡中起关键作用[14]。因此,这些靶基因的抑制可能涉及miR-486对心肌细胞低氧损伤的保护作用。这在本研究中也得到了证实,低氧环境中,与C+H组比较,M+H组LDH释放和细胞凋亡率明显下降,细胞活力明显上升;而I+H组LDH释放明显增多,细胞凋亡率明显上升,细胞活力明显降低。可见,miR-486对低氧导致的心肌细胞损伤和凋亡的改善是有效的。

表1 6组心肌细胞培养液中LDH活性、细胞活力和细胞凋亡率的比较Tab.1 Comparison of LDH activity,cell viability,and rate of apoptosis in the culture fluid of the cardiomyocytes among the six groups
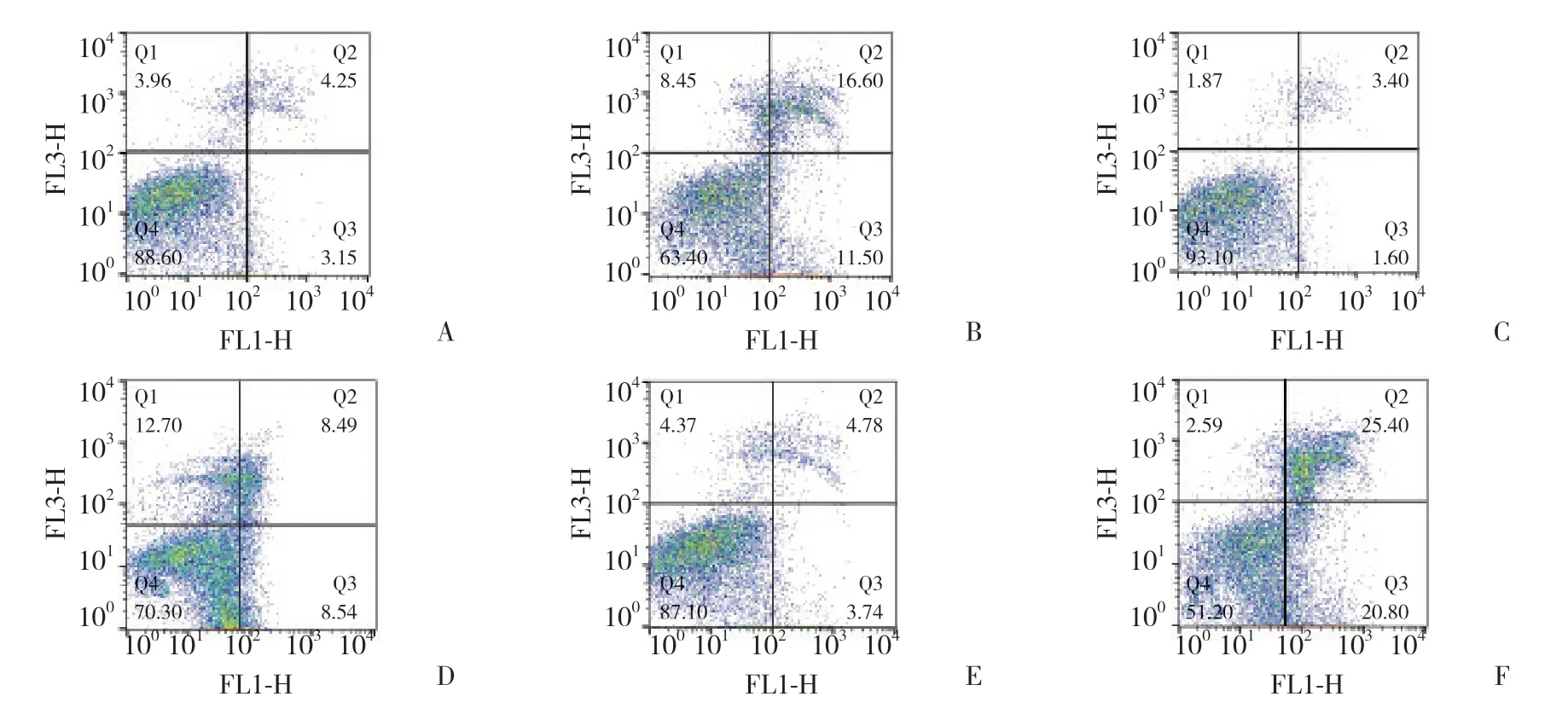
图1 流式细胞仪测定心肌细胞凋亡率Fig.1 Determination of the rate of apoptosis of the cardiomyocytes using flow cytometry
综上,本研究表明,miR-486对原代心肌细胞低氧状态下的损伤和凋亡有显著改善作用。miR-486可能为缺血性心脏病的基因治疗提供新的思路和实验依据。

