高迁移率族蛋白B-1通过细丝蛋白A影响喉癌细胞迁移
贾茹,孙媛媛,富伟能
(中国医科大学生命科学学院医学遗传学教研室,沈阳 110122)
喉鳞状细胞癌 (laryngeal squamous cell carcinoma,LSCC) 是常见的喉癌[1],其细胞起源于喉上皮细胞。研究[1]显示LSCC的5年生存率仅为60%左右,主要死亡原因是转移和复发[2]。因此,研究喉癌细胞迁移、转移的分子机制具有重要的理论意义和潜在临床价值。高迁移率族蛋白B-1 (high mobility group box-1,HMGB1) 是核DNA结合蛋白,含有2个DNA结合区 (boxA、boxB) 和1个酸性C末端区[3]。研究[4]发现HMGB1促进细胞迁移和转移,说明其在肿瘤的发生发展过程中具有重要作用。有研究[5]证实乳腺癌中miR-200c可以通过调控HMGB1的表达来抑制乳腺癌细胞的迁移;在直肠癌中沉默HMGB1后肿瘤细胞迁移能力减弱[6],但其具体的分子机制尚不清楚。细丝蛋白A (filamin A,FLNA) 是哺乳动物细胞内重要的细胞骨架蛋白[7]。有研究[8]证实FLNA在多种肿瘤细胞 (乳腺癌等) 中表达,但其在喉癌细胞系Hep2中的生物学功能尚不明确。研究[9]发现在FLNA启动子区存在2个HMGB1的潜在结合位点 (5'-A/TAACAAT/A-3') 。因此推测HMGB1可能通过调控FLNA发挥癌基因作用。本研究应用分子生物学技术检测喉癌及癌旁组织中FLNA表达水平及其对喉癌Hep2细胞迁移能力的影响,初步探讨HMGB1基因在喉癌发生发展中的作用机制及生物学功能,为喉癌的分子诊治提供新线索。
1 材料与方法
1.1 材料
1.1.1 标本来源:选取解放军第463医院耳鼻咽喉科30例喉癌患者术后组织标本,同时选取对应癌旁组织 (距癌组织切缘>2 cm) 作为对照组,选取的组织标本均经病理科确诊为LSCC,并具有完整临床样本信息,所有患者均知情同意。
1.1.2 细胞株及试剂:人胚肾细胞系HEK293 (中科院上海细胞库)、人喉癌Hep-2细胞 (中科院上海细胞库) 。胎牛血清 (中国BI公司)、1640培养基 (中国BI公司)、TRIzol (日本TaKaRa公司)、反转录试剂盒及PCR相关试剂 (日本TaKaRa公司),RIPA裂解液 (强) (碧云天生物技术公司)、BCA蛋白浓度测定试剂盒 (碧云天生物技术公司)、Transwell小室 (法国Coster公司)、结晶紫 (碧云天生物技术公司)、Polyplus转染试剂 (美国Afao公司)、FLNA蛋白抗体(武汉三鹰生物技术公司)、HMGB1-siRNA和FLNAsiRNA (上海吉凯公司) 。
1.2 细胞转染
提前24 h将处于对数生长期的Hep2细胞以2×105/mL密度铺于6孔板中。随机分为空白对照组 (CON组)、阴性对照组 (NC组)、HMGB1-siRNA组、FLNA-siRNA 组以及 HMGB1-siRNA+FLNA-siRNA组,然后将6孔板置于37 ℃、5% CO2的细胞培养箱中培养24 h,当细胞完全贴壁时,转染相关小RNA (NC、HMGB1、FLNA) 和转染试剂。根据不同实验在不同时间点收集转染后的Hep2细胞。
1.3 cDNA合成和实时定量PCR
使用PrimeSciptTMRT Master Mix Kit试剂盒将总RNA逆转录成cDNA,以cDNA为模板,采用TaKaRa SYBR Premix Ex TaqTMⅡ说明进行PCR扩增。引物序列:FLNA,上游引物5’-GACAGGTCGCTACACCATC C-3’,下游引物5’-CTAGCCCGTGACCTCCGATT-3’;GAPDH,上游引物5’-TAACATCAAATGGGGTGAG G-3’,下游引物5’-GGTTCACACCCATCACAAAC-3’。以GAPDH为内对照,反应结果用BIO-RAD CFX Connect Real-Time System软件分析,并计算每个反应管内的荧光信号到达设定的域值时所经历的循环数 (cycle threshold,Ct) 值。采用2-ΔΔCt计算喉癌及癌旁组织拷贝数的差异。
1.4 Western blotting检测
收集转染48 h后NC组及HMGB1-siRNA组喉癌Hep2细胞,加RIPA裂解液冰浴30 min,提取喉癌细胞总蛋白并采用BCA法测定蛋白浓度,检测蛋白浓度后,将其调整至相同浓度,每孔加入35 μg蛋白上样。将蛋白SDS-PAGE电泳分离1.5 h、恒流300 mA电转2 h、5%脱脂牛奶封闭2 h、用TBST洗涤3次后,放入1 ∶1 000稀释的FLNA一抗中摇床上4 ℃杂交过夜、次日取出后,用TBST洗涤3次后放入二抗中,37 ℃温箱中孵育1 h、用TBST洗涤3次后采用ECL化学发光法显影。BioRad图像分析系统测定条带吸光度,目标蛋白的相对表达量=目标蛋白吸光度值/GAPDH蛋白吸光度值。
1.5 细胞划痕实验
收集各转染组48 h细胞,胰酶消化后计数,以1×104/mL密度接种于6孔板,接种24 h后,在6孔板中划痕,PBS冲洗3次,更换无血清培养基,分别于划痕后0、24、48 h观察细胞的迁移情况并拍照记录,实验重复3次。
1.6 Transwell实验
转染细胞24 h后用胰蛋白酶消化细胞,以细胞密度3×104/孔接种于Transwell小室上层中 (加入终体积200 μL双无1640培养基),小室下层加入600 μL10%胎牛血清的1640培养基。培养24 h后,依次进行PBS冲洗、4%多聚甲醛固定30 min、结晶紫染色30 min、PBS冲洗后用小刀将滤膜切下、中性树脂封片、显微镜计数上、下、左、右、中5个视野的穿膜细胞数并拍照。
1.7 统计学分析
2 结果
2.1 FLNA在喉癌组织及喉癌Hep2细胞中低表达
应用实时PCR检测FLNA基因在30例喉癌组织及对应癌旁组织中的表达水平。结果显示,FLNA在11例 (36.7%) 癌组织中高表达。30例喉癌患者组织中FLNAmRNA表达量 (0.632±0.057) 显著低于癌旁组织 (1.000±0.0,P< 0.01) ;应用实时PCR方法比较人胚肾细胞HEK293和喉癌Hep2细胞中FLNA表达水平,结果显示FLNA在HEK293细胞中表达水平 (1.000±0.0) 高于喉癌Hep2细胞 (0.512±0.094,P<0.05) 。提示FLNA在喉癌中发挥抑癌基因作用。
2.2 HMGB1-siRNA抑制喉癌Hep2细胞HMGB1表达
转染siHMGB1至喉癌Hep2细胞48 h后,应用实时PCR检测HMGB1表达。结果显示,转染HMGB1-siRNA后,Hep2细胞中HMGB1mRNA表达 (0.210 2±0.088 47) 显著低于对照组 (1.000 0±0.0,P< 0.001),说明HMGB1-siRNA能有效抑制喉癌Hep2细胞HMGB1的表达,证明转染有效。
2.3 HMGB1基因沉默上调喉癌Hep2细胞中FLNA表达
转染了HMGB1-siRNA后,应用Western blotting和实时PCR检测Hep2细胞中FLNA表达水平。结果显示,HMGB1-siRNA组中FLNAmRNA和蛋白水平均显著高于对照组 (P< 0.05),见表1、图1。提示HMGB1基因沉默上调喉癌Hep2细胞中FLNA的表达,HMGB1负性调控FLNA。

表1 各组FLNA mRNA和蛋白表达比较Tab.1 Comparison of FLNA mRNA and protein expression in each group
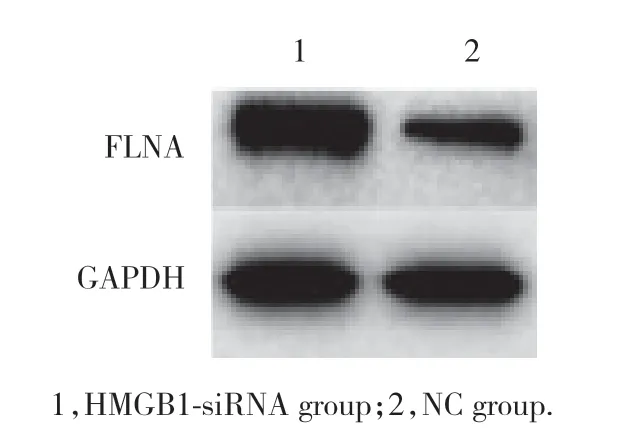
图1 HMGB1基因沉默上调喉癌Hep2细胞中FLNA表达Fig.1 HMGB1 silencing upregulated FLNA expression in laryngeal cancer Hep2 cells
2.4 HMGB1通过FLNA促进喉癌Hep2细胞迁移(表2、图2)
将FLNA-siRNA以及HMGB1-siRNA+FLNA-siRNA转染喉癌Hep2细胞48 h后,应用实时PCR检测FLNAmRNA表达水平。结果显示,与FLNA-siRNA组 (0.188 8±0.066 31) 比较,HMGB1-siRNA+FLNA-siRNA组 (0.511 9±0.094 03)FLNAmRNA表达升高 (P< 0.001),证明转染有效。同时,HMGB1-siRNA、FLNA-siRNA以及HMGB1-siRNA+FLNA-siRNA共转染喉癌Hep2细胞48 h后,采用划痕以及Transwell实验检测细胞迁移能力。结果显示,转染HMGB1-siRNA组迁移距离和数量明显低于NC组及对照组 (P< 0.01),转染FLNA-siRNA组迁移距离和数量明显高于NC组及对照组(P< 0.01) 。转 染HMGB1-siRNA+FLNA-siRNA组 与HMGB1-siRNA组相比,迁移能力明显升高 (P< 0.05) 。提示FLNA-siRNA可逆转HMGB1-siRNA对喉癌Hep2细胞迁移能力的促进作用,即FLNA介导HMGB1抑制喉癌Hep2细胞迁移。

表2 各组Hep2细胞迁移距离和数量比较Tab.2 Comparison of the migration distance and number of migrated Hep2 cells in each group
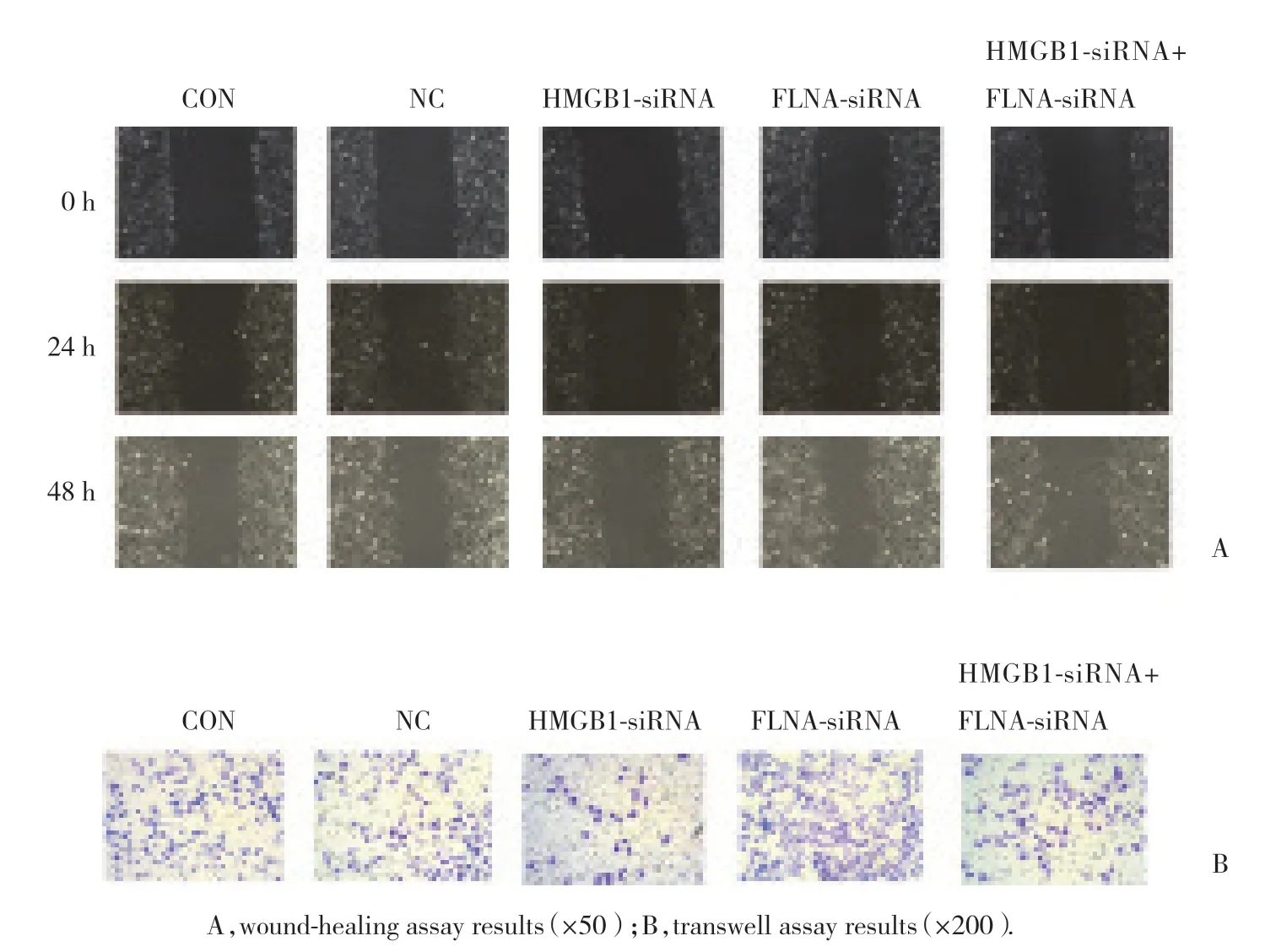
图2 HMGB1 FLNA促进喉癌Hep2细胞迁移Fig.2 HMGB1 promotes the migration of laryngeal cancer Hep2 cells by FLNA
2.5 喉癌组织中FLNA表达与临床病理特征的关系
结果显示,FLNA表达与淋巴结转移、TNM分期和肿瘤分化程度密切相关 (P< 0.05),而与患者年龄、性别等因素不相关 (P> 0.05),见表3。
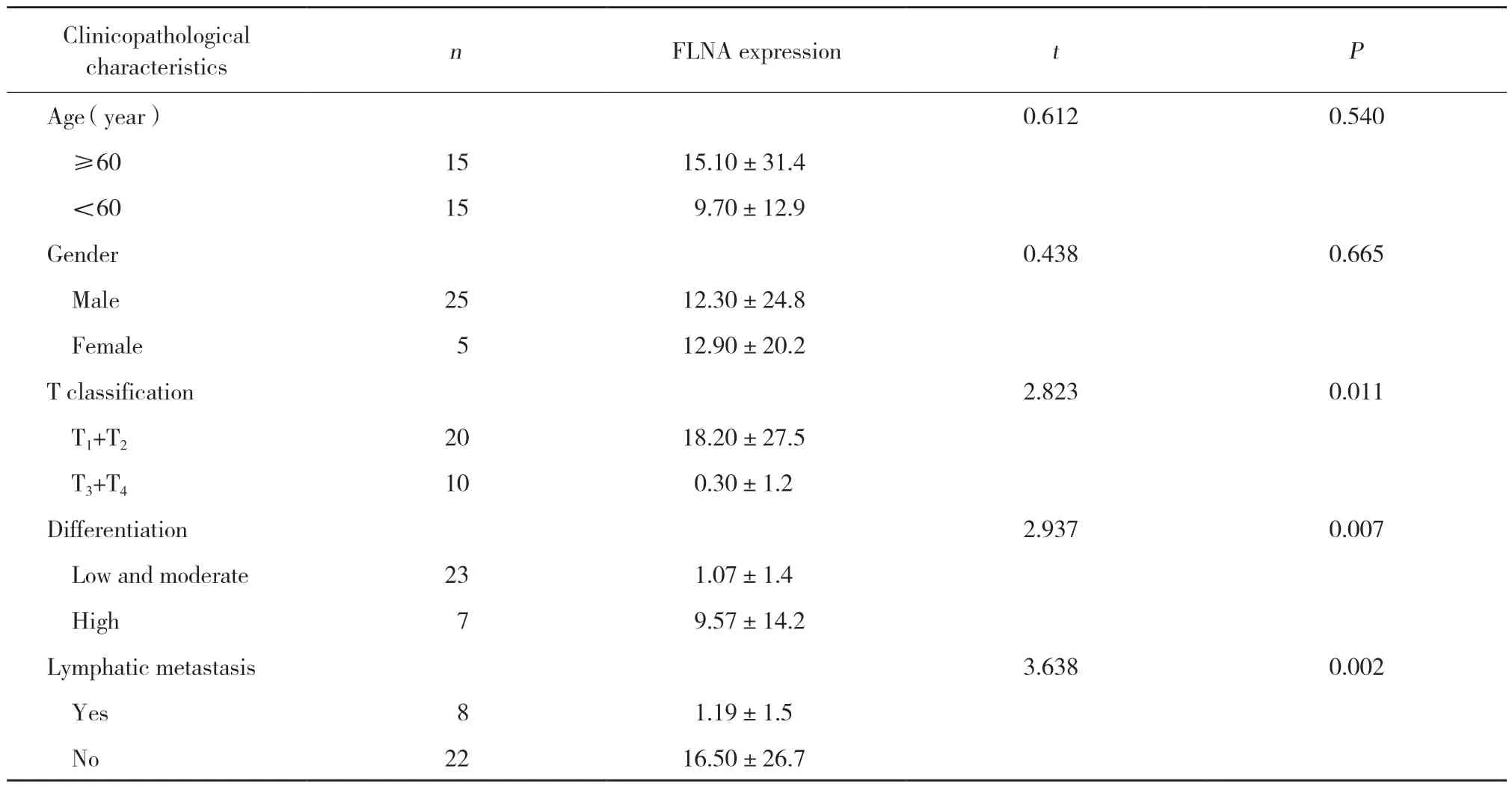
表3 FLNA表达与临床病理特征的关系Tab.3 Relationship between FLNA expression and clinicopathological characteristics of laryngeal cancer patients
3 讨论
FLNA 编码产物为一种细丝蛋白,是一种脚手架蛋白,可与肌动蛋白细丝交联,引导其与细胞膜上糖蛋白结合,引起细胞形状改变和迁移,在维持并稳定细胞骨架、细胞形态、细胞运动和信号转导等生物学行为中发挥重要作用[10]。
HMGB蛋白家族包含HMGB1、HMGB2和HMGB3 3种亚型蛋白,HMGB1是HMGB家族的重要成员[11]。本研究通过实时PCR检测喉癌组织及癌旁组织中FLNA基因的表达,发现喉癌中FLNA基因表达水平显著低于癌旁组织,且与喉癌患者淋巴结转移、临床分期以及肿瘤分化程度有关。提示FLNA在喉癌中可能发挥抑癌基因作用。研究发现HMGB1在FLNA启动子区存在潜在结合位点[9],本研究通过转染HMGB1特异性siRNA,应用实时定量PCR及Western blotting检测结果表明喉癌Hep2细胞中HMGB1沉默后FLNA表达上调,提示FLNA是HMGB1下游靶基因。
基于HMGB1在肿瘤中的重要作用,推测FLNA也可能对肿瘤细胞的生物学特性有影响。因此本研究采用划痕、Transwell实验分别检测了HMGB1、FLNA对喉癌Hep2细胞迁移和迁移的影响。结果显示,下调HMGB1表达后细胞迁移能力降低,且这种影响可被FLNA回复,提示HMGB1促进喉癌细胞迁移是通过调控FLNA实现的。FLNA作为一种新型肿瘤标志物,研究[12]已发现在鼻咽癌组织中的表达显著降低,且与TNM分期、淋巴结转移、临床分期、组织学分级显著相关。然而FLNA在调控喉癌细胞迁移的具体机制尚不清楚,需要进一步研究论证。
综上所述,HMGB1通过抑制FLNA的表达来促进喉癌细胞迁移。本研究以喉癌Hep2细胞为研究对象,首次报道了FLNA对喉癌迁移的影响及其初步机制,为喉癌分子靶向治疗的研究提供了新线索。

