中性粒细胞/淋巴细胞比值与2型糖尿病合并非酒精性脂肪肝的相关性分析
郑海兰 李 凡 丁 维 祁明霞 黄 茗
在2型糖尿病(type 2 diabetes mellitus,T2DM)、肥胖或代谢综合征等患者中, 非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)的患病率明显高于健康人群[1-2],另外,T2DM是NAFLD进展为非酒精性脂肪肝炎(nonalcoholic steatohepatitis, NASH)和进展性肝纤维化的危险因素之一[3-5],NASH在10~15年内进展为肝硬化高达15%~25%[6]。肝脏脂肪变及肝脏纤维化的早期诊断和评估,对及时治疗和控制病情进展具有重要意义。近年,中性粒细胞/淋巴细胞比值(neutrophil/lymphocyte ratio, NLR)作为主要炎症标志物之一备受关注。与其他白细胞亚型相比,NLR更稳定,且更容易获得。据报道,NLR与糖尿病的多种并发症相关[7-8],并与多种肝病相关[9-10]。研究表明,NLR可作为预测多种疾病严重程度的无创性新指标,且已被应用于与肿瘤及急性冠状动脉综合征患者的预后评估[11],但有关NLR与T2DM合并NAFID的报道少。本研究拟探讨NLR与T2DM合并NAFLD的相关性,以了解NLR对T2DM合并NAFLD的预测价值。
1 资料与方法
1.1 一般资料 回顾性分析2018年1月至2019年4月安庆市第一人民医院住院的430例T2DM患者的临床资料。纳入标准:T2DM患者,年龄>18岁。排除标准:排除病毒性肝炎、自身免疫性肝病、肿瘤、糖尿病严重并发症及其他急慢性炎症等;1个月内使用他汀类等可能损肝药物的患者。T2DM诊断符合1999年WHO标准[12]。NAFLD的诊断标准采用2010年中华医学会肝病学会NAFLD诊断标准[13]:肝脏影像学表现符合弥漫性脂肪肝的诊断标准且无其他原因可供解释,和/或有代谢综合征相关组分的患者出现不明原因的血清ALT和/或AST、GGT持续增高半年以上。根据彩超检查有无脂肪肝将研究对象分为T2DM合并NAFLD组(NAFLD组,177例)和T2DM不合并NAFLD组(n-NAFLD组,253例)。NAFLD组中男性112例,女性65例,平均年龄 (49.63±3.56)岁;n-NAFLD组中男性134例,女性119例,平均年龄(55.18±12.4)岁。
1.2 实验室检查 所有患者均于入院第2天早晨6∶00~7∶00抽取静脉血和餐后2小时静脉血,使用自动血液分析仪(XE-2100),检测白细胞数(white blood cell,WBC)、中性粒细胞数(neutrophil,Neut)和淋巴细胞数(lymphocyte,Lym);采用全自动生化分析仪(Beckman Unicel Dxc800)检测空腹血糖(fasting plasma glucose,FPG)、空腹C肽(fasting C-peptide,FCP),餐后2小时血糖(2 hour postprandial blood glucose,2 h PBG)、谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)、总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-c)、尿酸(uric acid,UA);采用Arleray HA-8160全自动糖化血糖分析仪检测糖基化血红蛋白(hemoglobin A1c,HbA1c)。计算NLR,NLR=中性粒细胞数/淋巴细胞数。所有血清指标均进行了评估及实验室质量控制。采用稳态模型法评估基础状态胰岛素抵抗,HOMA 胰岛素抵抗指数(HOMA insulin resistance index,HOMA-IR)=FPG×Fcp/22.5。
1.3 肝脏检查
1.3.1 超声检查 用彩超了解是否存在脂肪肝,超声仪器为飞利浦IE33,由经过统一培训的2名超声医师操作。超声具备以下3项表现中的2项者为弥漫性脂肪肝[13]:①肝脏近场回声弥漫性增强(“明亮肝”),回声强于肾脏;②肝内管道结构显示不清;③肝脏远场回声逐渐衰减。
1.3.2 肝硬度及肝脏脂肪衰减测定 用FibroScan(法国Echosens公司)检测肝脏硬度及脂肪衰减情况,由 2 名经过专门培训的操作医师严格按照仪器使用手册进行操作。患者取仰卧位,双手抱头,探头与皮肤表面垂直,选择肝左右叶为检测区域,连续有效检测 10 次以上,取中位数为最终测定结果,以肝硬度值(liver stiffness measurement,LSM)和脂肪衰减指数(controlled attenuation parameter,CAP)表示。最终检测成功率>60%且四分位数间距低于测量值中位数 1/3为有效测量。
1.4 观察指标 包括体质量指数(body mass index BMI)、收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)、HbA1C、FPG、2 h PBG、FCP、TC、TG、LDL-c、WBC、NLR、UA、ALT、CAP、LSM和HOMA-IR。

2 结果
2.1 两组患者临床基本资料及实验室检查结果比较 NAFLD组患者的年龄低于n-NAFLD组,差异有统计学意义(P<0.05);两组糖尿病病程差异无统计学意义(P>0.05),但NAFLD组患者BMI、TG、2 h PBG、HOMA-IR、WBC、NLR、ALT、CAP、LSM均高于n-NAFLD组,差异有统计学意义(P<0.05)。见表1。
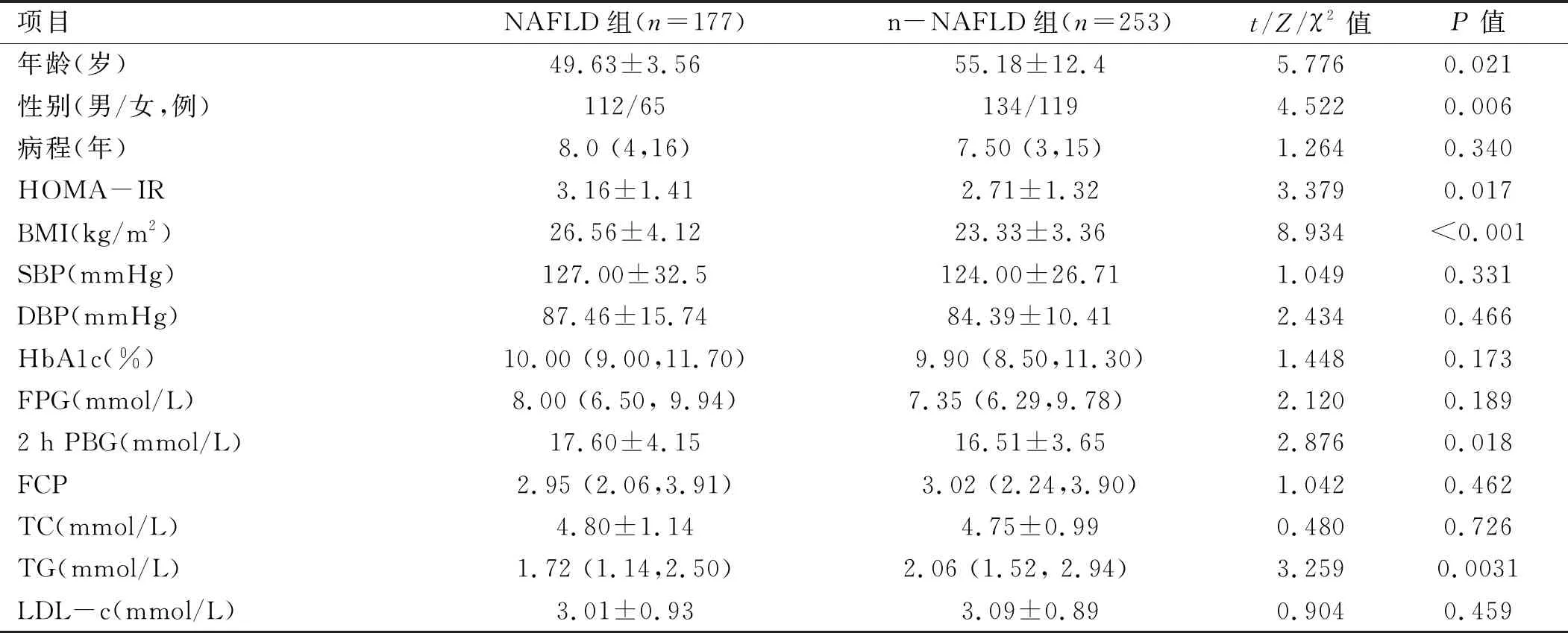
表1 两组患者临床基本资料及实验室检查结果比较
续表1

项目NAFLD组(n=177) n-NAFLD组(n=253) t/Z/χ2值P值WBC(×109/L)7.29±1.406.57±1.435.178<0.001NLR2.20 (1.74, 2.97) 1.51 (1.12,2.08) 4.631<0.001UA(mmol/L)336.5 (283.00,439.25) 329 (270.00,374.00) 2.3400.058ALT(U/L)58.56±39.9333.24±10.459.628<0.001AST(U/L)42.23±15.1237.76±15.650.9550.513CAP(db/m)286±63214±2316.669<0.001LSM(kp)10.87±3.406.63±2.5614.740<0.001
注:BMI为体质量指数,SBP为收缩压,DBP为舒张压,HbA1c为糖化血红蛋白,FPG为空腹血糖,2 h PBG为餐后2小时血糖,FCP为空腹C肽,TC为总胆固醇,TG为三酰甘油,LDL-c为低密度脂蛋白胆固醇,WBC为白细胞总数,NLR为中性粒细胞/淋巴细胞比值,UA为血尿酸,ALT为谷丙转氨酶,AST为谷草转氨酶,CAP为脂肪衰减指数,LSM为肝硬度值,HOMA-IR为HOMA胰岛素抵抗指数
2.2 NLR与相关因素的相关性分析 NLR与各因素进行Pearson相关分析, NLR与年龄、HbA1C、TG、TC、LDL-c、2 h PBG、CAP、ALT和LSM呈正相关。见表2。
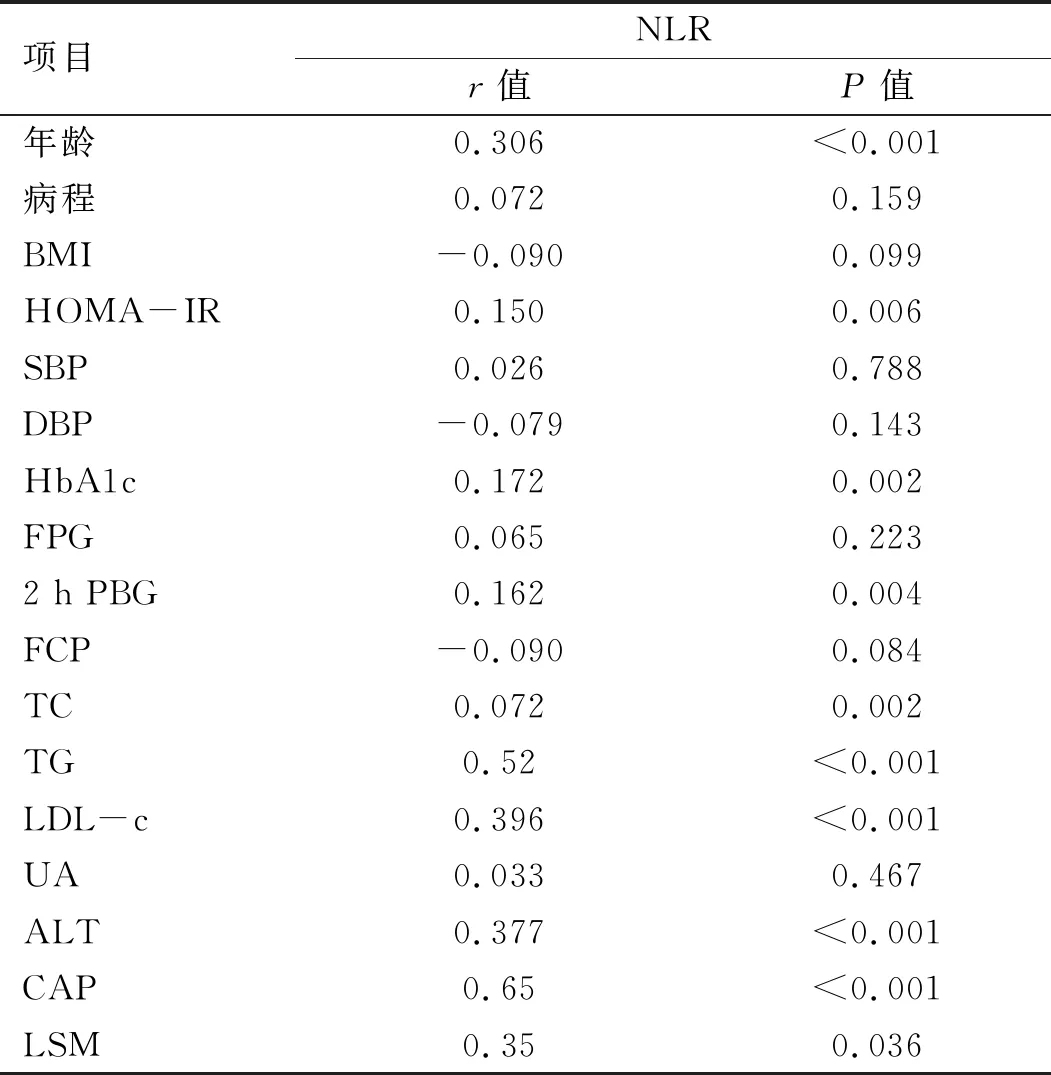
表2 NLR与相关因素的Pearson相关分析
注:BMI为体质指数,HOMA-IR为HOMA胰岛素抵抗指数,SBP为收缩压,DBP为舒张压,HbA1c为糖化血红蛋白,FPG为空腹血糖,2 h PBG为餐后2小时血糖,FCP为空腹C肽,TC为总胆固醇,TG为三酰甘油,LDL-c为低密度脂蛋白胆固醇, UA为血尿酸,ALT为谷丙转氨酶,CAP为脂肪衰减指数,LSM为肝硬度值
2.3 T2DM合并NAFLD与相关因素的logistic回归分析 以 T2DM 是否合并 NAFLD 为因变量(是=1,否=0),以上述有统计学意义的指标(性别:男=0,女=1;其余为连续型变量)为自变量,进行逐步logistic回归分析。结果显示,HOMA-IR、ALT、BMI、TG、NLR是T2DM合并NAFLD的独立危险因素。见表3。
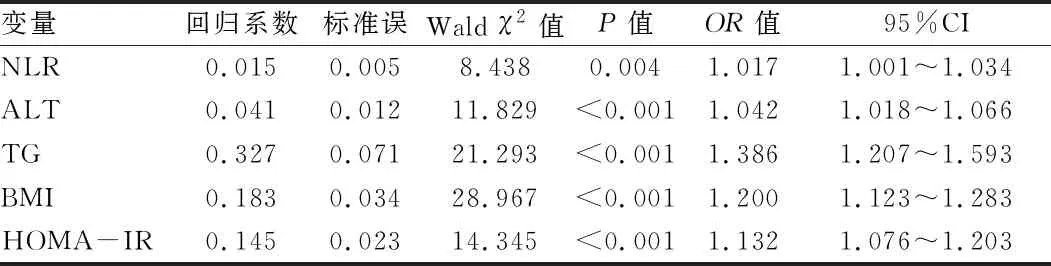
表3 2型糖尿病患者NAFLD危险因素分析
注:NLR为中性粒细胞/淋巴细胞比值,ALT为谷丙转氨酶,TG为三酰甘油,BMI为体质量指数,HOMA-IR为HOMA胰岛素抵抗指数
2.4 NLR诊断T2DM合并NAFLD的ROC的曲线分析 T2DM合并NAFLD患者,NLR的ROC曲线下面积为0.873,相对应的95%CI为0.809~0.940。NLR的最佳截断值为1.88时,对T2DM合并NAFLD的诊断敏感性为90.5%,特异性为53.6%。见图1。
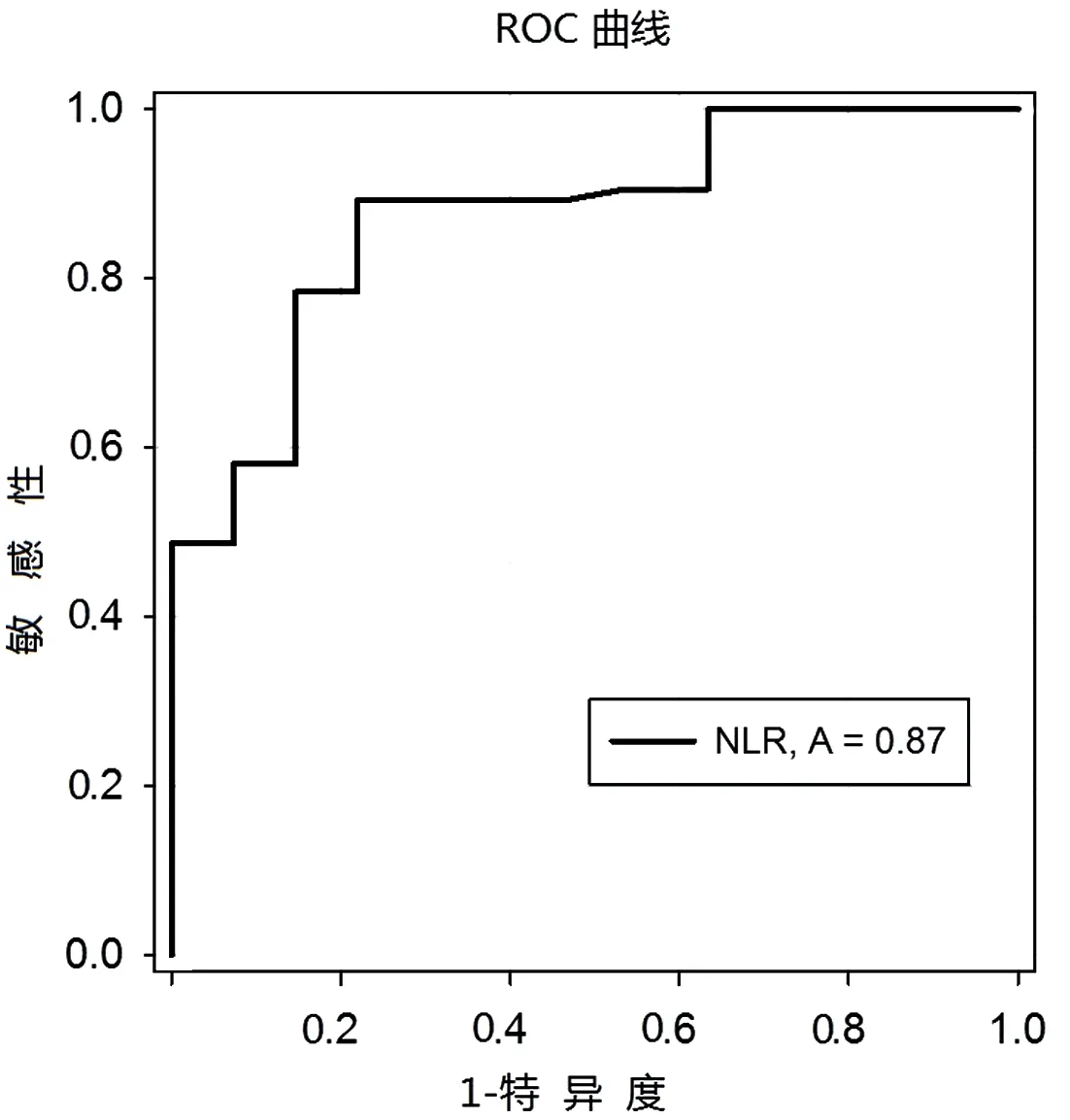
图1 NLR预测2型糖尿病合并NAFLD的ROC曲线
3 讨论
NAFLD是一个临床病理生理综合征,包括单纯的脂肪变性、非酒精性脂肪肝炎(nonalcoholic steatohepatitis, NASH),以及相关肝硬化和肝细胞癌[14-15]。它是21世纪全球重要的公共健康问题之一,亦是我国愈来愈重视的慢性肝病问题[16]。随着人民生活水平的改善,乙肝疫苗的广泛使用,病毒感染导致的肝脏疾病呈逐渐减少趋势[17],而NAFLD的患病率逐渐增加[13],发达地区发病率可达15%左右[16]。在代谢性疾病患者中,发病率更高,有研究[14-15]显示,在糖尿病患者中NAFLD的发病率可达28%~55%。本研究结果显示,住院T2DM患者NAFLD的患病率为41.2%,与周健等[18]研究结果一致。本研究结果提示,T2DM合并NAFLD组患者平均年龄(49.63±3.56)岁,显著低于n-NAFLD组的(55.18±12.4)岁,提示在T2DM患者中NAFLD的发病也更加年轻化。而T2DM合并NAFLD 与HOMA-IR和BMI显著相关,因此对T2DM患者进行NAFLD常规筛查非常必要。
临床上检测脂肪肝的方法较多,但均有一定缺点,如肝活检是评估NAFLD病变程度的“金标准”,但其有创性及潜在并发症等限制了临床使用;B超和CT临床使用较多,但敏感性差;MRI敏感性好,费用又较高;肝脏弹性回声瞬时成像是近年兴起的一种评估肝脏脂肪变及纤维化的一种设备,研究[19]显示,肝脏弹性回声瞬时成像测定对NASH及纤维化NASH的诊断均具有良好的诊断效能,与肝穿刺病理分期一致性好。研究[13]显示,慢性炎症状态可能在 NAFLD 进展为NASH及肝脏纤维化过程中发挥重要作用,已有多个炎症因子被证实可作为NASH潜在的生物标志物。外周血 NLR 为亚临床炎症的指标,可通过血常规白细胞分类检查容易获得。本研究结果提示,与未合并NAFLD的患者相比,T2DM合并NAFLD患者的NLR明显升高。进一步行相关性分析发现,NLR与CAP、LSM、ALT呈明显正相关。提示NLR越高,肝脏发生脂肪肝炎或纤维化可能越大,并且NLR随着NAFLD患者组织病变严重程度的增加而增高。之前的研究[20]也表明,NAFLD的炎症反应是由胰岛素抵抗、基因多态性、系统脂毒性产物、大量的炎性因子、肠道微生物和氧化应激等多种因素共同导致的。NLR反映机体整体的炎症状态,中性粒细胞介导炎症反应,淋巴细胞负责免疫调节。因此,当NLR值增加时,机体炎症反应越重,发生NASH和肝纤维化的可能性更大。这与Abdel-Razik等[9]的研究一致,该研究发现NLR和NAFLD活动评分、促炎性细胞因子和CRP呈正相关。另有研究[21]显示,脂代谢紊乱、肥胖和高血压是糖尿病合并脂肪肝的独立危险因素。本研究通过回归分析发现,NLR与HOMA-IR、BMI、TG一样,是T2DM合并NAFLD的独立危险因素。
ROC曲线结果提示,NLR鉴别T2DM是否合并NAFLD的最佳截断值为1.88,曲线下面积为0.87,敏感性为90.5%,特异度为53.6%,这与Alkhouri等[22]研究一致。提示NLR可以作为T2DM合并NAFLD的预测指标和病情进展的监测指标。
综上所述,NLR是T2DM合并NAFLD患者的独立危险因素,可作为T2DM合并NAFLD及出现肝脏脂肪变性及纤维化进展的预测指标。

