铜绿假单胞菌LAMP快速检测方法建立及微滴数字PCR验证
李羽翡,祖 新,李羽翠,张德荣
(1.甘肃省食品检验研究院,甘肃兰州 730030;2.甘肃省中医院,甘肃兰州 730050;3.西北民族大学生物医学研究中心,甘肃兰州 730030)
铜绿假单胞菌,又称绿脓杆菌,是一种人兽共患性常见致病菌,广泛存在于土壤、水和空气以及人的皮肤、肠道、呼吸道中,属于机会性致病菌,其所产生的各种内毒素、致死性外毒素能广泛侵袭机体各个脏器、组织,引起各种病变和炎症。GB 19298-2014《食品安全国家标准 包装饮用水》,首次将其纳入了食品检验的范围,明确指出铜绿假单胞菌不得检出。GB 8538-2016《食品安全国家标准饮用天然矿泉水检验方法》也将铜绿假单胞菌列为致病菌,近两年甘肃省承担的国家监督抽查和地方日常监督、风险监测任务结果显示,瓶/桶装饮用水铜绿假单胞菌检出率高达30%。果汁饮品,尤其是未经过高温灭菌的餐饮鲜榨果汁饮品,近年来消费量日益增高,其受到铜绿假单胞菌污染的机率也明显增大。目前,微生物发酵法及PCR技术已广泛应用于铜绿假单胞菌的筛查和检测中,但传统微生物发酵法检测铜绿假单胞菌,检验周期长,且对场所、设备设施要求较高;PCR法需要电泳处理或实时荧光定量检测设备,这些均不利于推广及大批量筛查,也不能应用于餐饮环节及销售现场。因此开发一种高效、便捷、灵敏的铜绿假单胞菌快速识别方法很有必要。
环介导等温扩增技术(LAMP)是近年来发展迅速的一种新型基因扩增方法,其原理是利用特异识别靶序列上6个位点的4条(或6条)引物和具有链置换活性的Bst DNA聚合酶,在等温条件下进行核酸扩增[1]。与传统核酸检测技术相比,其操作简便、只需要一种酶,扩增效率高,反应产物量大,适合简易性检测[2],近年来被广泛应用于食源性致病菌检测[3-5]、食品转基因成分检测[6-7]、食品过敏原成分检测[8-9]、动物源性成分检测[10-12]及微流控芯片领域[13]。
微滴式数字PCR是近年来发展起来的、优于实时荧光定量PCR的第三代PCR技术[14-16],在病源微生物的检测及鉴定方面应用广泛。其原理是在PCR扩增前将待测样品核酸随机分配至微反应器或微滴中,每个微反应器或微滴都是一个独立的PCR反应器,理论上认为每个微反应器中含有一个待测的核酸靶分子,或不含核酸靶分子,有荧光信号响应的判定为“1”,没有荧光信号响应的判定为“0”,最后根据泊松分布原理和阳性微滴比例,计算出样品中靶序列的拷贝数或浓度,从而实现无需依赖标准曲线的绝对定量检测[17-19]。该技术耗时短、灵敏度高、特异性强,近年来被广泛应用于病毒、细菌、转基因成分、动植物源性成分检测等研究领域[20-22]。
本文基于环介导等温扩增原理,建立一种铜绿假单胞菌等温扩增PCR检测方法,并利用微滴数字PCR技术,对建立的快速检测方法进行方法验证,考察了该快速检验方法的准确度与灵敏性,以期为铜绿假单胞菌的检测提供参考。
1 材料和方法
1.1 材料与仪器
铜绿假单胞菌(ATCC15442) 广东微生物菌种保藏中心;细菌基因组DNA快速提取试剂盒 卓诚惠生;数字PCR配套试剂盒(ddPCR Supermix for Probes) Bio-Rad;营养肉汤(成分:蛋白胨、牛肉粉、氯化钠、葡萄糖) 北京陆桥;环介导等温扩增用钙黄绿素荧光染料、噬菌体DNA片断重组质粒、噬菌体扩增引物等 荣研生物科技有限公司;沙门氏菌标准菌株(ATCC14028) 广东微生物研究所;果汁饮品样品 2018.7~2019.7间,采集兰州地区市售饮料饮品共计128份,其中餐饮现制现卖鲜榨果汁饮品58份,超市商店预包装果汁饮品70份。
Nano Drop one超微量分光光度计 Thermo;QX200 Droplet Generator微滴生成仪 Bio-Rad;PX1 PCR PlateSealer快速封膜仪 Bio-Rad;88880028振荡恒温金属浴、LP Vortex Mixer涡旋混合器、MEGAFUGE 8台式冷冻离心机、900series超低温保存箱 Thermo;mini-10k微型迷你离心机 广州迪奥;SIM-F140ADL制冰机 Panasonic;移液枪1~1000 μL Eppendorf;LabcultureB2生物安全柜 ESCO;医用冷藏冷冻箱HYCD-282 Haier;Simplicity uv超纯水仪 默克密理博。
1.2 实验方法
1.2.1 DNA模板制备 菌种DNA模板制备:将-80 ℃保存的甘油菌株冻存管复苏,并接种于营养琼脂平皿,36 ℃过夜培养,挑单颗菌落36 ℃继续纯培养,使用细菌基因组DNA快速提取试剂盒提取病原菌DNA,冻存于-20 ℃备用。果汁饮品DNA模板制备:将果汁饮品分别无菌取样25 mL,加入225 mL营养肉汤培养基,36 ℃培养24 h,取增菌液1 mL提取DNA,使用细菌基因组DNA快速提取试剂盒提取病原菌DNA,冻存于-20 ℃备用。
1.2.2 引物探针设计合成 从GenBank数据库中查找铜绿假单胞菌的基因组序列,以铜绿假单胞菌rpod基因为模板,利用PrimerExplorer软件设计LAMP引物,确保引物探针之间不能形成局部配对的可能,并委托生工生物工程(上海)股份有限公司合成。本实验分别设计订购了3种引物,经验证,引物3没有引物二聚体及假阳性现象且反应时间短,最终确定引物3为实验引物,引物1和2不满足需要,舍弃不用。引物3序列见表1。

表1 铜绿假单胞菌LAMP设计引物Table 1 Primer sequence for Pseudomonas aeruginosa LAMP
1.2.3 恒温PCR反应 查阅相关文献[23-27],调整试剂浓度、比例,得到最终反应体系见表2。在60 ℃条件下恒温反应40 min,每隔10 min记录反应结果。以噬菌体DNA片断重组质粒作为反应体系的阳性对照、阴性对照,以样品提取细菌DNA为模板,按实验步骤进行恒温PCR实验操作,并以无菌去离子水为作为空白对照。实验整个反应体系总体积为25 μL,各组分含量设置如下:
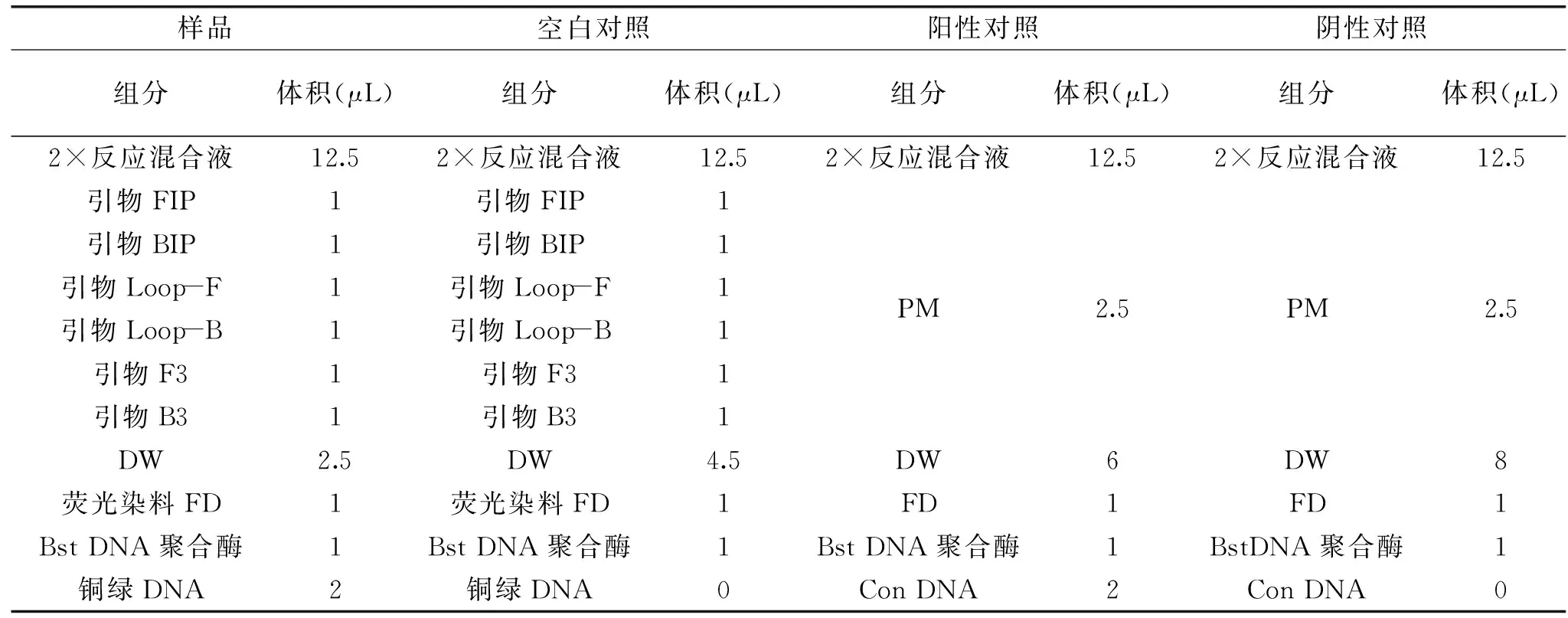
表2 环介导等温扩增反应体系Table 2 Amplification reaction system of LAMP
1.2.4 微滴式数字PCR验证实验 利用数字PCR对核酸DNA进行定性和定量验证。将浓度为1.5×106CFU/mL的铜绿假单胞标准菌菌悬液用生理盐水逐级10倍稀释,得到浓度为1.5×105、1.5×104、1.5×103、1.5×102、1.5×10 CFU/mL的菌悬液;提取菌体DNA作为对照标品,使用超微量分光光度计测定模板DNA浓度,分别为100、10、1 ng/μL,100、10 pg/μL;以果汁饮品样品提取核酸DNA为检测样品(包括2个具有显色变化的可疑阳性样品),以沙门氏菌标准菌提取DNA为样品对照,超纯水为空白对照,分别进行ddPCR。20 μL反应体系:2×ddPCR Supermix for Probe(no dUTP)10 μL,上下游引物各0.4 μL,探针0.4 μL,DNA模板4 μL,剩余用ddH2O补足[28-30]。
采用微滴生成仪对配制好的PCR反应体系进行微滴生成,每次可同时进行8个样品,耗时约2 min。将微滴生成仪器中生成好的微滴转移至96孔板中,铝箔盖住放入Bio-Rad PX1 PCR PlateSealer进行快速封膜。封膜温度180 ℃,5 s。将密封好的96孔板置于PCR仪上进行PCR扩增。反应程序为:95 ℃,30 s,预变性,然后进行循环反应:94 ℃,30 s(变性);60 ℃,60 s(退火、延伸、数据采集);共40个循环[31-33]。
PCR扩增完成后,将96孔板转入一起配套的plate hoder中组装好,平稳地放入微滴读取仪,打开QX200 Droplet Reader进行PCR定量。数字PCR检测的阳性、阴性微滴采用泊松分布原理,检测结果用Quanta Soft软件分析。
2 结果与分析
2.1 引物筛选
LAMP技术本身的引物设计比较复杂,要针对特定靶序列上的6~8个片段设计4~6条引物,由于这6条引物均要规避突变点区域,因此对靶序列的要求高,引物设计比较复杂。但是只要设计好引物、在酶作用下就可以进行恒温扩增,对温度控制仪器没有过高要求。本研究在反应体系中加入钙黄绿素荧光染料,通过颜色变化来判定LAMP技术检测铜绿假单胞菌rpod基因。
本文使用合成的3种引物进行环介导等温扩增,观察实验反应结果。如图1所示,1、2、3号引物扩增铜绿假单胞菌DNA模板全部显色。4、5、6号孔空白扩增未添加DNA,不应该显色,但4号孔却显色了,推测在引物1后续实验中出现了引物二聚体,造成假阳性结果。7~8号孔用来检测PCR反应体系是否正确,PCR体系是否被污染,阳性孔在30 min时出现颜色变化,阴性孔整个反应过程均未出现颜色变化,反应体系正常。反应过程中引物1与引物3(1孔、3孔)显色变化需要20 min,反应中引物2(2孔)没有LoopF序列,所以反应时间较长,显色变化需要38 min。相关研究显示[23-25],LAMP的关键在于多引物之间无交叉反应且能成环,添加环引物能提高扩增效率,缩短三分之二的扩增时间。综合考虑,引物3出现颜色变化仅需要20 min,且显色反应灵敏,最终选用引物3为方法用引物。

图1 3组设计引物铜绿假单胞菌LAMP扩增显色结果Fig.1 LAMP amplification color results ofPseudomonas aeruginosa by 3 groups of primer注:1、2、3号孔分别为引物1、2、3扩增样品,模板为实验室自己提取的铜绿假单胞标准菌株DNA;4、5、6号孔分别为空白扩增,模板为去离子水;7号孔为阳性扩增,模板为噬菌体DNA片断重组质粒;8号孔为阴性扩增,不添加噬菌体DNA片断重组质粒。
2.2 样品显色结果
以引物3为实验引物,测试果汁饮品共计128份样品,发现1号样品、10号样品显色,其余126个样品均未显色,图2仅展示包含2个显色样品的同批次处理的13个样品。

图2 样品铜绿假单胞菌LAMP扩增显色结果示例Fig.2 LAMP amplification color results ofPseudomonas aeruginosa in samples注:1~13分别为1~13号鲜榨果汁饮品。
2.3 样品数字PCR定量验证
将铜绿假单胞标准菌、沙门氏菌标准菌对照以及空白分别做数字PCR扩增,如图3所示,通过微滴生成,每个样品至少生成了11000个微滴(前列阳性微滴数与后列阴性微滴数的总和),符合数字PCR反应体系生成微滴数大于10000,才可用于正常定量的要求[34-35]。本实验方法对铜绿假单胞菌有明显阴性微滴峰和阳性微滴峰。对沙门氏菌及空白对照只有阴性微滴的单峰,阳性微滴数均为0。说明本次数字PCR反应体系对铜绿假单胞菌具有特异性选择,对沙门氏菌及空白无荧光信号响应。

图3 数字PCR方法特异性验证Fig.3 Specific verification results diagram of ddPCR注:横坐标P.aeruginosa列均为铜绿假单胞标准菌,每两列为一个样品(前列为阳性微滴数,后列为阴性微滴数),每个样品做两个平行,样品标准菌浓度分别是1.5×106、1.5×105、1.5×104、1.5×103 CFU/mL,Salmonella列为沙门氏菌1.5×106 CFU/mL,blank列为空白,纵坐标为数字PCR响应微滴数。
图4为铜绿假单胞标准菌株不同浓度梯度的微滴信号响应图,阈值线上方为阳性微滴,阈值线下方为阴性微滴。初浓度1.5×106CFU/mL的铜绿假单胞标准菌以10倍比稀释,进行数字PCR扩增。如图所示,10倍梯度稀释的菌株阳性微滴信号响应值也呈梯度下降,当标准菌株浓度低于1.5×103CFU/mL时,按样品提取步骤提取的细菌模板DNA数字PCR检测不到。表明所建立的ddPCR方法对铜绿假单胞菌具有好的选择敏感性[36-37]。

图4 ddPCR检测敏感性验证Fig.4 Sensitivity test of droplet digitalPCR detecting Pseudomonas aeruginosa注:图中不同纵列代表不同浓度铜绿假单胞标准菌,G04、H04浓度是1.5×106 CFU/mL,B05、C05浓度是1.5×105 CFU/mL,G05、F05浓度是1.5×104CFU/mL,C06、D06浓度是1.5×103 CFU/mL,纵坐标为阳性、阴性微滴信号值。
图5为不同样品的数字PCR检测结果,如图所示,浓度1.5×106CFU/mL的铜绿假单胞菌数字PCR检测结果为2258、2237 copies/μL,平均值为2248 copies/μL,由于标准菌与样品DNA处理流程一致,即25 mL定容至250 mL,故稀释了10倍,所以实际应该是浓度1.5×105CFU/mL,对应copy数2248 copies/μL,以此类推,则浓度1.5×102CFU/mL铜绿假单胞菌数字PCR检测平行结果为2.1和2.9 copies/μL。
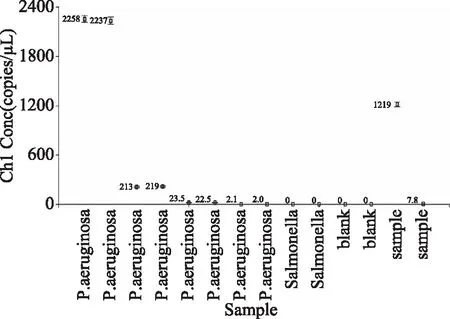
图5 样品ddPCR检测结果Fig.5 The concentration quantitative ofsample by droplet digital PCR注:该图显示样品数字PCR定量拷贝数,P.aeruginosa列均为铜绿假单胞标准菌样品,每个样品做两个平行,标准菌样品浓度分别是1.5×106、1.5×105、1.5×104、1.5×103 CFU/mL,Salmonella列为沙门氏菌1.5×106 CFU/mL,blank列为空白,sample列分别是1号果汁样品和10号果汁样品。
表3是数字PCR灵敏度、特异性测试,标准差分别为0.57、0.71、4.24、14.8,相应的RSD值在0.66%~22.8%之间,符合均小于25%的要求[38-40]。

表3 数字PCR特异性、敏感性数据Table 3 The specificity and sensitivity of ddPCR
图6显示,以铜绿假单胞菌菌悬液浓度为横坐标,以检测浓度copy数为纵坐标作图,由于数字PCR反应体系为20 μL,模板添加量为4 μL,故不同浓度菌悬液对应的平均copy值应该为分别为12.5、115、1080、11240 copies/μL,生成标准曲线y=0.07497x-9.3516,线性关系良好,R2=0.9999。
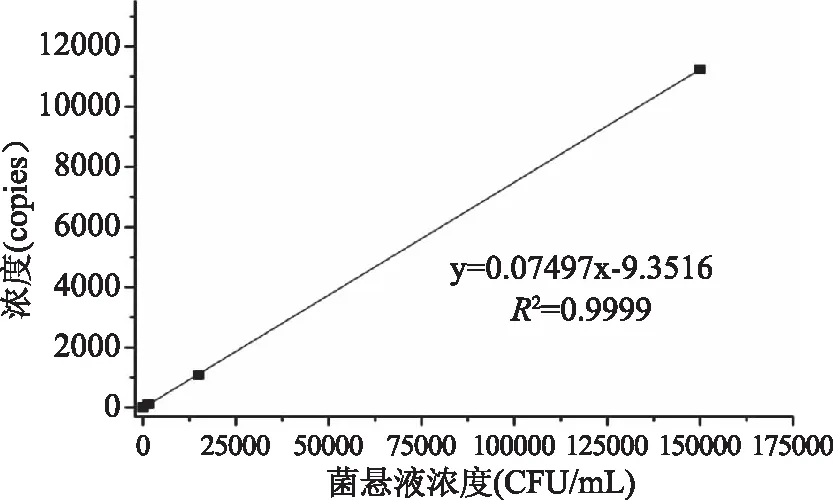
图6 ddPCR拷贝数与菌悬液浓度的线性关系Fig.6 Standard curve for copies of ddPCR and suspensionconcentration of Pseudomonas aeruginosa
表4显示LAMP快速检测方法显色的两个阳性样品,数字PCR检测值分别为1219、7.8 copies/μL,通过计算知两个样品铜绿假单胞菌的检测浓度分别为1.64×104、2.29×102CFU/mL。

表4 样品数字PCR定量结果Table 4 Quantitative verification of sample by ddPCR
3 讨论与结论
本实验建立了一种快速识别检测铜绿假单胞菌的LAMP检测方法,该方法操作快捷,从细菌核酸提取到检测判定只需100 min,设备要求仅为60 ℃恒温锅,与GB 8538-2016传统发酵法相比时间大大缩减,传统发酵法从过滤、增菌培养、生化鉴定等完成需要48 h以上[41];与荧光定量PCR相比,仪器设备要求低,成本更低,具有实际应用价值,可有效地在餐饮制备现场、产品销售场所进行铜绿假单胞菌的污染监测及推广应用。使用该LAMP快速检测方法共检测果汁饮品128份,126份未显色,2份显色。
由于LAMP快速检测方法通过肉眼识别进行判断,不能直观地对方法的特异性、灵敏度、检出限进行评价。因此采用数字PCR定量手段,完成了方法定量评价工作。数字PCR定量检测以铜绿假单胞菌悬液浓度为横坐标,以copy数为纵坐标,生成标准曲线y=0.07497x-9.3516,线性关系良好,R2=0.9999,铜绿假单胞菌检测范围1.5×102~1.5×105CFU/mL;方法灵敏度高、特异性强,标准差分别为0.57、0.71、4.24、14.8,RSD值在0.66%~22.8%之间。
对LAMP检测方法检测的58份鲜榨果汁饮品样品(包含2个呈现绿色荧光的显色样品)进行数字PCR定量验证,阳性结果与LAMP显色一致,并且沙门氏菌及空白均未成功扩增。说明该LAMP方法具有铜绿假单胞菌特异识别性。LAMP方法肉眼可见的显色样品,数字PCR定量结果下限为7.8 copies/μL,对应菌体浓度为2.29×102CFU/mL。
近年来关于LAMP方法研究食品中铜绿假单胞菌分析的文献并不多,且都是直接提取铜绿假单胞菌标准菌DNA来定最低检出限,特异性和灵敏度测试均以凝胶电泳为检测手段。李轲等[26]建立了纺织品中铜绿假单胞菌快速检测方法,铜绿假单胞菌灵敏度为4.5 CFU/mL,但模板提取使用了商品化免疫磁珠进行富集。文霞等[27]检测化妆品中铜绿假单胞菌灵敏度为62.5 pg/L,阳性样品检出限为1×102CFU/mL。刘伟等[23]检测36株铜绿假单胞菌标准菌株,灵敏度达到2.2~3.5 CFU/100 g。姜丽丽等[25]检测医院临床样品水貂绿脓杆菌,标准菌株灵敏度为1 ng/μL,阳性样品检出限为1.67×102CFU/mL。本方法检测食品中铜绿假单胞菌灵敏度为1 ng/μL,阳性样品检出限为1.5×102CFU/mL。且食品较其他样品,基质复杂,干扰性强,因此综合判定,本方法成本低、耗时短、灵敏度高,检出限低,益于推广应用。

