还原型谷胱甘肽纳米脂质体的修饰及稳定性评价
魏竹君,于少轩,杨 武,王善钰,宋元达
(山东理工大学农业工程与食品科学学院,山东淄博 255000)
还原型谷胱甘肽(glutathione,GSH)是由L-谷氨酸、L-半胱氨酸和甘氨酸组成的含活性巯基的三肽,在生物体内广泛存在且具有多种重要的生理功能,如抗氧化、解毒、消除疲劳、延缓衰老、预防糖尿病和癌症以及参与体内三羧酸循环和糖代谢等[1]。近年来,GSH也被广泛地应用于食品工业。例如,它可以作为营养调节剂被添加到肉制品中,增强肉类的风味;也可以作为抗氧化剂被添加到酸奶、婴儿食品以及蔬菜类食品中,防止食品发生氧化、褐变等不良反应,保持其原有的营养价值[2]。但是GSH稳定性较差,容易被氧化,而且不易透过细胞膜,生物利用率较低,因此,其在食品中的应用受到了限制。
脂质体是由磷脂双分子层组成的一种有效传递系统,可用于包埋亲水性和疏水性成分,具有靶向、缓释、降低毒性和提高药物的稳定性等作用[3]。由于其独特的分子结构和理化性质,脂质体被广泛应用于化妆品、食品、医药等领域。然而,脂质体在贮藏过程中其结构容易受到光照、酸、碱等的破坏,出现颗粒絮凝、粒径变大、药物释放等问题[4];另外,作为口服制剂的脂质体在体内消化吸收过程中,容易受到酸和酶的影响,使脂质体磷脂壁发生水解,磷脂双分子层受到破坏,从而使被包埋的物质泄漏出来,这些问题大大限制了脂质体的实际应用[5-6]。研究表明,对脂质体表面进行修饰可以提高其稳定性,且目前已有大量关于壳聚糖[7]、聚乙二醇[8]、蛋白质[9]等单一聚合物修饰脂质体的研究报道。但由于修饰过程中脂质体与修饰层间的结合力较弱,结构松散,所形成的单层修饰的脂质体的贮藏稳定性并不理想[10-11]。因此需要双层或多层修饰来提高其稳定性。
壳聚糖和海藻酸钠作为天然的聚阳离子型多糖和聚阴离子型多糖,具有良好的生物相容性、生物可降解性和黏附性,被广泛应用于活性成分包埋[12-14]。壳聚糖在酸性溶液中呈现阳离子性质,可以通过静电作用与带负电的脂质体结合,在脂质体表面形成一层保护膜[15]。Shalaby等[16]研究发现用壳聚糖修饰的脂质体比未修饰的脂质体具有更高的稳定性和更强的缓释功能。普遍认为壳聚糖修饰的脂质体是一种很有潜力的载体,能够用于包埋其他具有生物活性的功能成分,进而用于功能性食品的加工生产。Haidar等[17]用海藻酸钠和壳聚糖对牛血清蛋白脂质体进行修饰测定其贮藏稳定性,研究结果表明海藻酸钠-壳聚糖双层修饰脂质体能够大大增强其稳定性。Sliva等[18]通过海藻酸钠-壳聚糖对姜黄素脂质体进行了双层修饰,并且发现,在模拟体外消化过程中,被修饰的姜黄素脂质体具有更高的抗氧化能力,并且能够减少脂质体的消化程度,增加其稳定性,延长其体内外循环时间。但是消化过程中的脂质体的缓释机制尚未被研究。
在药物运载体系中,药物释放通常是一个很复杂的过程,受到众多因素的影响,如药物扩散、溶蚀作用、不同机制之间相互作用[19]等。而脂质体的释药过程往往是由几种机制相互作用、共同控制的。而且在不同释药阶段,每种释药机制的贡献大小也会存在差异。因此,通过引入合适的动力学模型,对脂质体的药物缓释机理进行深入研究对脂质体的应用具有重要指导意义。
本研究利用壳聚糖和海藻酸钠正、负电荷的静电作用层层交替对制备的GSH脂质体进行了双层修饰,构建出了壳聚糖-海藻酸钠双层修饰的GSH纳米脂质体。通过考察脂质体粒径、分散系数、电位的变化,以及脂质体修饰前后的贮藏稳定性和体外消化稳定性,表征了壳聚糖和海藻酸钠修饰对脂质体的影响,利用各种数学模型分析了脂质体在体外模拟胃肠道消化环境中释放GSH的可能机理。
1 材料与方法
1.1 材料与仪器
还原型谷胱甘肽 山东金城生物药业有限公司;大豆卵磷脂、胃蛋白酶(酶比活力:1∶15000)、胰蛋白酶(酶比活力:1∶2500) 上海麦克林生化科技有限公司;胆固醇、还原型谷胱甘肽含量检测试剂盒 索莱宝生物科技有限公司;吐温80、壳聚糖、海藻酸钠 国药集团化学试剂有限公司;其余常规试剂 均购自国药集团化学试剂有限公司。
Zetasizer Nano-ZS90纳米粒度及电位分析仪 英国马尔文仪器有限公司;UV-2600紫外分光光度计 日本岛津公司;Multiskan FC型酶标仪 赛默飞世尔(上海)仪器有限公司;RE-52AA旋转蒸发仪 上海亚荣生化仪器厂;FE20pH仪 梅特勒-托利多仪器(上海)有限公司;KYC-100B恒温培养摇床 上海新苗医疗器械制造有限公司;FG-18磁力搅拌器 巩义市予华仪器有限责任公司;KQ-700E超声波清洗器 昆山市超声仪器有限公司;JY99-ⅡD超声破碎仪 北京佳源兴业科技有限公司;傅里叶变换中红外光谱仪 美国热电尼高力仪器公司;场发射扫描电子显微镜Apreos 美国Thermo公司;真空冷冻干燥机 美国Labconco公司。
1.2 实验方法
1.2.1 GSH纳米脂质体(Lip)的制备 Lip的制备参考Lasic[20]的制备方法,并在其基础上进行改进。将大豆卵磷脂、胆固醇和吐温80按照质量比为4∶1∶1.6的比例加到15 mL无水乙醇中使得胆固醇的浓度为4.17 mg/mL,将混合溶液倒入圆底烧瓶,并在50 ℃、0.1 MPa条件下旋转蒸发30 min,以除去有机相并在瓶壁形成均匀透明的薄膜。然后向圆底烧瓶加入20 mL溶解有80 mg GSH的PBS溶液(0.05 mol/L,pH6.0),在50 ℃、常压条件下继续旋转水合30 min,将薄膜洗脱下来,然后将洗脱下来的溶液在冰浴中超声10 min,静置2 h,得到GSH纳米脂质体溶液,所得的样品于4 ℃保存。
1.2.2 Lip的双层修饰 将1 mL Lip溶液加到1 mL注射器中,然后按照体积比为1∶1的比例逐滴缓慢地滴加到pH6.0的壳聚糖溶液(0.1 g/100 mL)中,边搅拌边加入,待Lip溶液滴加完全后,将得到的混合溶液静置2 h,使壳聚糖充分包裹到纳米脂质体表面,即得到壳聚糖修饰的GSH纳米脂质体(CH-Lip)[21]。
将上述制得的CH-Lip置于注射器中,按照体积比为1∶1的比例逐滴滴加到pH6.0的海藻酸钠溶液(0.1 g/100 mL)中,边搅拌边加入,待CH-Lip溶液滴加完全,静置2 h,即得双层修饰GSH纳米脂质体(AL-CH-Lip),所得的样品于4 ℃下保存。
1.2.3 粒径、分散系数和Zeta电位测定 取1 mL AL-CH-Lip样品、CH-Lip样品和Lip样品,分别用超纯水稀释3、5和10倍,然后用电位-粒度分析仪测定三种样品的粒径、分散系数和Zeta电位,测定条件为20 ℃,磷脂和分散介质的折射率比值为1.330[22]。每个样品平行测定三次以上。
1.2.4 微观形貌观察 将AL-CH-Lip样品、CH-Lip样品和Lip样品分别用超纯水稀释3、5和10倍,然后滴加到硅片上,自然风干过夜,真空喷金镀膜,最后在扫描电子显微镜下进行观察。
1.2.5 红外光谱表征 将一定体积的Lip样品、CH-Lip样品和AL-CH-Lip样品在真空冷冻干燥机中冻干后,称取1 mg样品与150 mg KBr在玛瑙研钵中研磨混合,并置于模具中压成透明薄膜[23],然后将薄膜放到进行红外光谱分析仪中测定,扫描范围为400~4000 cm-1。
1.2.6 Lip包埋率的测定 精密量取脂质体100 μL,加入500 μL蒸馏水3000 r/min离心10 min,再加入200 μL蒸馏水离心10 min,精密量取超滤离心管外液体100 μL稀释10倍[24],利用GSH含量检测试剂盒测得游离GSH含量,按式(1)计算包埋率。

式(1)
式中:Wtotal为制备时加入的GSH总量,mg;Wfree为测得的游离GSH的量,mg。
1.2.7 贮藏稳定性试验 将Lip、CH-Lip、AL-CH-Lip贮藏于室温条件下,并于第1、3、5、7、9、11、25、39、60 d取样,测定释放到溶液中的GSH的量,并根据式(2)计算GSH释放率。

式(2)
式中:Et为时间t测定的游离GSH浓度,mg/mL;E0为0 d时测定的游离的GSH浓度,mg/mL;Etotal为制备时GSH的浓度,mg/mL。
1.2.8 体外消化稳定性研究
1.2.8.1 模拟消化液的制备 参考Dupont等[25]的方法配制模拟胃液和模拟肠液。
模拟胃液:称取2 g氯化钠溶解于10 mL蒸馏水中,量取7 mL市售浓盐酸溶液,混合均匀后,用0.1 mol/L盐酸溶液调节pH至1.2后定容至1 L容量瓶中。其中,胃蛋白酶在消化实验开始时加入,其质量浓度为3.2 mg/mL。制备完成的溶液贮藏于4 ℃。
模拟肠液:称取6.8 g磷酸氢二钾溶于蒸馏水中,然后准确量取190 mL浓度为0.1 mol/L的氢氧化钠溶液,混合均匀,然后用0.01 mol/L氢氧化钠溶液调节pH至7.4后定容到1 L。胰酶和胆汁在消化实验开始时加入,其中,胰蛋白酶的质量浓度为3.2 mg/mL,胆汁浓度为0.2 mg/mL。制备完成的溶液贮藏于4 ℃。
1.2.8.2 体外模拟胃、肠单独消化 分别将Lip、CH-Lip、AL-CH-Lip与模拟胃液或模拟肠液分别按照1∶3、2∶3、4∶3体积混合,在37 ℃、95 r/min摇床中孵育以模拟消化反应,以酶加入的瞬间作为反应的开始时间,每隔一定消化时间取样分析,取样时间为0、5、15、30、60、120、240 min[26-27]。测定样品中GSH的含量,并根据式(3)计算。每个样品平行测试三次。

式(3)
式中:Em为时间m分钟时测定的游离GSH含量,mg;En为反应开始时间时测定的游离的GSH含量,mg;Etotal为制备时加入的GSH总量,mg。
1.3 数据处理
所得数据采用SPSS 20.0、Origin 8.0、DDsolver等[28]数据处理和绘图软件进行分析作图,以P<0.01为差异极显著,P<0.05为差异显著的判断标准。结果均以平均值±标准差表示。
2 结果与分析
2.1 Lip、CH-Lip和AL-CH-Lip的粒径、分散系数和Zeta电位变化
纳米颗粒的大小直接影响包埋物的载量、释放、生物利用率以及体内分布和靶向性。控制粒子的大小和获得较窄均匀的粒度分布是制备纳米颗粒的关键[7]。
由图1可知,Lip、CH-Lip和AL-CH-Lip的平均粒径分别为(77.72±0.87)、(93.81±1.56)nm和(94.44±1.71)nm,即Lip经壳聚糖单独修饰或壳聚糖和海藻酸钠双层修饰后粒径分别增大了16.09 nm和16.72 nm,初步证明了壳聚糖和海藻酸钠包裹在了脂质体表面。另外,与Lip的分散系数相比,CH-Lip和AL-CH-Lip的分散系数有一定程度增加,但其值仍小于0.4。这可能是因为壳聚糖与海藻酸钠修饰在脂质体的外层使脂质体的表面毛糙,部分未成功修饰的壳聚糖和海藻酸钠使整个体系的分布更为分散。Alshraim等[29]研究发现对脂质体表面进行壳聚糖修饰,其粒径跟分散系数也会有一定程度增大,与本研究结果相似。

图1 Lip、CH-Lip和AL-CH-Lip的粒径及分散系数Fig.1 Particle size and polydispersity index(PDI)of Lip,CH-Lip and AL-CH-Lip
Zeta电位能够衡量电荷的多少,修饰剂的存在会改变脂质体表面的带电情况,分析修饰前后脂质体的电位值可以判断修饰剂是否成功修饰在脂质体的表面。
由图2可知,Lip的Zeta电位为(-27.2±0.03) mV,经壳聚糖修饰后变为(20.47±0.65) mV,再经海藻酸钠修饰后变为(-42.57±0.91) mV。磷酸基团的存在使脂质体Zeta电位为负值,而壳聚糖携带大量的正电荷,当壳聚糖包裹于脂质体表面时,脂质体的Zeta电位变化为正值。类似地,Zhou等[30]也发现用壳聚糖对脂质体表面进行修饰时,随着壳聚糖用量增加,脂质体Zeta电位也不断增加。同理,海藻酸钠分子带有大量负电荷,也能通过静电作用紧紧包裹于壳聚糖的表面,使经壳聚糖修饰的脂质体的Zeta电位由正值变为负值[31]。Zeta电位的变化进一步证实了壳聚糖和海藻酸钠通过静电吸附的方式成功包裹在了脂质体表面。

图2 Lip、CH-Lip和AL-CH-Lip的Zeta电位Fig.2 Zeta potential of Lip,CH-Lip and AL-CH-Lip
2.2 微观形貌表征
为了了解Lip修饰前后的形貌变化,采用扫描电子显微镜(scanning electron microscope,SEM)对Lip、CH-Lip和AL-CH-Lip 3个样品进行了观察,结果如图3所示。由图3a可知,Lip为球形,在SEM下呈亮白色。壳聚糖修饰后,如图3b所示,CH-Lip仍然是球形颗粒,但其外围有一层透明状的物质,这应该是包裹于Lip外层的壳聚糖。AL-CH-Lip也呈球形,并且外层也有一圈淡淡的物质,这应该是CH-Lip上包裹的海藻酸钠(图3c)。因此,SEM结果进一步证明了壳聚糖与海藻酸钠包裹在了Lip表面。Lip、CH-Lip和AL-CH-Lip的粒径大小分布在70~100 nm范围内,与粒度仪测量的结果接近。
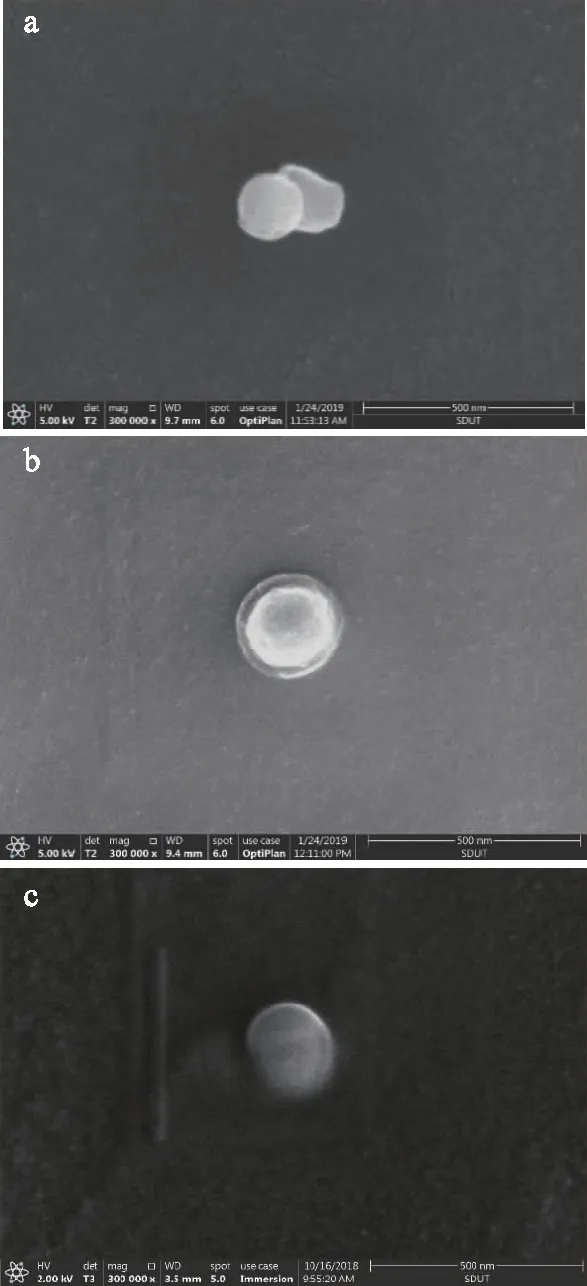
图3 Lip(a)、CH-Lip(b)和AL-CH-Lip(c)的扫描电子显微镜图像(300000×)Fig.3 SEM images of Lip(a),CH-Lip(b)and AL-CH-Lip(c)(300000×)
2.3 傅里叶变换中红外光谱表征
利用傅里叶变换中红外光谱仪可以测定Lip、CH-Lip和AL-CH-Lip的化学结构,进而推测修饰引起的化学键的变化情况,证明Lip的外层成功包裹上了壳聚糖与海藻酸钠,结果如图4所示。脂质体磷脂双分子层界面可以用C=O和P=O这两种极性基团表征。Lip的光谱中1739 cm-1为C=O的伸缩振动[32],1241 cm-1为P=O的对称振动[33],2926和2855 cm-1处的吸收峰为脂质体双分子层内部的丙烯链的对称和不对称CH2伸缩振动[34]。对比Lip、CH-Lip和AL-CH-Lip的光谱可以发现,丙烯的对称和不对称CH2伸缩振动在CH-Lip(2925和2854 cm-1)和AL-CH-Lip(2924和2853 cm-1)中基本保持不变。但是,代表C=O的吸收峰则在CH-Lip和AL-CH-Lip中分别移动至1700和1706 cm-1,说明在修饰脂质体的过程中有新的氢键的形成或者是氢键有所加强[22];另外,代表P=O基团表征的吸收峰在CH-Lip和AL-CH-Lip中出现于1235和1231 cm-1,说明壳聚糖与纳米脂质体之间有新的氢键的形成,证明壳聚糖成功的包裹在脂质体的表面。壳聚糖中的氨基的特征峰出现在1655 cm-1[35],海藻酸钠中的羧基的不对称伸缩振动的特征峰出现在1614 cm-1[36],在CH-Lip和AL-CH-Lip中这些特征峰消失,这说明壳聚糖与海藻酸钠发生相互作用,海藻酸钠成功包裹在了CH-Lip的表面。

图4 Lip、CH-Lip、AL-CH-Lip、壳聚糖和海藻酸钠的傅里叶红外图谱Fig.4 FTIR spectra of Lip,CH-Lip,AL-CH-Lip chitosan and alginate
2.4 Lip、CH-Lip和AL-CH-Lip的GSH包埋率
药物的包埋率是评价纳米颗粒质量和应用价值的重要指标,能够反映整个脂质体体系在制备过程中GSH的保留率。
由图5可知,Lip、CH-Lip和AL-CH-Lip对GSH的包埋率分别为67.5%±0.82%、85.5%±0.65%、93.5%±0.16%,即经壳聚糖修饰、壳聚糖和海藻酸钠双层修饰后,脂质体对GSH的包埋率分别增加了18.0%和26.0%。包埋率的增加可能是有两方面原因,一是壳聚糖与海藻酸钠在结合到脂质体表面的过程中,游离的GSH也被包埋到了颗粒表面;二是壳聚糖与海藻酸钠在脂质体表面形成致密的修饰层,避免了GSH的释放[37]。白春清等[38]利用壳聚糖和果胶多层修饰脂质体的结果也表明双层修饰后其包埋率会大大增加,与本研究结果相似。

图5 Lip、CH-Lip和AL-CH-Lip的包埋率Fig.5 Loading efficiency of glutathione in Lip,CH-Lip and AL-CH-Lip
2.5 贮藏稳定性
由于脂质体在贮藏过程中会出现颗粒絮凝、粒径变大、药物释放等问题,因此,修饰脂质体的贮藏稳定性是评价载体系统的重要指标之一。由图6可知,在室温贮藏过程中,随着时间不断延长,Lip、CH-Lip、AL-CH-Lip中GSH的释放率不断增加。其中,Lip的释放率最高,在常温贮藏60 d后,其GSH释放率高达16.23%±1.13%。而两种经过修饰的脂质体的释放率明显低于未修饰的脂质体的释放率,并且AL-CH-Lip的释放率最低,60 d后释放率仅为9.96%±0.99%。因此,将脂质体表面进行修饰能够明显提高其在室温下的贮藏稳定性,且双层修饰的脂质体具有更高的稳定性。

图6 Lip、CH-Lip和AL-CH-Lip中GSH在贮藏过程中的释放Fig.6 GSH release from Lip,CH-Lipand AL-CH-Lip during storage
2.6 体外消化稳定性
脂质体进入胃肠道之后很容易被强酸强碱性的消化液破坏,导致脂质体中包埋的物质泄漏,降低其生物利用度。为了表征修饰前后的脂质体对谷胱甘肽运载及吸收效果的影响,将运载谷胱甘肽的修饰前后的脂质体进行体外模拟消化实验。
由图7可知,Lip、CH-Lip、AL-CH-Lip在体外模拟胃消化过程中,GSH的释放都呈现先快后慢的趋势,但Lip的释放率明显高于两种经修饰的脂质体的释放率。在胃消化开始后60 min内,Lip的释放率达到了45.99%±2.50%,而CH-Lip与AL-CH-Lip的释放率分别为12.42%±1.04%和5.72%±1.56%。当消化时间为120 min时,三种脂质体基本达到了最大的GSH释放率,Lip、CH-Lip、AL-CH-Lip的释放率分别为48.02%±3.02%、21.90%±1.18%、7.63%±1.64%。之后,三种脂质体的GSH释放率都没有明显改变。在胃消化过程中,Lip中GSH的释放率远远高于CH-Lip和AL-CH-Lip。这可能是因为海藻酸钠能够降低胃蛋白酶的活,并且根据Cuomo等[39]研究表明,壳聚糖在胃酸中能够降低药物的释放。因此,AL-CH-Lip在胃液中具有更高的稳定性,这有利于将更多被包埋的GSH运输到小肠中。

图7 Lip、CH-Lip和AL-CH-Lip中GSH在模拟胃消化过程中的释放Fig.7 GSH release from Lip,CH-Lipand AL-CH-Lip in simulated gastric digestion
由图8可知,在体外模拟肠道消化过程中,Lip呈现一种随着时间不断增加其包裹的GSH的释放率也不断的增加的趋势,当消化时间为240 min时,其释放率到了88.81%±1.73%;而CH-Lip与AL-CH-Lip呈现的是先快速释放后进入缓慢释放的趋势,当消化时间为30 min时,CH-Lip和AL-CH-Lip基本达到了最大的GSH释放率,分别为26.14%±1.14%和8.92%±0.63%。之后,这两种脂质体的GSH的释放率都没有明显变化。因此,在模拟肠消化的整个过程中,未修饰的脂质体比修饰的脂质体释放出更多的GSH。

图8 Lip、CH-Lip和AL-CH-Lip中GSH在模拟肠消化过程中的释放Fig.8 GSH release from Lip,CH-Lipand AL-CH-Lip in simulated intestinal digestion
脂质体在肠液中对GSH的释放率明显高于其在胃液中对GSH的释放率。这可能是因为肠液中胰酶对脂质体外层磷脂的水解作用以及胆盐的增溶作用导致脂质体水解破裂[40],而释放出大量GSH。而包裹于脂质体表面的壳聚糖与海藻酸钠能够阻隔肠液中的胰酶和胆盐与脂质体外层的磷脂接触,从而保护脂质体的完整性,使被包裹的GSH不易渗出。纳米脂质体可以通过肠表面的粘膜层被吸收,据Sahay等[41]研究发现,纳米粒子可以被上皮细胞通过主动或被动运输机制直接吸收。所以,被双层修饰的脂质体能够大大提高GSH的生物利用率。
2.7 脂质体体外释放曲线拟合与释放机理
在药物释放机制的分析中经常采用的模型方程有零级释放方程、一级释放方程、Higuchi释放方程、Makoid-Banakar方程和Peppas-Sahlin方程。为了更好地理解Lip、CH-Lip、AL-CH-Lip在模拟消化过程中释放GSH的机制,通过DDsolver软件分别用上述五种释放模型对不同脂质体在模拟胃肠消化过程中GSH的释放进行了拟合。结果见表1和表2。

表1 不同脂质体在模拟胃消化道释放动力学和控释机制Table 1 The dynamics and controlled release mechanism of different liposomes in simulated gastric tract release
由表1可知,Makoid-Banakar模型和Peppas-Sahlin模型对于三种脂质体在体外模拟胃消化道释放曲线的最小信息标准(AIC)较小且模型选择标准值(MSC)较大,拟合效果较好。其中Makoid-Banakar模型拟合结果中的指数n值可以用来描述药物的释放机理:当n<0.45时,释放模型的药物是扩散型;当0.45≤n≤0.89时,释放模型的药物为扩散和溶蚀型兼有;当n>0.89时,药物释放模型为溶蚀型[42-43]。如表1中所示,Lip、CH-Lip、AL-CH-Lip经Makoid-Banakar模型拟合得到的n值分别为0.701、0.791和0.730,说明三种脂质体的释放模型均为扩散和溶蚀型兼有[44]。Peppas-Sahlin动力学方程对释药机制进行进一步研究。右边第一项表示Fick扩散作用对药物释放过程的贡献,而第二项表示基质溶蚀作用对药物释放过程的贡献即k1和k2分别表示扩散作用和溶蚀作用速率常数。如表2所示,三种脂质体的k1>k2,即GSH主要是从脂质体中扩散释放,另有一小部分GSH通过溶蚀释放。
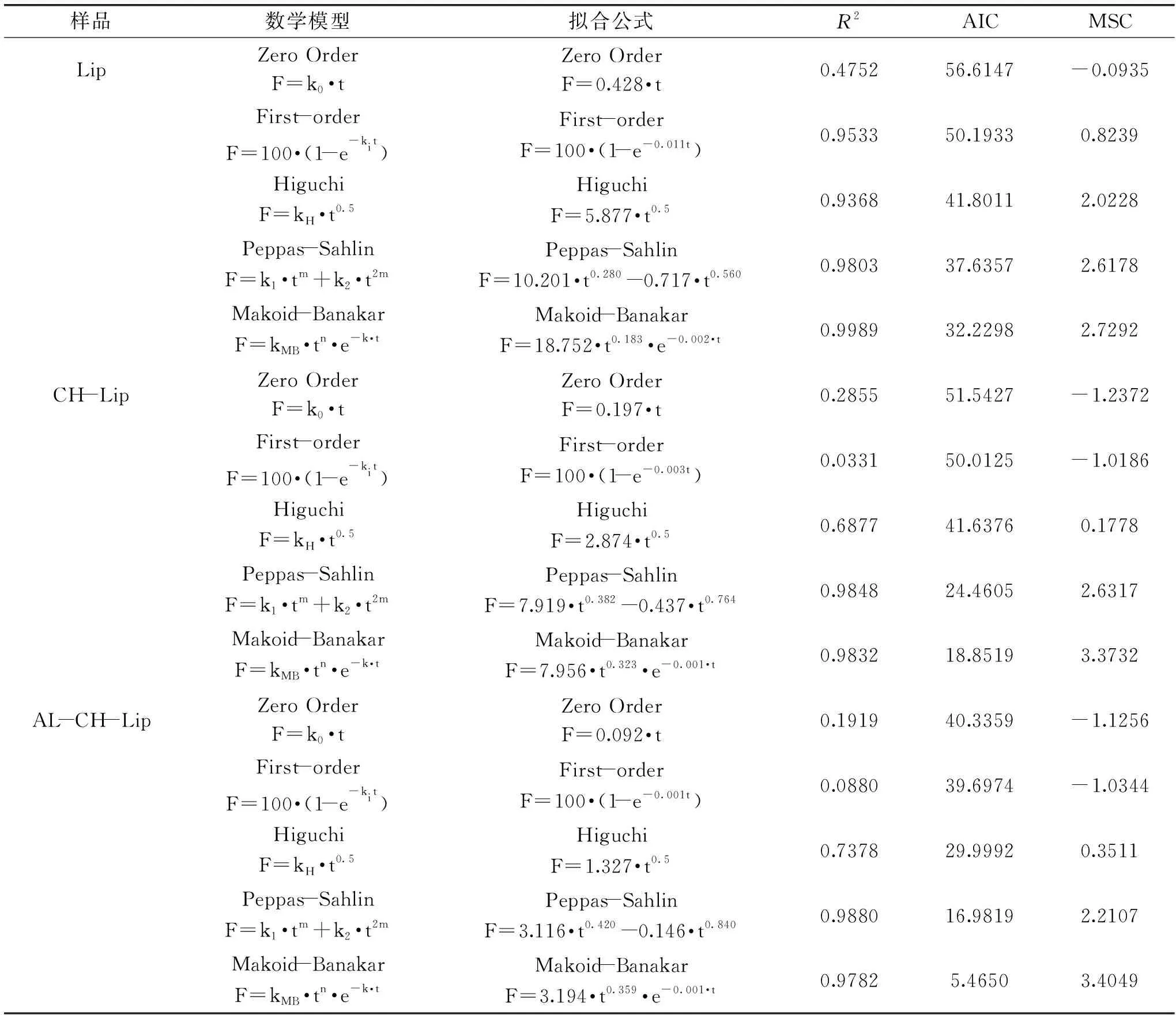
表2 不同脂质体在模拟肠消化道释放动力学和控释机制Table 2 The dynamics and controlled release mechanism of different liposomes in simulated intestinal tract release
通过引入Fick扩散贡献比(R),可以进一步评价Fick扩散作用在模拟胃消化道中GSH释放过程中贡献大小的变化。根据式(4)计算R值。
式(4)
式中:k1表示扩散作用速率常数,m2min-1;k2表示溶蚀作用速率常数,m2min-1;m表示Fick扩散指数;t表示某一时刻,min。
图9进一步考察三种脂质体在模拟胃消化道过程中各个时间点累积释放量中扩散和溶蚀所占的比例,可以发现三组脂质体释放时扩散机制所占比例均随释放时间延长而逐渐减小,但仍占据主导地位。当释放时间从0 min增加到240 min时,扩散机制所占比例从1分别减小到0.605、0.689、0.717;相反地,溶蚀机制所占的比例则相应增大,由初始0分别增大到0.395、0.311、0.283。因此,脂质体的修饰层数越多,在整个释放周期中溶蚀比例增加速度越慢,与前面海藻酸钠-壳聚糖双层修饰的脂质体在4 h内累积释放量明显低于未修饰的脂质体的释放量的结果一致,说明海藻酸钠-壳聚糖双层修饰的脂质体可以通过影响释放的溶蚀行为,起到延缓GSH的释放率。

图9 Lip、CH-Lip和AL-CH-Lip的Fick扩散贡献比RFig.9 Fick diffusion contribution ratio R of Lip,CH-Lip and AL-CH-Lip
由表2的结果可知,Makoid-Banakar模型和Peppas-Sahlin模型对于三种脂质体在体外模拟肠道释放曲线拟合较好,最小信息标准(AIC)较小,且模型选择标准值(MSC)较大。根据Makoid-Banakar模型拟合结果中的n值可以看出,三种脂质体在肠道的释放模型均是扩散型。
上述结果表明,未修饰的脂质体与被修饰的脂质体在释放GSH时存在一定差异,可能是因为修饰物在脂质体表面的壳聚糖和海藻酸钠作为扩散溶质的物理屏障,在GSH释放过程中起到了位阻作用[45]。Hasan等[46]在研究壳聚糖修饰前后的脂质体在水溶液中释放姜黄素的过程中也发现被修饰的脂质体的释放率明显低于被修饰的脂质体的释放率,与本研究结果相似。
3 结论
本实验先通过薄膜-超声法制备了GSH纳米脂质体Lip,然后用壳聚糖和海藻酸钠对其表面进行了修饰。结果表明,经海藻酸钠-壳聚糖双层修饰后,Lip的粒径从(77.72±0.87) nm增加到了(94.44±1.71) nm,Zeta电位由(-27.20±0.03) mV变为(-42.57±0.91) mV,GSH包埋率从67.5%±0.82%增加到93.5%±0.16%。通过SEM结果可以看出,修饰前后Lip的形貌没有变化,均为球形,而且海藻酸钠与壳聚糖修饰在纳米脂质体的表面。通过傅里叶变换中红外光谱上各官能团吸收峰位置和强度变化进一步证明,海藻酸钠与壳聚糖成功修饰在了脂质体表面。贮藏稳定性与胃肠道稳定性实验结果表明,海藻酸钠-壳聚糖双层修饰显著增强了GSH纳米脂质体的稳定性,使其在胃肠道中释放GSH的速率显著降低。因此,在复杂的食品加工体系中,使用壳聚糖-海藻酸钠双层修饰的脂质体可以避免GSH的过快释放,增加GSH的稳定性,从而促进胃肠道细胞对GSH的吸收,增加食品的营养价值。该研究结果为海藻酸钠-壳聚糖双层修饰的GSH纳米脂质体在食品领域中的应用提供了参考依据和一定的数据支持。

