糖尿病小鼠视网膜脉管系统分离铺片技术的改进与注意事项
姜逸,胡娜,袁琳,方龙娟,林敏,陆敏,钟霄毓,陆雄
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病最常见的微血管并发症,以及全球致盲的主要因素之一[1]。糖尿病小鼠能有效的模拟DR 的典型特点,而且方便进行转基因技术操作,因此普遍被用于DR 研究[2]。视网膜消化铺片是研究DR 的关键技术之一,这种方法可以在细节上研究视网膜脉管系统[2]。但是关于视网膜消化铺片技术,由于酶的浓度、消化方法、温度、固定时间、吹打方法的不同,导致脉管系统分离存在一定难度。本研究意在通过不同的实验条件的摸索,探讨相对稳定的糖尿病小鼠视网膜脉管系统分离铺片方法以及实验过程中的关键注意事项。
1 材料与方法
1.1 实验动物
C57BL/6J 雄性小鼠40 只,6 周龄,体重20~25 g,来源于上海斯莱克实验动物有限公司,动物许可证号:SCXK(沪)2017-0005。于上海中医药大学实验动物中心二楼SPF 级实验室层流架内饲养,5 只/笼,温度:(22±2)℃,相对湿度:(55±5)%,照明:12 h(开灯时间7:00~19:00,关灯时间19:00~7:00),自由饮水饮食。实验小鼠的喂养和使用遵循上海中医药大学实验动物福利伦理委员会规定 (批准文号:PZSHUTCM19012504)。
1.2 试剂与仪器
链脲佐菌素(Streptozotocin,STZ)(美国Sigma 公司,批号:S0130);柠檬酸(国药集团化学试剂有限公司,批号:20180202);二水合柠檬酸三钠(国药集团化学试剂有限公司,批号:20180119);Tris 乙磺酸(德国Biofroxx 公司,批号:1115GR500);盐酸(HCL)(国药集团化学试剂有限公司,批号:20131118);胰蛋白酶(Trypsin)1:250 (德国Biofroxx 公司,批号:EZ2921B401);胃蛋白酶(Pepsin)1:3000、1:12000(大连美伦生物技术有限公司,批号:M0210A);伊红和苏木素 (上海虹桥乐翔医用试剂技术有限公司,批号:181024);罗康全活力型血糖检测仪(Accu-chek Active)(德国罗氏诊断公司);血糖试纸(德国罗氏诊断公司,批号:24678121);低温培养箱(美国Torrey Pines IN30-2);摇床(美国Labnet S2025-230V);DME 光学显微镜(香港徕卡仪器有限公司)。
1.3 方法
1.3.1 动物模型的建立 将C57BL/6J 雄性小鼠随机分为正常对照组与糖尿病模型组各20 只。适应性喂养2 周后,正常组小鼠按55 mg/kg 的剂量腹腔注射PH 4.4,浓度0.1 mol/L 柠檬酸-柠檬酸钠缓冲液(配制方法:柠檬酸2.1 g 加入蒸馏水100 ml 中配成A 液,二水合柠檬酸三钠2.94 g 加入蒸馏水100 ml中配成B 液,A、B 液按1:1 混合,测定PH 值并调整至4.4 左右,0.22 μm 滤膜过滤后使用);模型组小鼠按同等剂量腹腔注射2%STZ 溶液(使用柠檬酸-柠檬酸钠缓冲液现配避光使用)。连续注射5 d。模型组末次注射STZ 溶液后第10 d,检测空腹血糖,平均值为351 mg/ml,血糖>250 mg/ml 即为成模[3]。成模后2组均正常饲养于SPF 实验室内,3 个月后同时取材。
1.3.2 眼球取材及固定单手固定小鼠背部,拇指和食指轻压小鼠颈部,使小鼠眼球凸起,另一手用弯头镊子固定眼球根部视神经,快速取出眼球,置于液氮中冷冻。取材成功后脱颈椎处死。眼球转移至-80℃环境下保存。
1.3.3 固定方法 (1)眼杯固定法(24 h):取出冻存的眼球,用一次性不锈钢双面刀片自睫状体平坦部后面(近锯齿缘)切除角膜,将眼球后段(含视神经)用4%多聚甲醛固定液固定24 h,条件4℃;(2)眼杯固定法(12 h):眼杯制作同(1),4%多聚甲醛固定液固定12 h,条件4℃;(3)整只眼球固定法(12 h),将整只眼球在4%多聚甲醛固定液中固定12 h,条件4℃。消化前再切除角膜。
1.3.4 视网膜分离及漂洗 取培养皿(100 mm)装入适量蒸馏水,放入固定好的眼杯(或整只眼球)。用两支弯头镊子,一支固定眼杯根部视神经,另一只轻压眼杯,挤出玻璃体,随之再挤出视网膜。用大头针尖固定好视网膜中心,眼科剪将视网膜平均剪切成3瓣。然后将其放在摇床上蒸馏水漂洗2 次,每次30 min。直到视网膜颜色由微黄变白,如没有变白可适当延长漂洗时间,以防固定液残留影响染色。
1.3.5 视网膜消化方法 (1)3%、5%、8%胰蛋白酶(1:250)用0.1 M Tris-HCl(pH 7.8)缓冲液配制,消化液提前置于烘箱37℃预热10 min,每组视网膜给予预热后的消化液6 ml(六孔板每孔或35 mm 培养皿),37℃烘箱,摇床消化,隔1 h 更换一次胰蛋白酶消化液,更换时蒸馏水漂洗,吹打残余组织,消化过程为2~5 h;(2)1%、3%、5%胃蛋白酶(1:12000)+3%胰蛋白酶(1:250)联合消化,1%、3%、5%胃蛋白酶用0.2%HCl 配制,配好的消化液提前置于烘箱37℃预热10 min,每组先给予6 ml 胃蛋白酶,消化视网膜至其明显透明、松散,肉眼可见絮状物飘出。然后转移至蒸馏水漂洗,吹打残余组织,继续用3%胰蛋白酶消化1~4 h。消化结束后,将视网膜转移至蒸馏水中,用1 ml 移液枪(胶头滴管)吹打,用力轻巧均匀,直至视网膜完全清透,仅存网状结构。
1.3.6 铺片用胶头滴管将蒸馏水中的脉管网吸出,滴在粘附型载玻片上(载玻片上先滴1 滴蒸馏水),利用水的张力,使脉管自然张开,以便平铺在载玻片上。用定性滤纸吸除周边水分,然后将载玻片放入37℃烘箱,烘干备染(也可室温自然干燥)。
1.3.7 HE 染色视网膜血管铺片,无水乙醇浸泡5 s,更换试剂重复一次;95%乙醇浸泡5 s,更换试剂重复一次;蒸馏水换洗3 次;苏木素浸泡10 min;蒸馏水换洗3 次;1%盐酸酒精分化30 s;70℃水蓝化处理;伊红染液3 min;95%乙醇浸泡5 s,更换试剂重复一次;无水乙醇浸泡5 s,更换试剂重复一次;二甲苯浸泡5 s,更换试剂重复一次。自然晾干,中性树脂封片。
1.4 观察指标及内容
观察不同实验方法处理下小鼠视网膜脉管系统与周围连接组织的分离情况:(1)树枝状脉管系统是否充分暴露,是否残留纤维结缔组织和其他细胞;(2)脉管系统形态是否正常,结构是否清晰完整。
观察正常组与模型组小鼠视网膜非细胞性毛细血管、内皮细胞和周细胞之间数量与形态上的差异:(1)与正常组小鼠相比,模型组小鼠非细胞性毛细血管是否增多;(2)与正常组小鼠相比,模型组小鼠内皮细胞与周细胞数量是否减少,周细胞有无偏离血管现象。
1.5 统计学方法
采用GraphPad Prism8.0 软件进行统计分析,2 组间独立样本比较采用t 检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 不同固定方法的比较
(1)眼杯固定法(24 h):视网膜硬化明显,剥离时受外力易碎,无法完成后续操作;(2)眼杯固定法(12 h):虽可剥离出完整的视网膜,但由于固定前小鼠眼球未硬化,眼球小而光滑,切开角膜操作较难容易损失部分视网膜;(3)整体眼球固定(12 h):足以发挥固定效果,硬化后角膜容易切开,分离后易于获得相对大而完整的视网膜(表1)。

表1 不同固定方法结果
2.2 两种消化方法的比较
(1)胰蛋白酶消化法:3%和5%胰蛋白酶,消化残存组织过多,神经胶质细胞和其他细胞,还有部分纤维结缔组织均不能消化透彻,光镜下大部分区域组织完整,无法观察到暴露的视网膜血管 (图1A、1B);8%胰蛋白酶消化,在未施加外力吹打的情况下,光镜下组织明显“破开”、松散,露出藏于组织里的脉管网(图1C)。蒸馏水中用1 ml 移液枪反复吹打,借助细密的水流冲击,消化松散的组织可完全脱落,肉眼可见薄而清透的脉管网,HE 染色后可见清晰完整的视网膜脉管系统呈树枝枝样分布,内皮细胞及周细胞清晰可见。(2)胃-胰蛋白酶联合消化法:5%胃蛋白酶消化30 min 后,消化液内飘出大量絮状碎片,视网膜明显变小,稍稍施加外力(如用胶头滴管转移至蒸馏水),便崩解破碎。3%胃蛋白酶情况与5%相似,胃蛋白酶消化后,捞片困难,基本无法联合3%胰蛋白酶继续消化。残余视网膜铺片后,光镜下脉管系统结构完全破坏,只剩残余结缔组织。1%胃蛋白酶消化30 min 后,培养皿内絮状物飘出,视网膜明显变薄变透,能保持视网膜瓣完整。但联合3%胰蛋白酶消化1 h 后,HE 染色光镜下血管结构依然遭到严重破坏(图1D-1F、表2)。
2.3 8%胰蛋白酶消化获得视网膜脉管系统正常组与模型组形态学比较
此条件制备的小鼠视网膜脉管系统在HE 染色后,光学显微镜下血管束暴露充分,内皮细胞和周细胞清晰可见。与正常组相比,模型组出现较多非细胞性毛细血管(t=2.668,P=0.024),内皮细胞和周细胞减少,偏离毛细血管的周细胞增多(图2)。

表2 不同视网膜消化方法结果
3 讨论

图1 不同消化方法组织形态图(×400)。1A、1B 3%和5%胰蛋白酶消化法,可见视网膜脉管树枝样结构,但其他细胞残留过多;1C 8%胰蛋白酶化法,无其他组织残留,脉管系统清晰、完整;1D-1F 1%、3%、5%胃蛋白酶联合3%胰蛋白酶消化法,光镜下未见血管结构和细胞,仅残留纤维结缔组织
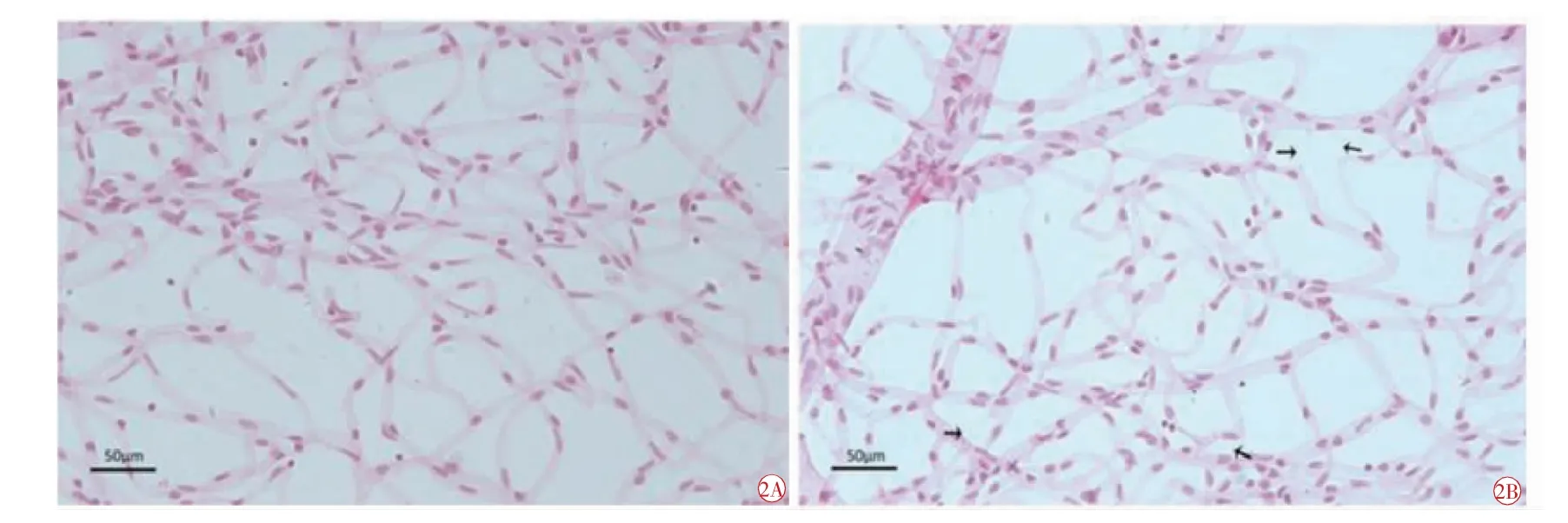
图2 正常组和模型组HE 染色后脉管系统形态图(×400)。2A 正常组,光镜下未见非细胞性毛细血管,内皮细胞和周细胞清晰可见;2B 模型组,光镜下可见较多非细胞性毛细血管(黑箭头),内皮细胞和周细胞减少
糖尿病是最常见的内分泌代谢紊乱性疾病,DR是糖尿病较为常见的并发症之一[4]。当糖耐量异常,继发视网膜损害,产生缺血、缺氧,导致眼底周围细胞受到损伤、血管微循环障碍、血管壁和血液流变学特性发生改变,并诱导新生血管的形成这一系列病理改变,从而造成视力残疾甚至失明。
本实验采用STZ 诱导的C57 小鼠作为实验模型。一方面,STZ 可直接造成胰岛β 细胞损伤,导致胰岛素分泌不足而成功诱导糖尿病,重复性和成功率较高;另一方面,相对其他实验动物,小鼠与人类基因具有较高同源性,造模后可有效模拟DR 的典型特点,同时具备成本低、体积小易操作的优势。故而本实验采用STZ 诱导的糖尿病小鼠进行DR 的相关研究。
通过小鼠视网膜血管分离及铺片技术,可以直观的看到糖尿病视网膜微血管结构,细胞状态及病理状态下的增生及改变,且成本低廉,对于糖尿病视网膜病变的研究是非常有意义的[5-6]。目前,国内外已有许多研究采用了这种技术,但细节描述过于粗糙,对于初次探索的研究者来说有一定困难。也有一些学者发表了类似文章,介绍这种技术的具体操作,但仍然存在一些问题,一是年代久远,细节无法考证;二是大多实验对象是糖尿病大鼠,大鼠和小鼠眼球实际差异较大[7-9]。笔者在探索这一技术的过程中,通过多种实验方法,探索出适用于糖尿病小鼠视网膜消化铺片的稳定的实验条件。
3.1 固定时间
有研究表明在进行视网膜血管消化铺片前,组织至少要固定48 h 以上。甚有结果显示4%甲醛固定2d 和3 个月成片效果相同[10-11]。在Cogan 和Kuwabara的报道中[8],已成功分离出在福尔马林固定液(5%~10%甲醛)中浸泡多年的眼球视网膜血管网,认为福尔马林固定时间对后续消化没有影响。初期本实验使用4%多聚甲醛固定24 h,切开角膜以便固定液充分浸润视网膜。然而使用这种方法固定,分离出来的视网膜硬化、转移过程中极为易碎,不利于后续操作。遂缩短为12 h,切开角膜固定眼杯。操作几次后发现,由于固定前切开角膜取眼杯,眼球未硬化,分离角膜容易损伤内里的视网膜,不利于获取完整的、相对较大的视网膜。最后考虑到文献所载固定方法多为糖尿病大鼠眼球,与其相比小鼠眼球体积小、组织薄,固定液易于浸润到眼球内,最终改为4%多聚甲醛整体固定12 h,硬化后切开分离,操作简便,视网膜完整,为后续消化出视网膜血管争取到更大的操作范围。
3.2 消化方法的选择
本实验进行前查阅相关文献,诸多研究报道,胃-胰蛋白酶联合消化最佳[12-15],但每篇文献报道的联合消化时间不同,且常用胃蛋白酶有两种不同的酶活性3000 U/g 和12000 U/g。最初我们采取3%胰蛋白酶(1:250)单独消化和5%胃蛋白酶(1:3000)+3%胰蛋白酶(1:250)联合消化法进行对比,以确定最佳消化方法。在整体消化时间一样的情况下,联合消化法与3%胰蛋白酶单独消化相比没有任何优势。于是使用酶活性更高的5%胃蛋白酶(1:12000)联合消化,胃蛋白酶消化以30 min 为时间节点,观察视网膜状态。然而实际观察30 min 后,视网膜瓣崩解破碎,无法捞片完成后续操作。后胃蛋白酶(1:12000)浓度降低至3%消化30 min,情况同前,无法保持视网膜瓣完整,勉强捞片完成后续操作,消化过度仅残留结缔组织而无血管结构。最后降低至1%消化30min,视网膜瓣明显变薄,但整体完整,消化1 h 后肉眼见视网膜薄而清透,为防止同前消化过度破坏结构,遂漂洗后继续联合胰蛋白酶消化1 h。结果显示结构明显被破坏。本结果与何洁等[13]的报道不一致,可能是因为实验对象不同,大鼠视网膜组织较厚,而糖尿病小鼠视网膜相比大鼠要单薄的多,组织结构极易被胃蛋白酶破坏所致。
因此,放弃了胃-胰蛋白酶联合消化的方法,采用胰蛋白酶单独消化法进行试验。结果发现,3%胰蛋白酶消化效率低,4 h 后才观察到视网膜变轻薄透明,且消化液清澈无文献所强调的“消化液明显变浑浊即可停止消化”。染色后光镜下观察,组织残留过多,无血管暴露。5%胰蛋白酶进行试验也没有很好的改善这种情况。直到我们将胰蛋白酶浓度提高到8%才发现消化液变得浑浊(内含破碎的组织),消化时间在2~2.5 h 最佳。光镜下,对比3%、5%、8%胰蛋白酶HE 染色结果,3%、5%没有暴露血管网,只有8%胰蛋白酶组,组织有明显“破开”,局部暴露清晰的血管网。最后确定8%胰蛋白酶为最佳消化浓度。
3.3 消化时间及其他关键注意事项
虽然8%胰蛋白酶初步展现出消化优势,但仅暴露局部,远远达不到实验要求。如何使消化后变疏松的组织完全脱离血管网,而又不破坏血管网结构成为最为一个关键问题。由于不同视网膜不同部位厚薄有差异,分割后在无人为干预的情况下消化相同时间,状态却不相同。因此消化过程无法准确设定为完全一致的时间,而需人为的参与观察待视网膜明显轻薄后结束,整体时间一般在2~2.5 h。如若消化时间少于2 h,组织残留多而致密,人为吹打也无法暴露血管;超过3 h,视网膜瓣过度消化,周细胞、内皮细胞、血管壁破坏殆尽,光镜下只见组织残留而不见血管网结构。在此过程中一定要控制好消化温度。因为胰蛋白酶的催化反应速度随着温度升高而加快,达到最适工作温度37℃时可最大发挥消化作用,而超过这个温度后活性逐渐降低直至完全失活。另外高温本身就会破坏脆弱的视网膜瓣。
此前实验采用胶头滴管吹打,胶头滴管的吹吸力度全凭人为控制,存在用力较难均匀,吹吸水流大,容易破坏消化后的视网膜瓣的一系列问题。但如若不施加吹吸这一操作,仅靠消化无法使残留的组织脱落。1 ml 移液枪可以很好解决胶头滴管的缺陷,吹打时出水细密均匀,能够很好地将疏松的组织带离血管网,且不会破坏血管网结构。需要注意的是,吹打时枪头不能触碰视网膜,以免造成不可逆的结构破坏。8%胰蛋白酶消化,每隔1 h 配合移液枪吹打,分离视网膜进行HE 染色后又出现了消化过度的问题,光镜下未显示血管壁,仅见周细胞和内皮细胞的核仁。因此设计时间点,缩短时间,整体消化2 h获得最佳结果。
总之,本实验为糖尿病小鼠视网膜脉管系统分离铺片确立了一种稳定可靠的实验条件,希望对相关疾病研究的科研工作者们有所帮助。

