基于网络药理学的复方丹参滴丸治疗糖尿病视网膜病变的作用机制研究
王妙然,李秋艳,马学竹,王旭杰,4,张雪雪,4,张蕊
糖尿病视网膜病变(diabetic retinopathy,DR)是继发于糖耐量受损而造成视网膜损害,引起视力下降,甚至黄斑水肿、视网膜脱离及玻璃体出血,最终导致失明的一种疾病。作为一种严重的糖尿病微血管并发症[1],DR 也是糖尿病(diabetes mellitus,DM)最常见的并发症之一[2]。DR 发病机制较为复杂,是基因和环境共同作用的结果。现代医学主要从血糖水平及糖尿病病程、高血压及高血脂、多元醇代谢通路的异常、蛋白质非酶糖化产物的堆积、氧化应激反应增强、血管紧张素转换酶系统、细胞因子等角度对其发生机制进行了初步的研究。
根据DR 的临床证候,中医将本病概括为“视瞻昏渺”“云雾移睛”“暴盲”“血灌瞳神”等范畴[3]。DR发病源于血瘀损伤眼部络脉[3],吕仁和等[4]认为糖尿病及其并发症的发生存在血脉瘀滞的病机。文小敏等[5]认为瘀血为糖尿病视网膜病变发生发展的主要原因。张亚欣等[6]认为消渴病久肝肾阴虚,目失濡养,气阴亏损、阴虚内热,气虚无力运血,阴虚血行滞涩,引起眼底脉络瘀阻,导致DR 眼底改变;眼底脉络瘀阻日久不消则生内热,炼液成痰,或内生痰湿,痰瘀互结,导致新生血管、出血、机化、牵拉等视网膜增殖性病变。
复方丹参滴丸是在复方丹参片的基础上,根据中医传统理论,采用现代高科技手段研制的一种纯中药滴丸剂,其含有的主要成分包括丹参、三七、冰片的提取物。现已证实复方丹参滴丸能够改善DR的症状,疗效确切[7]。但目前复方丹参滴丸对DR 的作用机制尚未完全阐明。
网络药理学(network pharmacology)是由Hopkins 于2007 年首先提出的[8],建立在计算机虚拟计算、高通量组学数据分析等技术基础上的一种方法,从系统的角度展现中药成分靶点间的相互联系和作用[9],它能够整体地分析中药复方“多成分”的作用机制,也能独立呈现某种特定疾病相关的 “活性成分-靶点-通路”,具有系统性、整体性的特点,与中医中药整体观、辨证论治的原则相吻合,广泛应用于中药复方及单味药的作用机制研究中[8,10-11]。本文拟采用网络药理学方法筛选复方丹参滴丸活性成分及靶点,分析其治疗DR 的关键靶点和信号通路,以期为进一步的药效物质基础和作用机制实验研究提供理论依据。
1 材料与方法
1.1 复方丹参滴丸化合物及活性成分的筛选
本研究通过中药系统药理数据库(TCMSP,http://lsp.nwu.edu.cn/tcmsp.php)检索复方丹参滴丸中丹参、三七、冰片所含有的化合物。依据药代动力学中吸收、分布、代谢、排出特性,以口服生物利用度(oral bioavailability,OB)和类药性(drug-likeness,DL)作为筛选指标,筛选阈值为OB≥30%,DL≥0.18,筛选出符合条件的活性成分。
1.2 复方丹参滴丸潜在靶点的反向预测及筛选
通过并在PubChem 数据库中获取相关成分SDF 格式化学结构,所有化学结构均采用ChemBio 3D Ultra 软件转换为Mol2 文件格式,将复方丹参滴丸化学成分Mol2 格式结构文件,上传至PharmMapper 服务器(http://59.78.96.61/pharmmapper/),以活性小分子为探针,搜寻潜在药物靶点,进而得到虚拟筛选和预测化合物生物活性。参数设置如下,Generate Conformers:Yes;MaximumGenerated Conformations:300;Select Targets Set:Human Protein Targets Only(v2010,2241);Number of Reserved Matched Targets(Max 1 000):300,所有靶点预测结果按Fit score 由高到低进行排序。通过UniProt 数据库中UniProtKB搜索功能(http://www.uniprot.org/)规范检索到的药物靶点的命名,输入蛋白名称并限定物种为“人”,将检索得到的所有“Homo sapiens”靶标校正为其官方名称(official symbol)。
1.3 糖尿病性视网膜病变已知治疗靶点获取
以“Diabetic retinopathy”为关键词通过Genecard网站(www.genecards.org)检索与糖尿病性视网膜病变对应的靶点,所得靶点即为糖尿病性视网膜病变已知靶点。
1.4 复方丹参滴丸活性成分靶点与DR 相关治疗靶点相互作用网络
利用String(Search Tool for the Retrieval of Interacting Genes/Proteins,Version:11.0,http://string-db.org/) 平台,选用Multiple proteins 工具,限定物种为“人”,以置信度大于0.4,将DR 的已知治疗靶点映射到复方丹参滴丸的靶点上,构建蛋白质-蛋白质相互作用网络(protein-protein interaction,PPI),并保存其TSV 格式文件。并利用可视化软件Cytoscape 3.7.2的“Network Analyzer”插件对网络进行拓扑分析,网络中节点(node)之间如存在调控作用关系则以边(edge)相连。拓扑指标为自由度(degree)和介数(betweenness),二者用于说明网络节点的重要性,其值越大,则该节点在网络中越重要。
1.5 复方丹参滴丸治疗DR 预测靶点富集分析
采用Metascape 基因聚类在线分析工具库(http://metascape.org/gp/),基于上述所得到的所有互作靶标,进行GO 生物分析:选择数据类型为“人”,然后进行Custom Analysis,分别选GO Biological Processes,GO Cellular Components 和GO Molecular Functions。再利用DAVID(http://david.nifcrf.gov/)对网络合并后获得的靶点蛋白进行京都基因与基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)通路分析,以人类全基因组为背景和参照,分析结果设置阈值EASE<0.05,Count≥4,FDR<0.01,P<0.01 获得显著性较高的生物过程和通路富集分析结果,点击通路名称可以连接到KEGG 数据库查看通路及详情。
1.6 “活性成分-靶点-通路”网络构建
为了更清晰的展现复方成分、核心靶点与通路之间的关系,利用Cytoscape 3.7.2 软件构建并分析复方丹参滴丸“活性成分-靶点-通路”的网络药理图。在网络中,节点表示活性成分、靶点或通路。边则代表了活性成分、靶点及通路之间的相互作用关系。
2 结果
2.1 复方丹参滴丸化合物、活性成分及潜在靶点的收集与筛选
TCMSP 平台共收录丹参化学成分202 个,符合筛选条件 (OB≥30%,DL≥0.18) 的共有40 个。TCMSP 平台共收录三七化学成分119 个,符合筛选条件(OB≥30%,DL≥0.18)的共有7 个。TCMSP 平台共收录冰片化学成分31 个,符合筛选条件(OB≥30%,DL≥0.18)的共有3 个。将符合筛选条件的化学成分结合文献调研的结果,复方丹参滴丸共筛选出50 个有效成分。将复方丹参滴丸各活性成分在Pharmmapper 中返回的前300 个靶点在作用靶点依据匹配度由高到低排序。通过向Uniprot 数据库的UniProtKB 搜索功能(http://www.uniprot.org/)中输入蛋白靶点的名称并限定物种为“人”,将检索得到的所有蛋白校正为其官方名称,即为丹参、三七、冰片活性成分的预测作用靶点。共对应得到丹参426 个,三七386 个,冰片307 个基因靶点。去除重复后共得到429 个靶点。结果复方丹参滴丸中不同活性化合物可作用于相同的靶点,同一个活性化合物也可作用于不同的靶点,这反映了其多成分、多靶点治疗DR的作用模式。
2.2 已知DR 治疗靶点及与复方丹参滴丸共同靶点的筛选
从GeneCards(https://www.genecards.org/)数据库中检索到2366 个DR 有关的已知治疗靶点,按其相关性评分取≥5 分的靶点821 个。将获得的靶点与复方丹参滴丸的潜在靶点交集,归纳得到98个可能相关联的潜在作用靶点(图1)。将丹参、三七、冰片与对应活性成分,活性成分与潜在作用靶点,潜在作用靶点与DR 对应关系以及属性导入到Cytoscape,建立“药物-成分-靶点-疾病”网络(图2)。
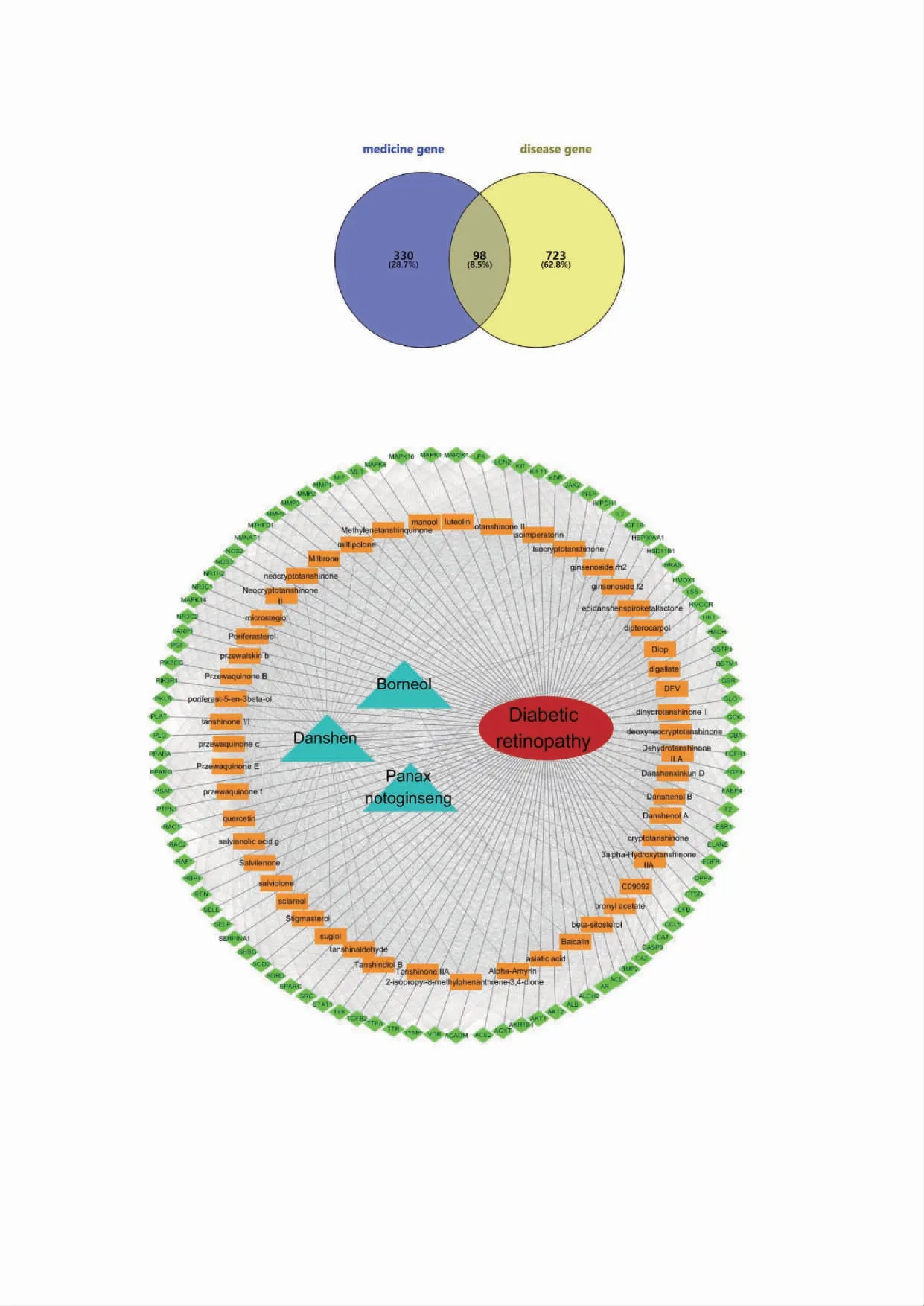
图1 复方丹参滴丸作用于DR 靶点筛选
2.3 候选靶点蛋白互作网络构建与拓扑分析
基于STRING 数据库得到复方丹参滴丸活性成分预测出的98 个靶点的蛋白互作网络,包括95个节点和1047 条边(图3)。经Cytoscape 3.7.2 软件可视化并对网络进行拓扑分析,拓扑指标选取自由度大于中位数的2 倍即38,介数大于中位数即0.00362648,拓扑指标分析后得出16 个靶点,作为复方丹参滴丸治疗DR 的关键靶点,按核心程度由高至 低排名为 ALB、AKT1、MMP9、MAPK1、EGFR、MAPK8、CASP3、SRC、CAT、MMP2、NOS3、ESR1、HSP90AA1、HRAS、MAPK14 和PPARG。
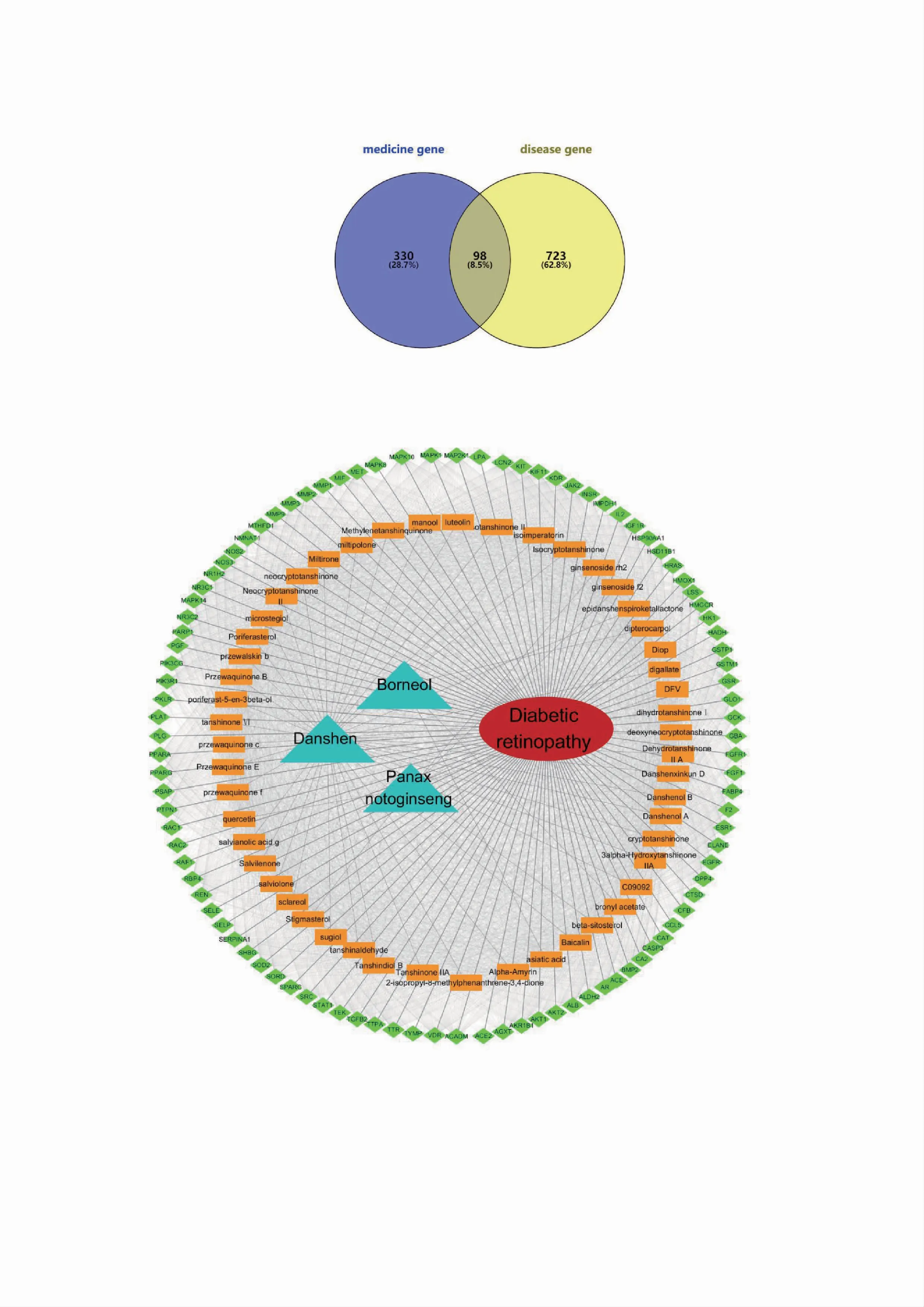
图2 复方丹参滴丸治疗DR 的“药物-成分-靶点-疾病”网络图
2.4 复方丹参滴丸治疗DR 基因GO 富集分析

图3 复方丹参滴丸治疗DR 的PPI 网络图
将复方丹参滴丸活性成分预测出的98 个作用靶点通过Metascape 生物分子功能注释系统对鉴别得到靶点进行GO 富集分析,共包括3 个分支,即生物过程 (biological process)、分子功能(molecular function)和细胞组分(cellular component)。其中生物过程细胞迁移的正调控、无机物反应、肽反应以及肌细胞增生靶点富集较集中(图4)。在分子功能中磷酸转移酶活性、醇基受体、辅因子结合、丝氨酸型肽酶活性、类固醇激素受体活性靶点富集较为集中(图5)。细胞组分中与囊腔、膜筏、细胞外基质、受体复合物、粘着斑相关性最大。
2.5 复方丹参滴丸治疗DR 基因KEGG 富集分析
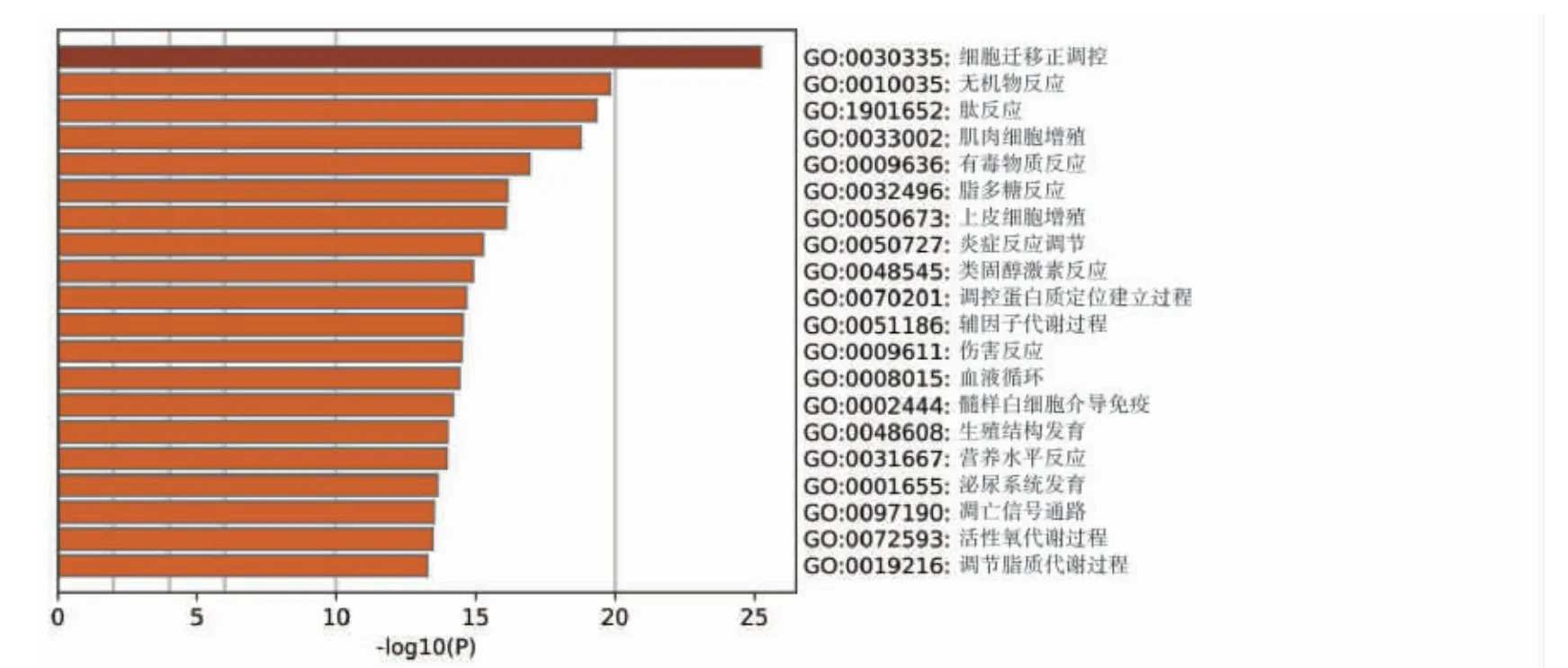
图4 复方丹参滴丸治疗DR 潜在靶点的GO 生物学过程分析
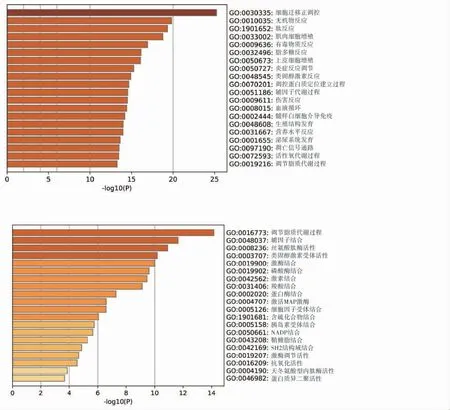
图5 复方丹参滴丸治疗DR 潜在靶点的GO 分子功能分析
KEGG 通路分析共得出108 条通路,以P<0.01作为指标,选取与DR 相关的通路,共37 条(表1)。信号通路主要涉及到细胞能量代谢、细胞增殖、分化、粘附、迁移,细胞外基质分泌、胰岛素抵抗、肿瘤细胞新陈代谢、血管新生、免疫炎症等方面,其中基因数目>10 的有29 个条目,通路上靶点越多,指示复方丹参滴丸在治疗DR 时越可能通过该通路发挥作用。
以PI3K-Akt 信号通路为例,富集的靶点为AKT1、AKT2、HRAS、JAK2、KIT、MET、RAF1、TEK、EGFR、FGF1、FGFR1、HSP90AA1、IGF1R、INSR、IL2、KDR、MAPK1、MAP2K1、NOS3、PIK3CG、PIK3R1、PGF、RAC1,由此可见复方丹参滴丸治疗DR 是通过多通路、多靶点作用来实现的(图6)。
2.6 “活性成分-靶点-通路”网络分析
采用Cytoscape3.7.2 软件构建37 条通路的“活性成分-靶点-通路”网络模型(图7),黄色菱形代表化合物,绿色三角形代表作用靶点,红色椭圆形代表通路,以自由度调节网络中的节点大小,从而直观显示网络中节点的重要程度。由KEGG 分析得到37条通路中,共有59 个靶点,其中对应复方丹参滴丸的50 个活性成分。这37 条通路中有40 个活性成分来自于丹参,7 个活性成分来自于三七,3 个活性成分来自于冰片。其中来源于丹参的化合物较多。在丹参的活性成分中丹参环庚三烯酚酮(miltipolone)、紫丹参己素(przewaquinone F)、丹参醇A(danshenol A)和紫丹参戊素 (przewaquinone E)的作用靶点最多(自由度=48),接着是化合物紫丹参乙素(przewaquinone B,自由度=47),3α-羟基丹参酮IIA(3α-HyDRoxytanshinone IIA,自由度=47),丹参醇B(danshenol B,自由度=45)。这些活性成分具有较多的作用靶点,可能在复方丹参滴丸治疗DR 的过程中起到较为核心的作用。在作用靶点方面,MAPK1,MAP2K1,PIK3R1,PIK3CG 和MAPK10 的自由度分别为82、79、78、76、70,有较多的活性成分配体。

表1 复方丹参滴丸治疗DR 潜在靶点的KEGG 富集分析
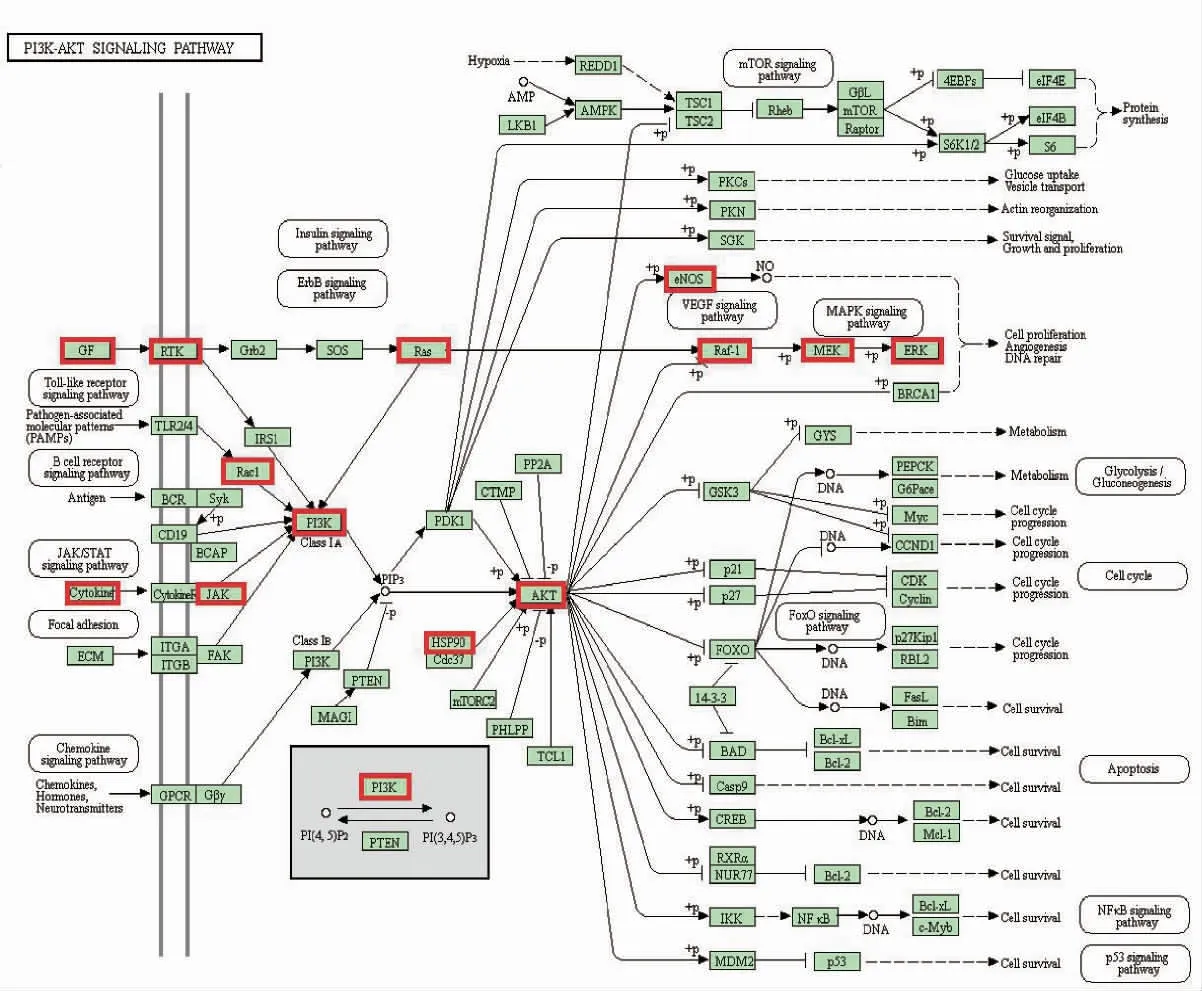
图6 复方丹参滴丸治疗DR 靶点在PI3K-Akt 信号通路的富集情况。红框内为复方丹参滴丸治疗DR 靶点。AKT:AKT1,AKT2;(2)RTK:KIT,MET,TEK,EGFR,FGFR1,KDR,PGR;(3)GF:FGF1,IGF1R,INSR;(4)RI3K,PIK3CG,PIK3R1;(5)Aas:HRAS;(6)Cytokine:IL2;(7)MEK:MAP2K1;(8)ERK:MAPK1
在37 条通路中自由度较大的有癌症通路、PI3K-Akt 信号通路、Rap1 信号通路、Ras 信号通路、癌症中的蛋白聚糖(proteoglycans in cancer)、粘着斑(focal adhesion)、FoxO 信号通路、催乳激素信号通路、VEGF 信号通路、HIF-1 信号通路,自由度分别为30、23、22、22、21、18、17、16、14、13。复方丹参滴丸高类药性的活性成分作用靶点分布于不同的代谢通路,相互协调。
3 讨论
DR 病理机制及发生发展是一个复杂的过程,各发病机制或途径之间关系复杂,以多种方式相互作用并导致视网膜的氧化和炎症损伤。就细胞而言,糖尿病患者的视网膜细胞大多都处于异常状态并参与了糖尿病视网膜病变的发展。如抑制参与视觉循环、释放神经递质、调节血管功能[12-13]的Müller 细胞中VEGF 的表达可显著改善糖尿病视网膜病变血管新生[14]以及血管通透性异常[15]。同样,通过抑制视网膜色素上皮细胞特异蛋白65 的活性来减缓视觉周期活动[16-18]可显著抑制糖尿病引起的毛细血管渗漏的进展和退变。即使是不属于视网膜细胞的白细胞[19-20]和干细胞[21]也被认为参与了糖尿病视网膜病变血管病发症的发展。就目前研究发现,没有任何一条信号通路能完全解释DR 的发病机制,也不能靠阻断单一信号通路而达到治疗DR 的效果[22]。
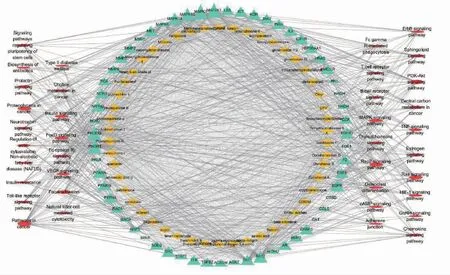
图7 复方丹参滴丸治疗DR 的“活性成分-靶点-通路”网络图
中医药对DR 的作用是从整体出发的多环节、多方位、多靶点的全面治疗,并且各个环节彼此之间相互联系、相互作用、相互影响。但由于中药复方制剂成分复杂多样,化学结构不确定,对其治疗DR 的药理机制尚不十分明确,缺乏深入的研究。本文通过检索文献与查询科研成果后总结发现如下。
PI3K-Akt 信号通路是介导多种生长因子促存活的重要通路[23]。它的主要作用是对葡萄糖代谢、细胞生长、增殖和分化的过程进行调控,并可介导下游反应[24]。糖尿病时低氧和低血糖可激活PI3K 信号通路,活化的Akt 可引起血管扩张,血管重塑与血管新生[25]。过度的血管生成,导致视网膜病变和肾病。在糖尿病发生和发展过程中,持续的高血糖可能激活PI3K-Akt 细胞信号传导通路,导致多种细胞因子(如NF-κB)的合成与释放量上调,最终加速了DR的发生与发展。
Ras 信号通路被认为能有效调节细胞的增殖、分化、凋亡和癌性转化等过程。Ras 在调控细胞增殖和生存的网络信号途径中处于中心的位置,而Rap1主要调控细胞的黏附、细胞间连接形成、细胞的分泌作用与极性[26]。Ras 与Rap1 在决定下游信号通路及受体的结构域上具有显著的相似性[27]。同Rap1 一样,都可通过不同的效应子按照不同的机制抑制或激活MAPK 通路[28]。MAPK 激活后定位在细胞核,通过磷酸化转录因子调控基因的表达,决定细胞是增殖还是分裂。
MAPK 信号通路在细胞增殖、凋亡、坏死、炎症等病理过程中发挥重要调控作用[29]。在损伤环境下,大量的细胞因子和炎症因子的释放激活了细胞内的MAPK 通路,引起多种下游调控因子和效应分子被激活,从而诱发炎症和凋亡[30-31]。炎症和细胞凋亡是DR 的重要病理反应之一,并且往往导致视神经细胞的凋亡和坏死,从而影响视网膜损伤后的修复[32-33]。
FoxO 家族是Fox 基因家族中的一个亚族,为细胞核内一种转录因子,参与调节细胞增殖、分化和凋亡等过程[34]。它们介导胰岛素或胰岛素样生长因子对细胞代谢、生长、分化、氧化应激、衰老、自噬和衰老等关键功能的抑制作用。在Fox 家族中的FoxO1广泛表达于重要的胰岛素感应器官,主要参与肝脏的糖异生调节,调控胰岛素β 细胞的代谢、发育及增殖,调控脂肪和肌肉的分化及代谢[35-37]。
血管内皮生长因子(VEGF)是最有效的血管生成生长因子之一,并具有增加血管通透性、血管内皮细胞迁移、增殖和血管形成等作用[38]。血管在发育过程中,尖端细胞可感知VEGF 的梯度,导致丝状伪足形成,并向VEGF 梯度迁移[39]。VEGF 对血管内皮细胞的增殖和迁移发挥重要作用[40]。目前抗VEGF 是眼部血管新生的标准治疗策略,该治疗策略已被广泛应用于各种视网膜血管疾病,包括DR 和视网膜静脉阻塞[41]。
HIF-1 信号通路在多种心血管疾病、炎症、癌症与急性脏器损伤等过程中发挥重要作用[42]。HIF-1 蛋白是缺氧状态下调控血管新生的重要分子,缺氧能够诱导HIF-1 蛋白的表达并通过HIF-1 蛋白与VEGF、EPO 基因启动子区域的结合来启动VEGF、EPO 的表达[43-44]。同时由于HIF-1α 能调控VEGF 的表达,进而调控血管增生[45]。
通过网络药理学的方法,发现复方丹参滴丸多个活性成分可以作用于同一靶点,单个成分也可以作用于多个靶点,通过多条通路协同发挥作用。这都体现出复方的多成分、多靶点、多通路整体调整的作用特点。对有效靶点进行KEGG 通路分析后发现复方丹参滴丸主要通过PI3K-Akt 信号通路、Ras 信号通路、Rap1 信号通路、MAPK 信号通路、FoxO 信号通路、VEGF 信号通路以及HIF-1 信号通路对糖尿病视网膜病变进行治疗调控。复方丹参滴丸能通过不同的调节方式对相应信号通路产生作用来达到对疾病的干预作用。其对各信号通路的调节是十分复杂的,可能通过细胞能量代谢、细胞增殖、分化、粘附、迁移,细胞外基质分泌、炎症及免疫因子等多种信号通路作用于DR,本研究发现的主要通路有望成为新的治疗DR 的靶点方向,但仍需进一步行相关研究验证其具体作用机制。对于何种成分以何种方式作用于具体靶基因与各通路调节机制等具体细节更应当继续加以深入研究。

