肝硬化超声影像特点与患者肠黏膜炎性因子和Th1/Th2变化的关联
许年凤 章小华 白露 雷艾华 王宏亮
肝硬化是指慢性肝损伤导致门脉高压和终末期肝病的再生结节周围纤维带的组织学发展[1]。目前正在研发能够阻止失代偿性肝硬化进展甚至逆转肝硬化的药物疗法[2]。随着彩色超声仪器的普及,彩色多普勒超声在诊断肝硬化中越来越多使用[3]。肝硬化与肠屏障功能障碍和肠道通透性增加有关。肝硬化中的肠屏障功能障碍及其相关机制具有重要的临床意义,它与肝硬化严重并发症的发生有关[4]。肠上皮由单层上皮细胞组成,紧密连接在顶端表面,似乎是决定肠道通透性的最重要因素[5]。肝硬化导致肠细胞紧密连接的显著改变,这是肠通透性高的一个重要致病机制。黏膜屏障也依赖于上皮细胞的稳态,而上皮细胞的稳态是由细胞增殖和死亡之间的平衡决定的,后者调节肠细胞的转换和黏膜细胞的数量。细胞因子是负责免疫系统大多数生物学效应的激素信使。T淋巴细胞是细胞因子的主要来源,T淋巴细胞有两个主要的亚群,以细胞表面分子CD4和CD8的存在为特征。表达CD4的T淋巴细胞也被称为辅助性T细胞。这一亚群可进一步细分为Th1和Th2,它们产生的细胞因子被称为Th1型细胞因子和Th2型细胞因子。Th1型细胞因子倾向于产生原炎性反应,该反应负责杀死细胞内寄生虫并使自身免疫反应持续,干扰素γ是主要的Th1细胞因子[6]。Th2型细胞因子包括IL-4、IL-5和IL-13,这些细胞因子与特应性免疫球蛋白(IgE)和嗜酸细胞反应的促进有关,也包括IL-10,后者具有更多的抗炎反应。Th2反应将抵消Th1介导的杀菌作用[7]。Th1和Th2细胞因子平衡的改变与多种免疫相关疾病的转归和预后密切相关。
1 资料与方法
1.1 一般资料 选择2018年1月至2019年1月36例患者作为研究对象。36例受检者根据患者情况分为对照组(n=12),由年龄和性别相匹配的健康人组成,接受上消化道内镜检查,没有病理发现。代偿性肝硬化(n=12),失代偿性肝硬化(n=12)。失代偿性或代偿性疾病的分类基于Child-Pugh分类;Child-Pugh A被分类为代偿性肝硬化,Child-Pugh B或C被分类为代偿性肝硬化。所有参与研究的患者都接受了上消化道内窥镜检查,在检查过程中,活组织检查从十二指肠的第二部分获取。3组患者一般情况(年龄、体重、性别比例、体重指数)比较,差异无统计学意义(P>0.05)。见表1。

表1 3组一般资料对比 n=12
1.2 纳入与排除标准
1.2.1 纳入标准:性别不拘;年龄30~70岁;如果患者被诊断为肝硬化(病毒性、酒精性或其他病因),则有资格纳入本前瞻性研究。
1.2.2 排除标准:恶性肿瘤、糖尿病、风湿性疾病、肾脏疾病、胃肠道疾病(如腹腔疾病、炎症性肠病、过去四周胃肠道出血)或肠道手术、感染包括自发性细菌性腹膜炎(过去4周)、过去4周酗酒。服用血清或尿淀粉酶升高和治疗的药物,如抗生素,皮质类固醇,非甾体类抗炎药和抗氧化剂(维生素C和E,别嘌呤醇,N-乙酰半胱氨酸)。
1.2.3 医学伦理学问题:所有参与研究的患者均得书面知情同意;依据临床指南的相关原则充分保障患者的治疗安全;对患者诊疗记录进行保密,保护患者的隐私权。
1.3 方法
1.3.1 内毒素测定:在内窥镜检查之前,所有患者都要从外周静脉进行血液取样以测量内毒素。血液样本在无内毒素的小瓶中收集,然后分离血浆,并在-80℃下储存,直到处理。内毒素浓度通过定量显色鲎-阿米巴细胞溶解物试验(LAL,QCL-1000,Lonza,Walkersville,MD,USA)测定,并以EU/ml表示。样品按照说明书进行处理。
1.3.2 肠道脂质氢过氧化物(looh)测定:肠道样本在0.1 ml 10 mm磷酸盐缓冲液(pH值7.2)中均匀化(使用微管装),为蛋白质定量10 μl。用0.09 ml氯仿:甲醇(2∶1,v∶v)萃取19份匀浆,离心(15 000 g,5 min),氯仿层真空干燥,用0.25 ml甲醇溶解。
1.3.3 肠黏膜增殖和凋亡的组织病理学评价:十二指肠活检用10%中性甲醛溶液固定,石蜡包埋,4 μm切片,苏木精和伊红染色。
1.3.4 流式细胞术:细胞用合适的fitc-、藻红蛋白或cychrome结合abs在PBS中培养30 min,其中0.1%胎牛血清和0.02 mmol/L NaN3。细胞质CTLA-4由细胞内染色确定。用5-和6-羧基氟烷二乙酸酯琥珀酰亚胺酯(CFSE;Molecular Probes,Inc.,Eugene,or)标记纯化的CD4细胞。清洗后,在facscan(加利福尼亚州圣何塞市Becton Dickinson)上分析标记的细胞样品。
1.3.5 细胞因子和生化参数:通过免疫化学发光分析测定肿瘤坏死因子α(TNF-α);化学发光分析测定白介素-6(IL-6);cent分析IL-4;酶联免疫测定法测定IL-10,此外,患者进行常规实验室评估,包括凝血酶原活性、血清白蛋白、胆红素和IgG,计算作为Th1/Th2激活替代标记物的IFN-γ/IL-10、IFN-γ/IL-4和IFN-γ/IL-13的比值。

2 结果
2.1 内毒素测定 失代偿和代偿组内毒素浓度较对照组明显增高(P<0.05)。见表2。
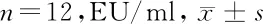

组别内毒素对照组 1.25±0.13代偿肝硬化组 4.35±2.02*失代偿肝硬化组4.35±0.34*F值6.472P值0.002
注:与对照组比较,*P<0.05
2.2 肠道脂质氢过氧化物 失代偿期肝硬化组的肠道脂质过氧化显著增加(P<0.05)。见表3。
2.3 肠黏膜有丝分裂和凋亡活性 在每个肠黏膜标


组别looh/ml对照组 2.45±2.65代偿肝硬化组 4.67±0.98*失代偿肝硬化组3.25±4.67*#F值8.439P值0.006
注:与对照组比较,*P<0.05;与代偿肝硬化组比较,#P<0.05
本中,通过形态学分析鉴定和计数肠上皮的有丝分裂和凋亡体。代偿性和失代偿性肝硬化组的黏膜有丝分裂计数明显低于对照组(P<0.05)。细胞凋亡有增加的趋势(P<0.05)。与对照组比较,B组和C组的有丝分裂/凋亡率显著降低(P<0.05)。见图1,表4。

图1 健康受试者(A)和代偿性肝硬化患者(B)肠上皮细胞有丝分裂的显微照片(红色箭头,HE×200);失代偿性肝硬化患者(C)肠上皮细胞凋亡体的检测(红色箭头,HE×200)

表4 肠黏膜有丝分裂计数、凋亡计数及其比值
注:与对照组比较,*P<0.05;与代偿肝硬化组比较,#P<0.05
2.4 细胞因子 代偿性肝硬化组和失代偿性肝硬化组IL-4、IL-13、TNF-α、IL-6水平均高于对照组(P<0.05)。失代偿肝硬化组TFN-γ低于对照组、代偿性肝硬化组(P<0.05),IL-4高于对照组,低于代偿性肝硬化组(P<0.05),IL-10、IL-13、TNF-α、IL-6水平均高于对照组、代偿性肝硬化组(P<0.05)。见表5。
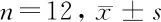

项目对照组代偿肝硬化组失代偿肝硬化组F值P组IFN-γ(pg/ml)6.25±7.625.64±5.605.09±2.56*#0.3620.000IL-4 (ng/ml)0.93±1.621.79±5.30*1.15±1.34*#3.1650.000IL-10 (pmol/L)11.50±26.6710.75±5.9513.69±10.11*#13.519 0.001IL-13 (pg/ml)10.76±21.3021.68±28.07*25.38±34.01*#6.858 0.033TNF-α (pg/ml)4.80±1.826.31±2.20*8.09±4.69*#12.971 0.002IL-6 (pg/ml)5.89±4.307.19±4.74*9.96±12.81*#4.5150.000
注:与对照组比较,*P<0.05;与代偿性肝硬化组比较,#P<0.05
3 讨论
肝硬化是临床常见的慢性进行性肝病,由一种或多种病因长期或反复作用形成的弥漫性肝损害[8]。肝硬化反复证实肠道通透性增加,肠上皮似乎是决定肠通透性的最重要因素,在肝硬化患者的肠上皮中,TJ相关蛋白occludin和claudin-1的表达下降,在细胞水平上,促进了肠通透性的增加。肠屏障功能完整性与肠上皮细胞增殖和凋亡有关。肠上皮细胞增殖显著减少,凋亡趋势增加。肝硬化患者肠道的增殖/凋亡率明显降低。在代偿性和失代偿性肝硬化患者中同时检测到黏膜细胞的变化,而差异无统计学意义(P>0.05)。2组肝硬化患者存在肠屏障功能障碍和显著内毒素血症。肠道屏障功能障碍和肠道通透性高发生在肝硬化的早期。在失代偿性疾病患者中观察到的肠道源性内毒素血症的更大程度可归因于导致该组肠道屏障紊乱的其他因素,肝硬化与氧化应激密切相关[9]。在肝硬化患者的血液和肝组织中检测到氧化应激。氧化应激介导的肝线粒体功能障碍。在失代偿性疾病中观察到,失代偿性疾病是一种重要的氧化应激启动子,通过激活全身炎性反应,并在肝病中耗尽肝细胞抗氧化防御[10,11]。代偿性肝硬化患者的肠道细胞发生了改变。没有红色同时出现的肠道高氧化应激,表明其他因素,如全身内毒素血症,可能与肝病早期肠道黏膜异常有关。然而,在失代偿性肝硬化中,肠道氧化性很高。通过抑制细胞增殖和破坏紧密连接结构复合体,应激可能在进一步损害黏膜屏障完整性方面发挥了关键作用。
在研究中,患者的IFN-γ水平仍高于对照组,而IL-13和IL-10水平也较高。IL-13是主要由Th-2细胞产生。IL-13促进纤维生成,但也刺激基质金属蛋白酶。它还具有多种抗炎功能[12]。IL-10主要由2型巨噬细胞、单核细胞、调节性T淋巴细胞和B细胞产生。作为一种负性免疫调节细胞因子,对Th1和Th2淋巴细胞、单核吞噬细胞和自然杀伤细胞具有抑制作用[13,14]。因此,发现患者的IL-13和IL-10水平可能导致免疫调节作用[15,16]。患者的IFN-γ水平也高于对照组,表明Th1淋巴细胞活性增加。
总之,研究表明肝硬化与肠上皮内稳态的显著改变有关,通过减少黏膜增殖和增殖/凋亡率来证明。失代偿性疾病与高水平的肠道氧化应激有关。恢复肠上皮内稳态和减少肠氧化应激的治疗剂,如肠免疫营养(谷氨酰胺)、益生菌、抗氧化剂和肠道调节肽(蛙皮素、神经降压素),可能对肝硬化患者具有潜在价值。在肝硬化患者中,Th1细胞因子,如IFN-γ,在主要Th2衍生细胞因子IL-4水平较低的情况下升高。IL-10是一种抗炎性细胞因子,它的产生与肝功能损害有关。与IL-4相比,肝硬化患者的IL-13增加。尽管由Th2细胞产生,其他类型的细胞也分泌这种细胞因子,它除了促进纤维生成外,还与IL-10一起发挥免疫调节作用。因此,在肝硬化患者中,Th1活性增加,同时IL-10和IL-13水平增加。

