牛磺酸通过抑制氧化应激减轻放射性肠损伤的实验研究*
李沁恺 沙 桐 苏存锦 胡端敏&
苏州大学附属第二医院消化科1(215000) 药剂科2
背景:氧化应激在电离辐射引起的肠道损伤和炎症反应中起关键作用。牛磺酸是一种广泛分布于体内的含硫氨基酸,具有抗氧化、抗炎等多种生物学功能。目的:研究牛磺酸对放射性肠损伤的治疗作用及其潜在机制。方法:以CCK-8实验和细胞内活性氧(ROS)荧光探针DCFH-DA检测牛磺酸对电离辐射引起的人肠上皮细胞株HIEC-6活力抑制和ROS蓄积的影响。以real-time PCR检测牛磺酸对体内、外辐射暴露后肠道细胞氧化应激相关基因表达的调节作用。以HE染色和TUNEL染色评估牛磺酸对全身辐射后小鼠肠道形态结构和细胞凋亡的改善作用。结果:体外实验中,牛磺酸可显著改善电离辐射引起的HIEC-6细胞活力抑制和细胞内ROS水平升高,并上调过氧化氢酶(CAT)和谷胱甘肽过氧化物酶1(GPx1)表达。体内实验显示,牛磺酸能激活核因子E2相关因子2/血红素氧合酶-1(Nrf2/HO-1)信号通路,减轻辐射暴露引起的小肠绒毛结构紊乱和肠隐窝丢失,抑制肠道细胞凋亡。结论:牛磺酸可能通过激活Nrf2/HO-1抗氧化信号通路降低细胞内ROS水平,对电离辐射引起的肠道损伤发挥保护作用,是一种可用于治疗放射性肠损伤的潜在药物。
电离辐射对于一些恶性肿瘤有较好的治疗效果,但也会造成周围健康组织损伤[1],放射治疗引起的多种胃肠道症状,如便血、腹泻、吸收不良、恶心、呕吐、腹胀、腹痛等严重影响患者生活质量[2-3]。因此,减轻放射治疗的毒性反应以提高患者生活质量在肿瘤治疗期间至关重要。活性氧(reactive oxygen species, ROS)是体内一类氧的单电子还原产物,其在生理状态下参与细胞内信号转导、能量代谢,过多则对细胞产生损伤作用[4]。电离辐射与生物分子之间相互作用产生的ROS是引起放射性损伤的重要因素[5-6]。电离辐射造成的细胞内ROS蓄积引起氧化应激、线粒体膜通透性变化、DNA损伤、细胞凋亡以及炎症相关信号通路激活和促炎细胞因子分泌增加、抗炎细胞因子分泌减少,是放射性肠损伤的关键病理生理环节[7-10]。牛磺酸(taurine)是一种结构简单的含硫氨基酸,具有抗氧化、抗炎、抗凋亡等多种生物学功能,研究显示其可明显改善辐射引起的肾、脑、睾丸、肺等组织器官损伤[5,11-13]。本研究通过体、内外实验探讨牛磺酸对放射性肠损伤的治疗作用及其潜在机制,以期为牛磺酸应用于放射性肠病的临床治疗提供理论依据。
材料与方法
一、细胞株、实验动物和主要试剂
正常人肠上皮细胞株HIEC-6(上海雅吉生物科技有限公司)以RPMI-1640培养基(添加10%胎牛血清、1%青-链霉素配制成完全培养基),培养于37 ℃、5% CO2恒温培养箱中。
6~8周龄雄性Balb/c小鼠(上海斯莱克实验动物有限责任公司)平均体质量约20 g,饲养于SPF级环境中,温度20~25 ℃,相对湿度30%~50%,12 h明暗周期,自由摄取饲料和饮水。动物实验方案经苏州大学动物伦理委员会审核批准。
牛磺酸(上海阿拉丁生化科技股份有限公司);Cell Counting Kit-8(CCK-8)细胞增殖和细胞毒性检测试剂盒、细胞核荧光染料DAPI、TUNEL细胞凋亡检测试剂盒(显色法;上海碧云天生物技术有限公司);细胞内ROS荧光探针DCFH-DA(MedChem-Express.);TRIzolTM试剂(InvitrogenTM, Thermo Fisher Scientific);RevertAid First Strand cDNA Synthesis Kit(Thermo Fisher Scientific);SYBR Premix EX Taq(Perfect Real Time; Takara Bio Inc.)。
二、方法
1. 体外实验
①细胞活力检测:HIEC-6细胞以每孔1×104个接种于96孔培养板,37 ℃、5% CO2饱和湿度培养箱中培养12 h至细胞贴壁。将牛磺酸分别配制成40 mmol/L和100 mmol/L浓度的溶液。将细胞分为四组:对照组(CON组)、辐射组(RAD组)和RAD+TAU(40 mmol/L)组、RAD+TAU(100 mmol/L)组,后两组每孔培养基中加入10 μL配制好的牛磺酸溶液,培养12 h后予电离辐射处理(X射线辐照,照射剂量10 Gy,剂量率0.98 Gy/min);辐射处理后继续培养24 h,每孔加入10 μL CCK-8试剂后培养2 h,以酶标仪检测各孔吸光度值(A值)。细胞活力=(实验组A值-空白组A值)/(对照组A值-空白组A值)。实验设3个复孔,结果取均值。
②细胞内ROS检测:以无血清RPMI-1640培养基将ROS荧光探针DCFH-DA按1∶1 000的比例稀释,浓度为10 μmol/L。电离辐射后6 h,各组HIEC-6细胞去除培养基,加入含DCFH-DA荧光探针的培养基,37 ℃培养箱中孵育20 min;去除培养基,无血清培养基洗涤细胞3次以充分洗去未进入细胞的DCFH-DA;于培养孔中加入细胞核荧光染料DAPI避光染色10 min;PBS洗涤1次,荧光显微镜下观察、拍照。
③Real-time PCR检测氧化应激相关基因表达:电离辐射后6 h,TRIzol试剂提取各组细胞总RNA,根据RevertAid First Strand cDNA Synthesis Kit说明书配制逆转录体系,合成第一链cDNA,以之为模板,使用Applied Biosystems 7500快速实时荧光定量PCR系统行real-time PCR扩增,反应体系的配制和反应条件参照SYBR Premix EX Taq (Perfect Real Time)说明书,引物序列见表1。内参照基因使用GAPDH,以2-△△Ct法计算目的基因mRNA相对表达量。
2. 体内实验
①动物分组和造模:将实验小鼠随机分为三组:对照组(CON组)、全身辐射组(RAD组)和全身辐射+牛磺酸干预组(RAD+TAU组),每组6只。X射线全身辐射剂量为10 Gy,剂量率为 0.98 Gy/min。RAD+TAU组和RAD组分别于X射线照射前3 d开始每日1次腹腔注射牛磺酸1 000 mg/kg或等体积0.9% NaCl溶液,照射当日于照射前30 min腹腔注射一次,照射后继续每日腹腔注射;对照组小鼠不予X射线照射,仅予腹腔注射0.9%NaCl溶液。照射后3.5 d处死小鼠(处死当日不予腹腔注射),进行后续实验。
②小肠组织获取:4%水合氯醛麻醉小鼠,剪开胸腔,分离心脏,由心尖入针,剪开右心耳,0.9% NaCl溶液灌流全身。于距盲肠1 cm处取小肠组织,用于real-time PCR检测。4%多聚甲醛灌注直至小鼠四肢僵硬,另选择一段小肠取材,4%多聚甲醛固定待测。
③Real-time PCR检测小肠组织CAT基因表达:方法同细胞实验。
④组织病理学检查和细胞凋亡检测:小肠组织标本以4%多聚甲醛固定48 h,常规石蜡包埋,垂直于肠管横截面4 μm厚连续切片,行HE染色,并参照试剂盒说明书行TUNEL染色,观察小肠组织病理学变化和细胞凋亡情况。
三、统计学分析
结 果
一、牛磺酸改善电离辐射引起的人肠上皮细胞活力抑制
选择人肠上皮细胞株HIEC-6作为研究对象,通过体外实验研究牛磺酸预处理对电离辐射引起的肠道细胞活力抑制的影响。既往研究显示牛磺酸的细胞毒性很小,故直接选用40 mmol/L和 100 mmol/L两个剂量进行实验。CCK-8实验结果显示,10 Gy电离辐射可显著抑制HIEC-6细胞活力,与未予牛磺酸预处理者相比,经100 mmol/L牛磺酸预处理的HIEC-6细胞活力明显增加,差异有统计学意义(P<0.05;图1),表明100 mmol/L牛磺酸可改善电离辐射引起的人肠上皮细胞活力抑制。后续体外实验步骤均使用100 mmol/L牛磺酸。

**与CON组比较,P<0.01;#与RAD组比较,P<0.05
二、牛磺酸降低电离辐射后人肠上皮细胞内的ROS水平
ROS荧光探针DCFH-DA检测显示,与未经电离辐射者相比,辐射暴露后的HIEC-6细胞内ROS水平明显升高,牛磺酸预处理则可有效抑制辐射引起的细胞内ROS水平升高(图2),表明牛磺酸可降低电离辐射后人肠上皮细胞内的氧化应激水平。
三、牛磺酸调节电离辐射后氧化应激相关酶表达
为进一步探索牛磺酸对氧化还原平衡的影响,研究采用real-time PCR检测了电离辐射后氧化应激相关酶的体内、外表达水平。体外实验中,辐射暴露后的HIEC-6细胞内抗氧化分子CAT、GPx1 mRNA相对表达量明显降低,牛磺酸预处理则可有效上调两者表达,差异均有统计学意义(P<0.05;图3A、3B)。体内实验中,与未予全身辐射的小鼠相比,辐射后3.5 d小鼠小肠组织CAT mRNA相对表达量明显降低,牛磺酸干预则可上调CAT mRNA表达,差异均有统计学意义(P<0.05;图3C)。
四、牛磺酸激活Nrf2信号通路调控氧化应激保护小鼠肠道细胞
基于牛磺酸对氧化应激相关酶的调节作用,研究进一步探讨了牛磺酸对氧化应激系统的调节机制。转录因子Nrf2是细胞抗氧化应激的重要调节因子之一,可在转录水平上调下游抗氧化因子表达,对细胞发挥保护作用[14]。Real-time PCR检测显示,与未予全身辐射的小鼠相比,辐射后3.5 d小鼠小肠组织Nrf2 mRNA相对表达量明显升高(P<0.05),这可能是由于辐射导致细胞内Nrf2信号通路激活,Nrf2表达代偿性增加,牛磺酸干预则可进一步上调Nrf2 mRNA表达(P<0.05),Nrf2下游靶基因HO-1的表达变化与之相一致(图4)。
五、牛磺酸维持全身辐射后小鼠肠上皮结构的完整性
本实验步骤评估了牛磺酸对全身辐射后小鼠小肠结构的保护作用。辐射后3.5 d小鼠小肠出现严重损伤,表现为肠壁充血、水肿、变薄、褶皱减少,肠内容物变稀;经牛磺酸干预的辐射暴露后小鼠无论是肠壁情况还是肠内容物均有明显改善(图5A)。HE染色显示,辐射后3.5 d小鼠小肠上皮出现不同程度的绒毛短缩和肠隐窝丢失,肠绒毛部分缺如、绒毛结构紊乱;牛磺酸干预则可部分恢复小肠绒毛和肠隐窝的完整性(图5B)。上述发现表明,牛磺酸可减轻全身辐射引起的肠道结构紊乱。
六、牛磺酸抑制全身辐射后小鼠肠道细胞凋亡
细胞凋亡是辐射暴露后肠道细胞死亡的关键机制,凋亡导致的绒毛上皮细胞和隐窝干细胞丢失是腹部和盆腔放射治疗引起胃肠道综合征的重要原因[15]。本研究TUNEL染色显示,与未予全身辐射的小鼠相比,辐射后3.5 d小鼠小肠隐窝内有大量染为褐色的凋亡细胞,牛磺酸干预则可显著改善小肠隐窝和绒毛细胞凋亡(图6)。上述发现表明,牛磺酸可减少全身辐射引起的肠道细胞凋亡。
讨 论
本研究探讨了牛磺酸对放射性肠损伤的保护作用及其可能机制,研究结果表明,牛磺酸可通过上调抗氧化应激相关酶表达而减少辐射暴露后人肠上皮细胞内的ROS蓄积。具体而言,牛磺酸可激活Nrf2/HO-1信号通路,发挥抗氧化作用。体内实验结果表明,牛磺酸可减轻全身辐射引起的肠道损伤,维持肠上皮结构完整性,减少肠道细胞凋亡。上述发现为牛磺酸用于放射性肠损伤的治疗提供了理论依据。
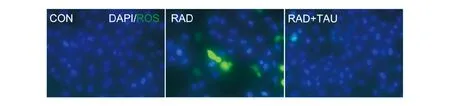
蓝色荧光为细胞核,绿色荧光为ROS阳性细胞
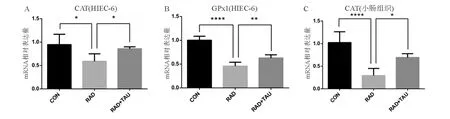
两组间比较,*P<0.05,**P<0.01,****P<0.000 1

两组间比较,*P<0.05,**P<0.01
ROS在电离辐射引起的肠道损伤和炎症反应中起关键作用[7-10]。ROS主要由线粒体产生,细胞呼吸过程中,线粒体呼吸链“电子漏”会使少量电子与氧直接结合产生超氧阴离子O2-,即初级ROS,并在歧化酶的催化下继续形成H2O2[16]。细胞暴露于电离辐射时,线粒体膜电位发生变化,线粒体膜损伤导致ROS产生进一步增加[17]。而ROS的蓄积又可促进线粒体功能障碍,导致持续的氧化应激,形成恶性循环[7]。为保护自身免于ROS诱导的细胞损伤,细胞会启动主要基于酶类的抗氧化防御体系,如CAT和GPx以维持氧化还原平衡[18]。

A:小肠组织大体图;B:HE染色图(×40)
牛磺酸广泛分布于脑、脊髓、心脏、肌肉细胞和视网膜中,是在几乎所有组织器官中含量均较为丰富的氨基酸之一[19]。作为一种调节机体正常生理活动的活性物质,牛磺酸在神经、心血管、肾脏、内分泌和免疫系统中发挥多种生理功能和药理作用。其细胞保护特性表现在细胞的发育、营养、存活等诸多方面。此外,牛磺酸还具有抗氧化功能。在糖尿病引起的肾脏损伤中,牛磺酸可降低血糖、促炎细胞因子和肾脏氧化应激水平,减少细胞凋亡,改善肾功能[20]。牛磺酸还可通过多种机制改善多种生理或病理情况下的认知功能损害,包括减轻神经炎症、上调Nrf2表达和抗氧化能力、激活Akt/CREB/PGC1α信号通路以进一步增强线粒体生物合成、突触功能、减少氧化应激等[21]。上述发现表明,牛磺酸具有保护多种组织器官免于氧化应激损伤的作用。本研究在既往研究的基础上探讨了牛磺酸对放射性肠损伤的保护作用。
牛磺酸在动物细胞线粒体中发挥重要的抗氧化作用[22]。细胞内牛磺酸的消耗可能会导致牛磺酸修饰的线粒体tRNA减少,从而损害呼吸链的电子传递能力,电子由呼吸链转移至氧,形成超氧阴离子,而恢复牛磺酸水平可恢复呼吸链活性,降低细胞内ROS(超氧阴离子)水平[23-24]。对放射性肾损伤的研究表明,牛磺酸可能通过改善线粒体功能障碍抑制ROS,从而减轻电离辐射引起的肾损伤[5]。由此推测在放射性肠损伤中,牛磺酸可能同样是通过调节线粒体功能抑制ROS,促进电离辐射引起的肠损伤的恢复。本研究体外实验验证了这一推测,牛磺酸确可抑制辐射暴露后人肠上皮细胞的ROS产生,上调抗氧化酶CAT、GPx1表达,并改善细胞活力。
Nrf2是调节氧化应激的上游信号通路因子,被认为是细胞维持氧化还原稳态的主要调节因子,在控制外部因素诱导的氧化应激中起关键作用[14]。正常情况下,Nrf2分布于细胞质中,与Keap1结合形成复合物,进而被泛素化降解;细胞发生氧化应激时,Nrf2通过磷酸化与Keap1解离并转位进入细胞核,与靶基因启动子区的抗氧化反应元件(antioxidant response element, ARE)结合,上调下游靶基因表达[25-26],如HO-1、CAT、GPx1等,发挥抗炎、抗氧化应激、抗凋亡作用。研究证实Nrf2信号通路激活可保护细胞免受辐射损伤,其机制可能与减少辐射后产生的氧自由基有关[8,12,26-27]。对小鼠精母细胞的研究[12]表明,牛磺酸对电离辐射引起的细胞损伤的保护作用与激活Nrf2/HO-1信号通路有关。另有研究显示,阿魏酸和鬼臼属植物根茎提取物对辐射暴露造成的胃肠道和造血系统损害发挥保护作用亦与激活Nrf2/HO-1信号通路有关[8,27]。但目前尚无研究表明牛磺酸可通过激活Nrf2/HO-1抗氧化信号通路逆转电离辐射引起的肠道损伤。因此,本研究在明确了牛磺酸可通过调节CAT和谷胱甘肽氧化还原系统发挥抗氧化作用后,推测这一作用的发挥同样是由Nrf2信号通路所介导。体内实验结果显示,经全身辐射后,小鼠肠道细胞中的Nrf2/HO-1信号通路激活,而牛磺酸干预可进一步上调Nrf2及其靶基因HO-1表达,CAT表达亦明显上调,辐射暴露引起的小肠绒毛结构紊乱、肠隐窝丢失和细胞凋亡部分逆转,证实牛磺酸可通过激活Nrf2/HO-1信号通路减轻放射性肠损伤。
综上所述,本研究探索并验证了牛磺酸对放射性肠损伤的治疗作用及其潜在机制。牛磺酸可能通过激活Nrf2/HO-1抗氧化信号通路降低细胞内ROS水平、保护肠道细胞、维持正常肠道结构,对电离辐射引起的肠道损伤发挥保护作用,是一种可用于治疗放射性肠损伤的潜在药物。

