慢性胰腺炎的临床诊治
熊慧芳 吕农华
南昌大学第一附属医院消化内科(330006)
慢性胰腺炎(chronic pancreatitis, CP)是一种由遗传、环境等因素引起的胰腺局部、节段性或弥漫性的慢性进展性炎症,病程中胰腺组织逐渐纤维化,胰腺功能发生不可逆的损害[1]。随着疾病的进展,患者出现胰腺内、外分泌功能不全甚至胰腺癌等严重并发症[2]。CP临床上主要表现为反复发作或持续性腹痛、腹泻或脂肪泻、消瘦、黄疸、腹部包块和糖尿病。
一、病因和流行病学
遗传和环境因素被认为是CP的主要发病机制。除过量饮酒外,吸烟也是CP发生的独立危险因素[3]。约28%~80%的CP患者被归类为“特发性CP”,其中多达50%的患者存在基因突变,主要为丝氨酸蛋白酶抑制剂KazalⅠ型(serine protease inhibitor Kazal type 1, SPINK1)基因和囊性纤维化跨膜传导调节蛋白(cystic fibrosis transmembrane conductance regulator, CFTR)基因突变[1]。其他少见危险因素包括高钙血症、高三酰甘油血症、自身免疫性疾病以及环状胰腺等胰腺先天解剖异常。
全球CP发病率约为9.2/10万人年[(4.4~24.7)/10万人年],患病率为(44.0~153.9)/10万人[4]。我国CP发病率数据不多,中国慢性胰腺炎研究组开展的多中心回顾性调查显示,我国城市居民1996年和2003年的CP患病率分别约为3.1/10万人和13.5/10万人,患病率呈逐年增长趋势[5]。因此,国内亟需开展新的全国性流行病学调查,明确CP分布的最新动态。不同研究报道的CP发病率和患病率的差异与研究人群、CP的定义以及调查模式不同有关。新近发表的以人群为基础的丹麦全国性CP发病率和患病率变化趋势研究[4]显示,1994—2018年,丹麦CP总体平均发病率为12.6/10万人年,标化发病率保持稳定,标化患病率则从1996年的126.6/10万人上升至2016年的153.9/10万人,患病率升高主要与个体的总体预后和预期寿命得到改善、诊断性影像学技术的发展以及酒精性CP减少有关。近年来,随着人群吸烟和饮酒模式的改变,以及包括内镜超声(endoscopic ultrasono-graphy, EUS)、CT、MRI等在内的影像学技术的发展,更早地识别CP已成为可能。据报道,从1994年至2013年,美国MRI和CT的使用率分别增加312%和151%[6]。
CP发病率男性高于女性,男性发病率约为女性的2倍[7],这与更多的男性人群有吸烟、饮酒嗜好有关。男性CP发病多于女性还与胰腺腺泡细胞claudin-2相关X连锁CLDN2基因的风险等位基因有关,女性只有纯合子CLDN2基因型携带者易患酒精性胰腺炎,而男性半合子基因型携带者也易发生酒精性胰腺炎[8]。CP的发病年龄取决于其病因,酒精性CP患者通常于40~60岁出现症状,三分之二以上的患者为男性,而基因突变相关CP患者通常于10~40岁发病,男女患者数几乎相等[1,9]。一项涉及66例特发性CP的研究[9]中,25例早发型病例的中位发病年龄为19岁,41例迟发型病例的中位发病年龄为56岁;早发型病例病情进展明显慢于迟发型病例。
二、病理学
CP病情进展缓慢,胰腺腺泡细胞损伤后炎症因子激活,导致炎症级联反应和进一步的纤维化。其组织病理学特征包括小叶间和小叶内纤维化、腺泡细胞丢失、结构紊乱和导管扩张。乙醇的氧化代谢产物乙醛和非氧化代谢产物脂肪酸乙酯可致腺泡细胞损伤;吸烟引起的腺泡细胞损伤与尼古丁的毒性代谢物亚硝胺酮有关。胰腺星状细胞通常处于静息状态,受刺激后被激活,活化的胰腺星状细胞是CP慢性炎症和纤维化的重要介质。
三、临床表现
CP的临床表现主要包括疼痛、胰腺外分泌功能不全(腹胀、脂肪泻、营养不良等)和胰腺内分泌功能不全(糖耐量异常、糖尿病),还可出现黄疸、纳差、恶心、呕吐等非特异性症状。
疼痛是CP最常见、最主要的临床症状,可见于80%~90%的CP患者,严重影响患者生活质量。胰管结石和狭窄导致胰管内压增高,可引起疼痛,合并假性囊肿和胰腺癌时亦可引起疼痛,部分患者还可能存在神经源性疼痛[10]。CP疼痛的特点为上腹痛、腰背部放射痛和进餐后疼痛。疼痛模式可分为A型和B型两类,A型为间歇性疼痛,表现为阵发性短暂发作的疼痛,存在数日、数月甚至数年的无痛间期;B型为持续性疼痛,表现为持续性疼痛和阵发性疼痛加剧。Kempeneers等[11]关于CP疼痛模式的最新前瞻性队列研究共纳入源自荷兰30家医院的1 131例CP患者,589例(52%)为持续性疼痛,231例(20%)为间歇性疼痛,311例(28%)无疼痛;持续性疼痛患者的疼痛程度更为剧烈,需使用更多阿片类等止痛药物,生活质量更低;不同疼痛模式患者的影像学表现、病程和治疗方式无明显区别,且疼痛模式会相互转变。
胰腺外分泌功能不全的临床表现与胰酶分泌不足引起的消化不良有关,包括腹胀、脂肪泻、体质量减轻、脂溶性维生素缺乏等。据报道,42%~99%的CP患者会发生胰腺外分泌不足,轻、中度胰腺外分泌功能不全诊断较为困难,脂肪泻是严重外分泌功能不全的表现,常见于晚期CP患者,提示胰腺外分泌功能保留不到10%。研究[12]显示,约14%的CP患者在诊断时存在脂肪泻,确诊后1、5、10、20年的脂肪泻累积发生率分别为4.27%、12.53%、20.44%和30.82%。
胰腺内分泌功能不全表现为血糖异常。美国糖尿病学会和世界卫生组织将胰源性糖尿病定义为3c型糖尿病,3c型糖尿病在所有糖尿病中占8%,其中75%与CP有关[13]。一项关于CP确诊后糖尿病发生情况的meta分析共纳入15项研究8 970例患者,结果显示CP确诊后新发糖尿病发病率为30%(95% CI: 27%~33%),确诊后36个月内和60个月后,新发糖尿病患病率分别为15%和33%[14]。
50%以上的CP患者在病程中有复发性急性胰腺炎病史[15],因此临床上对于病因不明的复发性急性胰腺炎患者,需考虑CP并行相关基因检测等排查。CP是一种进展性疾病,部分患者可发生胰腺癌。Vujasinovic等[16]的研究探讨了CP患者的胰腺癌发生风险,581例确诊CP患者纳入分析,在3 423人年的观察期内共诊断6例胰腺导管腺癌(0.2%/年),确诊CP至胰腺癌发生的平均时间间隔为5.0年(2.7~8.6年),所有发生胰腺癌的患者均无胰腺癌家族史;胰腺癌诊断后平均生存时间为4个月(0.5~13个月),无急性胰腺炎病史者胰腺癌发生风险更高。发生胰腺癌的CP患者可出现黄疸、恶液质、腹痛性质改变等相应临床表现。
四、影像学、实验室检查和诊断
CT是临床诊断CP的主要检查手段,诊断敏感性较高。如CT检查无明显异常改变,但患者存在吸烟、饮酒、家族史、糖尿病或胰腺外分泌功能不全临床表现时,则需进一步行MRI评估,以明确胰腺实质和胆胰管情况。CT和MRI检查可发现胰腺钙化、胰管扩张和胰腺萎缩。磁共振胰胆管造影(magnetic resonance cholangiopancreatography, MRCP)主要用于检查胆胰管病变,如主胰管扩张、胰腺先天变异、胆管扩张或狭窄等。酒精性CP患者通常在症状出现时或症状出现后较短时间内出现相应的影像学改变,而特发性CP患者可能在症状出现后很长一段时间内无典型影像学改变。
当常规影像学检查无法确诊CP时,EUS有助于临床诊断,尤其是对早期CP和复发性急性胰腺炎的筛查具有优势。EUS对CP的诊断敏感性和特异性分别为81%(95% CI: 70%~89%)和90%(95% CI: 82%~95%)[17]。EUS与细针穿刺活检(fine needle aspiration, FNA)联合可获取组织病理学诊断,尤其是在胰腺肿瘤与肿块型CP的鉴别诊断中起有关键作用。EUS下弹性成像和造影增强更有助于胰腺病变的诊断和鉴别诊断。内镜逆行胰胆管造影(endoscopic retrograde cholangiopancrea-tography, ERCP)对CP有较高的诊断率,但作为一种侵入性检查手段,目前仍主要用于CP相关内镜治疗。
胰腺外分泌功能检测包括直接试验和间接试验。直接试验属侵入性检查,临床应用受限,本文不做赘述。间接试验常用的检测方法包括粪便弹性蛋白酶-1检测和13C混合三酰甘油呼气试验(13C-MTG-BT),但敏感性和特异性较低[18],目前国内仅有为数不多的几家医疗机构开展这些项目。因此,尚未出现典型脂肪泻的轻、中度胰腺外分泌功能不全的CP患者诊断较为困难。胰腺内分泌功能检测参照我国2型糖尿病防治指南中的相应标准[19],糖尿病诊断标准为空腹血糖≥7.0 mmol/L或随机血糖≥11.1 mmol/L或口服葡萄糖耐量试验(OGTT)2 h血糖≥11.1 mmol/L。未确诊糖尿病的CP患者建议每年进行一次血糖监测。
另外,对于特发性、青少年起病以及有胰腺疾病家族史的CP患者,可行基因检测,如SPINK1、CFTR、PRSS1等基因。
CP诊断的主要依据是典型影像学和组织病理学改变;次要诊断依据包括反复发作的上腹痛、血清淀粉酶异常、胰腺内分泌和外分泌功能不全表现、基因突变、大量饮酒史。主要诊断依据满足一项即可确诊;影像学或组织病理学呈现不典型表现,同时次要诊断依据满足2项或2项以上亦可确诊(图1)[18]。
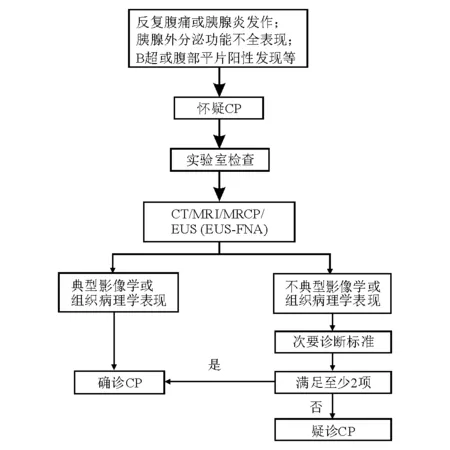
图1 CP诊断流程图
五、治疗
CP患者的生活质量明显降低,预期寿命亦显著缩短[20],当前的治疗策略旨在减轻CP相关并发症,并没有能有效逆转疾病进展的药物。首先,应建议患者停止吸烟和饮酒,改变不良生活习惯;可服用非甾体抗炎药以及曲马多等弱阿片类止痛药物;控制糖尿病首选二甲双胍和胰岛素;补充胰酶以及含硒、多种维生素和甲硫氨酸的抗氧化剂以改善腹胀、脂肪泻、维生素缺乏等胰腺外分泌功能不全表现,多达50%的CP患者症状可得到控制。
内镜治疗是CP相关胰管结石、胰管狭窄、胰腺假性囊肿、胆管狭窄等的主要治疗方法,有利于缓解胰源性疼痛,改善患者生活质量。研究表明,在CP患者的病程中,61%的患者需接受至少一次内镜干预,31%的患者需外科手术治疗[21]。存在胰管结石和狭窄致胰管阻塞的患者可行ERCP引流以降低导管内压力,从而缓解疼痛。对于体积较小的主胰管结石,可直接行ERCP取石;对于直径>5 mm、不透X线的主胰管结石,首选体外冲击波碎石术。Wang等[22]和Hao等[23]的研究证实体外冲击波碎石术是治疗胰管结石安全、有效的方法,<18岁的儿童和青少年患者、18~65岁的成人患者和>65岁的老年患者,在结石清除后随访3~4年,多数疼痛有效缓解,完全缓解率达到75%以上。ERCP支架置入是胆胰管狭窄最主要的治疗方法,首选置入单根塑料支架,支架通常留置6~12个月,如狭窄未得到明显改善,可考虑置入多根塑料支架或尝试使用全覆膜自膨式金属支架[24]。
20%~40%的CP患者存在胰腺假性囊肿,其中仅<10%的病灶会自发消退,且消退的假性囊肿直径一般<3 cm[25]。CP假性囊肿的形成可能是由于胰管内高压导致侧支或主胰管破裂,患者出现症状(腹痛、黄疸、流出道梗阻等)或伴有局部并发症(出血、感染、破裂等)时需予治疗,包括EUS引导下透壁引流或ERCP经乳头引流。无主胰管断裂时,可仅行透壁引流;部分主胰管断裂时置入1根支架桥接断裂处,但成功率仅33%~67%;主胰管完全断裂即存在胰管离断综合征时,移除透壁支架可导致复发,需考虑长期留置透壁“双猪尾”(double pigtail)塑料支架。
ERCP治疗胰管狭窄、结石或假性囊肿经乳头引流失败时,可行EUS引导下胰管引流术[21,26]。内镜治疗失败、疗效差或不能完全排除恶变等情况下,可行外科手术治疗(如胰空肠吻合术伴或不伴胰头切除术)。研究[27]显示,在接受升阶梯治疗[均衡饮食、胰酶、抗氧化剂→内镜和(或)手术干预]的CP患者中,随访至第15年,有近70%的患者维持疼痛缓解。然而,CP患者的疼痛原因是多方面的,部分患者内镜治疗后疼痛无明显缓解,可能是因为引流仍不够充分或疼痛系神经源性或是由其他因素引起,此时可考虑行EUS引导下腹腔神经丛阻滞术,总体成功率为95%,短期疼痛缓解率为50%~55%,但疼痛缓解维持时间短,12周和24周时疼痛缓解率分别仅为26%和10%;45岁以下的年轻患者和因CP接受胰腺手术者腹腔神经丛阻滞术效果更差[25]。
六、结语
CP是一种迁延不愈的难治性疾病,症状顽固,严重影响患者生活质量;最常见的病因是过度饮酒、吸烟和基因突变。腹痛是CP最常见的临床症状,治疗方法主要包括戒烟酒、止痛、胰腺功能替代,对于部分患者可予内镜治疗引流缓解梗阻;内科保守治疗或内镜治疗效果较差或治疗失败时,可考虑外科手术治疗。CP是一种进展性疾病,部分患者可发生胰腺癌,因此应定期随访和监测,并根据监测结果调整治疗方案。

