肠黏液屏障:从基础到临床*
熊艺琳 宋 军 侯晓华
华中科技大学同济医学院附属协和医院消化内科(430022)
肠道黏膜屏障是抵御外来病原微生物入侵和维持肠道内环境稳定的重要屏障,是将机体内环境和肠腔内环境分开的结构,主要包括机械屏障、化学屏障、生物屏障和免疫屏障。一旦肠黏膜屏障的完整性被破坏,外源性有害物质可侵犯宿主肠道组织,造成炎症和组织损伤。肠道的化学屏障即肠道黏液屏障,是隔离外来病原体与肠上皮的第一道防线。本文就肠黏液屏障的组成、功能、调控及其在疾病中作用的研究进展作一综述。
一、肠黏液屏障组成
1. 结构组成:肠黏液屏障由黏蛋白(主要是MUC2)、水、无机盐、免疫分子和促进致病菌清除的抗菌肽等组成,其中水占98%以上[1]。黏蛋白是高度糖基化的大蛋白质,包括分泌型黏蛋白和跨膜型黏蛋白[2]。分泌型黏蛋白(如MUC2)由杯状细胞分泌至肠腔后发生水合解聚,形成巨大的凝胶网状结构,成为黏液屏障的主要“支架”[3]。跨膜型黏蛋白位于上皮细胞顶端,具有跨膜结构域,使其能锚定于细胞膜,为胃肠道上皮细胞表层创造稳定的环境。
黏液屏障中还分布了多种分子,黏蛋白与水形成的网状结构为这些分子提供扩散屏障以更好地发挥作用。Paneth细胞可分泌α-防御素、隐窝素相关序列(CRS)肽、溶菌酶、胰岛素衍生蛋白REG3β和REG3γ、血管生成素4(ANG4)等,参与隔离细菌、抵御病原体入侵和肠道微生物群的形成[4]。此外,杯状细胞还分泌CLCA1、FCGBP、AGR2、ZG16、TFF3等,并可与黏蛋白相互作用,增加黏液层黏度[1]。
2. 肠段分布:肠黏液屏障在不同肠段分布不同。小肠黏液层疏松、未紧密附着于肠上皮,充满肠绒毛腔隙之间,同时覆盖绒毛尖端[5]。结肠黏液层由疏松、不附着的外层和紧密附着在肠上皮细胞的内层构成,外层结构与小肠黏液层类似,但其中可见大量共生菌定植[6];内层结构致密,其中某些内源性蛋白酶可将黏蛋白水解转化为外层黏液,体积扩大3~4倍,但不改变其网状结构[3]。
二、肠黏液屏障的形成过程
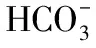
MUC2分为两种分泌形式,包括调节囊泡分泌和复合胞吐[8]。调节囊泡分泌主要是肠道表面杯状细胞在细胞骨架运动下的连续低水平分泌,即平时维持和更新黏液屏障的基础分泌,周期约3 h。而复合胞吐多见于隐窝处杯状细胞,在外来刺激的作用下,杯状细胞中储存的MUC2会在短时间内全部释放,形成新的黏液层,此时杯状细胞完全排空,黏蛋白恢复速度减慢,周期约6~8 h[2]。
三、肠黏液屏障的生理功能
1. 屏障作用:肠黏液屏障将肠道上皮与肠内容物、病原体、共生菌隔离开,从而避免肠上皮细胞受外源性物质的攻击。小肠形成的黏液层疏松,其间的孔径较大,可容许细菌等大分子穿透,但小肠内定植的细菌丰度远少于结肠,这是由于细菌被限制在黏液层的网状结构中。黏蛋白的聚糖支链也可与某些病原菌的特异性黏附素结合,防止其扩散,同时小肠通过运动将黏液及其中渗透的细菌等物质推向远端[2]。人结肠黏液层外层疏松,为共生菌定植,内层结构致密,可阻挡直径为0.5 μm的颗粒通过。
2. 免疫调节作用:黏液屏障中除一些固有免疫分子如sIgA发挥作用外,其余抗菌肽等分子亦可发挥不同的抗菌作用。杯状细胞分泌的肠三叶因子(TFF3)可与黏蛋白相互作用增加黏液层的黏度[9]。抵抗素样分子β(RELM-β)可直接杀死渗透入黏液层的共生菌和病原体[10]。α-防御素是Paneth细胞分泌的最主要抗菌肽,可与细菌细胞膜结合形成离子通道,导致细菌胞内容物泄露从而杀死细菌[11]。
黏蛋白及其聚糖可与免疫细胞上的凝集素样蛋白结合来发挥免疫调节作用[7],抗菌肽等分子与黏液混合扩散,并在肠道上皮至肠腔的黏液层中形成逐渐下降的浓度梯度,共同发挥免疫保护作用。
四、肠黏液屏障的结构组成和形成过程对功能的影响
1. 结构组成对功能的影响:黏蛋白和水形成的凝胶网状结构不仅将外源性有害物质和肠上皮隔开,发挥屏障作用,还为肠上皮细胞分泌的免疫分子提供扩散和稳定的场所,更好地发挥抗菌功能[12]。肠黏液屏障中的抗菌肽等物质与黏蛋白相辅相成、增强黏液层黏度,并通过不同途径发挥杀菌作用。
2. 形成过程对功能的影响:黏液屏障形成过程中最重要的步骤是黏蛋白的合成、分泌和水合解聚[8]。黏蛋白合成量过大时会使内质网负荷过重,引起内质网应激(ERS),进而导致黏蛋白错误折叠和杯状细胞凋亡[13]。正常情况下,黏液屏障需依赖杯状细胞通过调节囊泡的分泌来维持,而肠上皮受到外来刺激后,储存在杯状细胞囊泡中的黏蛋白被一次性排空,黏液层短暂性增多后由于储存的黏蛋白耗竭,又会进入黏液层减少的病理状态[2]。黏蛋白释放到肠腔后需要进行水合解聚,体积扩大1 000倍以上才能形成疏松的黏液层,这个过程需要meprin β金属酶的切割和Ca2+的解离作用,否则无法形成黏液屏障,甚至会导致肠梗阻等疾病[14]。
五、肠黏液屏障的调控
肠黏液屏障是直接与肠腔内容物接触的第一道屏障,既要消化吸收营养物质、维持对共生菌群的免疫耐受,又要抵御外来病原体的入侵,其稳态受到多个因素的调控和影响。
1. 形成过程调控:有研究表明,杯状细胞内质网特异性表达的IRE1β基因与MUC2的合成有关。在IRE1β基因敲除鼠中存在ERS现象以及MUC2的异常积聚[15]。给予ERS小鼠IL-10则可减少MUC2的错误折叠,并维持MUC2转运、O-糖基化和分泌,恢复正常黏液屏障的形成[16]。
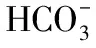
2. 共生菌群调控:人肠道中约有3.8×1013个细菌,在结肠中的菌群密度为1011/cm3~1012/cm3 [18],结肠外层黏液为共生菌群提供营养和繁殖环境,同时细菌可通过糖苷酶降解聚糖,利用聚糖残基进行生长代谢,这个过程也有助于MUC2降解。细菌发酵生成的短链脂肪酸(SCFA)又可被结肠吸收并提供能量,用于MUC2的合成和分泌[19]。共生菌还可分泌某些抗菌物质帮助阻挡病原体入侵,与黏液层相互作用,共同维持肠道内环境稳定。
乳酸菌表面的黏液结合蛋白可与黏液特异性结合,黏附在黏液层中。此外,鼠李糖乳杆菌的菌毛蛋白也显示出与黏蛋白的强结合力[6]。肠道菌群会产生多种碳水化合物活性酶,利用食物中难以消化的多糖或黏蛋白侧链的聚糖作为能量来源,如拟杆菌擅长利用膳食纤维产生SCFA、有机酸等代谢产物[8]。
不同菌群对肠道黏液屏障的形成也会产生不同影响。研究表明,拟杆菌可促进杯状细胞的分化以及黏蛋白相关基因的表达,促进黏液产生[20]。肠道菌群的定植占据了黏蛋白上可用的结合位点,一定程度上阻止了病原体的黏附。嗜黏蛋白艾克曼菌能促进黏蛋白的合成和降解,还有潜在的抗炎作用[21]。普拉梭菌可分泌微生物抗炎因子(MAM),抑制黏蛋白分泌相关NF-κB的信号转导和肠道炎症[22]。
六、肠黏液屏障与肠道疾病
1. 感染性疾病:志贺菌可导致人重度腹泻甚至死亡;在志贺菌感染的人肠道细胞模型中,MUC2表达上调,这被认为是宿主的肠道保护机制,黏液层在减少致病菌流动性的同时,志贺菌也会利用黏蛋白作为碳源进行代谢,打破固有免疫防御[23]。小肠结肠炎中耶尔森菌可通过黏蛋白降解酶增加黏液层的渗透性,使病菌更容易扩散和移动[6]。在轮状病毒感染鼠模型中MUC2表达上调和结构改变,给予感染组小鼠体外分离出的MUC2可有效中和并抑制病毒感染[24]。
研究发现多种蠕虫、寄生虫感染均会导致杯状细胞增生、黏液分泌增加。在旋毛虫感染鼠模型中,MUC2缺陷小鼠蠕虫排空时间较对照组延长,而抗感染小鼠黏液渗透性较易感小鼠低,说明黏液性质发生变化[25]。
因此,在肠道感染时,黏液屏障可通过刺激杯状细胞增生、大量释放MUC2、增加MUC2表达来抵抗病原微生物,中和毒素。病原体也可通过自身特性规避黏液屏障的捕获,打破平衡,接触肠上皮细胞造成感染。
2. 炎症性肠病(IBD):IBD是肠道黏膜免疫系统和共生菌群失衡的共同结果,溃疡性结肠炎(UC)和克罗恩病(CD)均存在不同程度的黏液屏障破坏。研究表明,UC患者结肠黏液中存在一系列糖基化异常,包括寡糖链长度缩短、硫酸盐化减少、唾液酸化增加等,导致黏液层的物理屏障功能降低[26]。活动性UC在杯状细胞内质网内可发现堆积有部分合成或折叠错误的黏蛋白,引起ERS,使成熟黏蛋白分泌减少,杯状细胞耗竭,分泌黏液速度减慢,黏液层变薄,同时黏液成分改变,糖基化产物、TFF3、防御素等减少,黏液通透性增加,使细菌能直接与上皮细胞接触,从而导致微生物群移位和免疫系统激活[27]。活动性UC杯状细胞的抗菌防御因子WFDC2表达失调,其与结肠黏液屏障内外层转换相关,可能是导致渗透性增加的发病机制之一[28]。
CD患者肠道黏液增厚,可能是由于细胞因子刺激黏液分泌。但黏液屏障的寡糖链长度缩短、唾液酸化增加,使细菌更易穿透[29]。有研究[30]表明,肠上皮细胞色氨酸代谢酶吲哚胺2,3-双加氧酶1(IDO1)表达会促进杯状细胞的分化和黏液的产生,CD患者回肠中表达与分泌水平呈正相关,说明IDO1可能是CD黏液变化的机制之一。
在IBD的发病中,黏蛋白的结构、分泌和黏液层厚度、渗透性等均受到不同程度破坏,最终导致肠道炎症持续发生,说明黏液屏障在IBD发病机制中起有重要作用,也可能为其治疗提供新的途径。
3. 肠易激综合征(IBS):肠黏液屏障在IBS中作用的研究目前不多,但IBS肠上皮通透性明显增加。在母体分离的IBS大鼠模型中,成年雄性后代的回肠MUC2表达上调,但给予IBS母鼠益生菌干预后,后代MUC2表达相应下调[31]。研究证实,IBS大鼠模型肠道含黏液的杯状细胞减少,黏蛋白O-聚糖结构发生变化,但肠道杯状细胞数量和MUC2并无明显改变[32]。因此,IBS是否伴随黏液屏障质量和结构变化,有待更进一步的研究证实。
4. 先天性疾病

②先天性巨结肠(HSCR):HSCR是较常见的新生儿消化道运动性疾病之一,17%~50%的患者会并发相关小肠结肠炎(HAEC),可导致腹泻、败血症,甚至死亡[35]。研究表明,HSCR患者远端结肠杯状细胞数目增加,HAEC的发展与黏蛋白比例增多相关[36]。HSCR患者的杯状细胞特异性分化因子SPDEF、KLF4表达显著降低,杯状细胞表达产物TFF3下降[35]。
5. 肿瘤性疾病:结直肠癌分泌黏蛋白的能力是其特性之一,结直肠癌患者MUC2表达显著下降,但与癌症分期无关。黏液性结直肠腺癌的预后较非黏液性腺癌差,且MUC2高表达。研究表明,MUC2高表达的结直肠癌转移至肝脏的概率增加,若接受新辅助化疗者的主要病理表现为黏蛋白池,其预后则非常差[37]。
七、肠黏液屏障与肠外疾病
1. 急性胰腺炎:在急性胰腺炎小鼠模型中,肠黏液屏障通透性增加,黏液层丢失但绒毛未见损伤,这与活性氧、活性氮中间体(RNI)介导的黏液损伤和黏液抗氧化能力降低有关,而24 h后,又可观察到黏蛋白反弹性分泌增多,此时杯状细胞完全排空[38]。通常认为急性胰腺炎引起的低血容量和全身性炎症状态会导致内脏的血液分流至全身循环,继而造成肠缺血-再灌注损伤,这对于肠道黏液屏障具有刺激作用。缺血会导致黏液层与肠上皮分离,外来病原体可直接接触肠上皮甚至到达隐窝,引起杯状细胞的复合胞吐,重新快速形成新的黏液层[2]。
2. 非酒精性脂肪性肝病(NAFLD):肠-肝轴在NAFLD进展中起有重要作用。对NAFLD患儿的研究[39]表明,肠道通透性明显增加且与肝纤维化严重程度呈正相关,同时存在肠道菌群移位。动物研究中给予轻度肝脂肪变性的小鼠葡聚糖硫酸钠,可促进肝炎和肝纤维化发生[40]。NAFLD模型组小鼠肠道sIgA水平明显下降,抵抗细菌和内毒素能力减弱,导致肠源性内毒素血症的发生[41]。这在一定程度上说明NAFLD患者的黏液屏障成分发生了变化,为进一步寻找NAFLD的发病机制与治疗提供新思路。
八、展望
总之,肠道黏液屏障在很长一段时间都被认为只有润滑、隔离的作用,目前越来越多的证据表明,作为一道“动态”屏障,在抗感染、肠道免疫调节以及肠道和肠外疾病发生等方面均发挥重要作用。对其功能和调控机制的深入研究,可能为相关疾病的治疗提供新的方向。

