高龄供肝对肝移植术后并发症的影响
——148 例受者预后分析及思考
杨梦凡,魏绪勇,王琨,鲁迪,陈俊丽,岑贝妮,杨墨丹,郑树森,3,徐骁
(1.浙江大学医学院附属第一医院肝胆胰外科,浙江 杭州 310003;2.国家肝脏移植质控中心,浙江 杭州 310003;3.树兰医院肝胆胰外科,浙江 杭州 310004)
自2015 年以来,公民逝世后器官捐献(organ donation after death,DCD)成为我国除活体移植外最主要的供体器官来源。随着我国逐渐步入人口老龄化社会,高龄供者所占比例逐渐上升。由于高龄供者肝脏较年轻供者肝脏再生能力差、肝脏萎缩体积减小、纤维化明显、肝动脉粥样硬化发生率高、对缺血/再灌注损伤更为敏感,因此其更容易影响受者预后,但目前关于高龄供肝的具体界定还比较模糊。本研究旨在分析高龄供肝对肝移植术后移植物功能及受者生存率的影响及其干预策略,为边缘性供肝拓展使用提供理论依据。
1 材料和方法
1.1 临床资料与研究分组:本研究采用倾向性评分匹配模型进行配对,以减少患者基线特征差异导致的选择偏倚。根据供者年龄≥或<60 岁1:1 配对选取2016 年1 月—2017 年6 月于浙江大学医学院附属第一医院、树兰医院行肝移植手术的患者,分为高龄供者(elderly donor, ED, n =74)组和非高龄供者(non-elderly donor, NED, n =74)组。NED 组与ED 组配对患者间供肝脂肪变性程度相同,冷缺血时间(cold ischemia time, CIT)±1 h,原发病良恶性相同。本研究符合《赫尔辛基宣言》,全部供肝均来源于公民逝世后器官捐献并经医院伦理委员会审批同意。
同时按照CIT ≥或<12 h、受者术前终末期肝病模型(model for end-stage liver disease,MELD)评分≥或<20 分、移植物重量≥或<1 300 g、受者原发病良恶性进一步分组,对比分析不同组别受者术后移植物早期功能不全(early allograft dysfunction, EAD)、原发性移植物无功能(primary non function, PNF)、胆道并发症发生率及移植物、受者生存率之间的差异。
1.2 术式与免疫抑制方案:本文受者术式均为背驮式。术后7 d 内每日化验肝肾功能、血常规和凝血功能等,术后1 个月内每周检查1 次上述指标。术中 及术后第4 天分别使用巴利昔单抗,术后使用经典三联免疫抑制方案 (环孢素/他克莫司+吗替麦考酚酯+泼尼松),或使用无激素免疫抑制剂方案[2]。
1.3 随访与临床转归:本研究中肝移植受者均规律随访,统计受者移植术后EAD、PNF 及胆道并发症发生率,移植物和受者1 年生存率等。
1.4 诊断指标:供肝脂肪变性定义:根据肝细胞胞质内脂肪空泡的含量,分为轻、中、重三级, 其脂肪变比例分别在<30%、30%~60%、>60%, 脂肪空泡含量<5%可认为是无脂肪变性[3]。
EAD 诊断标准:① 术后7 d 内丙氨酸转氨酶(alanine aminotransferase,ALT)或天冬氨酸转氨酶(aspartate aminotransferase,AST) >2000 U/L; ② 术后第7 天凝血酶原时间国际标准化比值 (international normalized ratio,INR)≥1.6;③ 术后第7 天总胆红素(total bilirubin,TB)≥171 mmol/L[4]。
PNF 诊断标准:受者术后肝功能极差、术后7 d 内需要进行再次移植[5]。
1.5 统计学方法:采用SPSS 23.0 软件进行统计学分析。计量资料数据采用均数±标准差(±s)表示,采用t 检验,计数资料采用频数表示,率的比较采用χ2检验,Kaplan-Meier 检验进行生存分析。P <0.05 为差异有统计学意义。
2 结 果
2.1 入选病例的基线数据比较:ED 组供者的平均年龄为(64.09±3.06)岁;受者的平均年龄为 (53.80±6.81)岁。NED 组供者的平均年龄 为(41.10±11.04)岁; 受者的平均年龄为(46.25± 7.38)岁。经倾向性评分匹配后,ED 组与NED 组患者在性别、供肝脂肪变性程度、体重指数(body mass index,BMI)、移植物重量、冷缺血时间(cold ischemia time,CIT)、热缺血时间(warm ischemia time,WIT)、血钠水平、终末期肝病模型(model for end-stage liver disease,MELD) 评分、CHILD 分级、原发病良恶性类型、捐献方式、供受者血型等方面均无统计学差异。基线数据详见表1。
2.2 受者术后早期肝功能恢复情况:ED 组患者术后EAD发生率为47.3% (35/74),PNF发生率为2.7%(2/74)。NED 术后EAD 发生率为28.4%(21/74),PNF 发生率为1.4%(1/74)。ED 组EAD 发生率显著高于NED 组 (P <0.05),见图1。
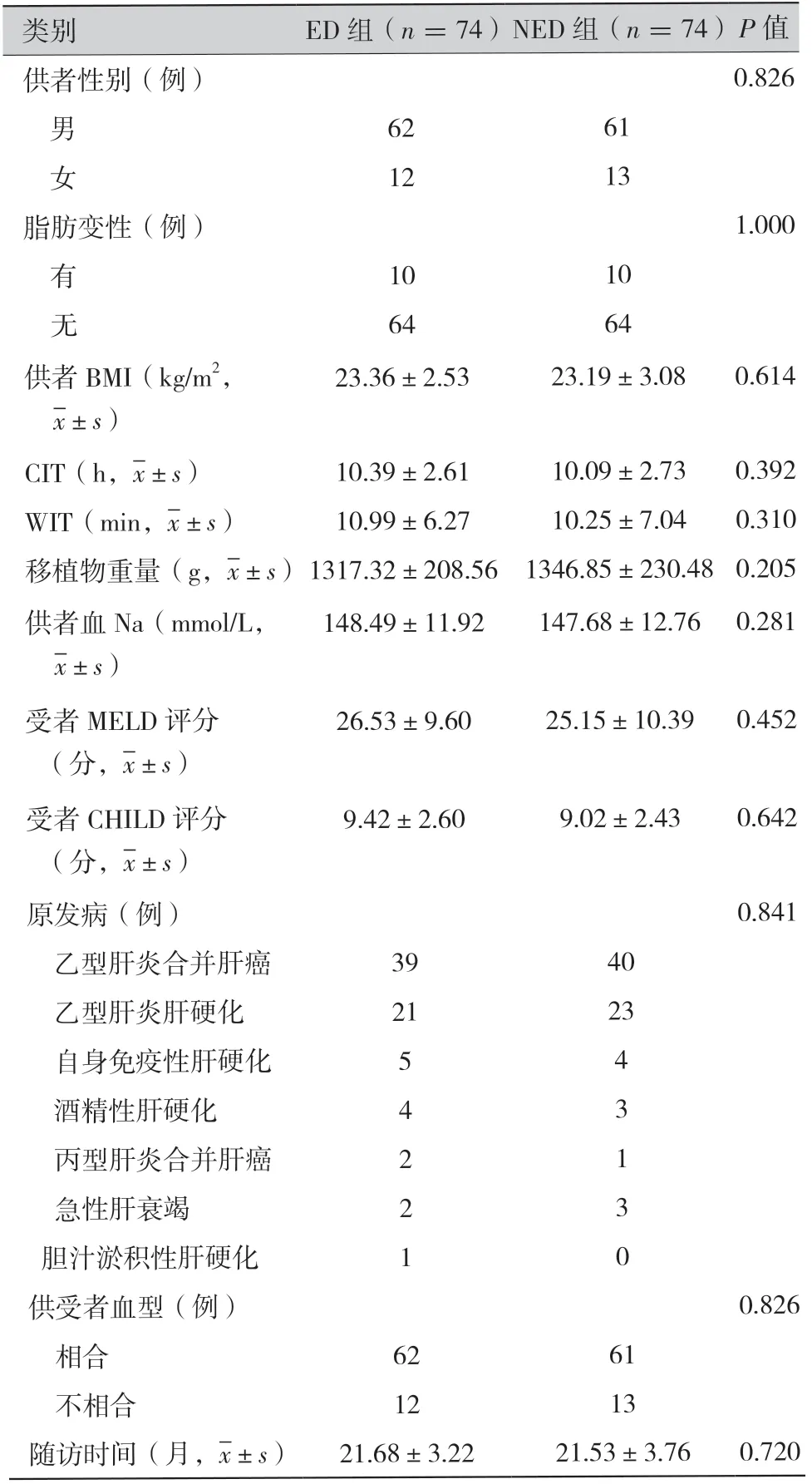
类别ED 组(n =74)NED 组(n =74)P 值供者性别(例)0.826 男6261 女1213脂肪变性(例)1.000 有1010 无6464供者BMI(kg/m2, images/BZ_37_1351_1170_1373_1213.png±s)23.36±2.5323.19±3.080.614 CIT(h,images/BZ_37_1351_1170_1373_1213.png±s)10.39±2.6110.09±2.730.392 WIT(min,images/BZ_37_1351_1170_1373_1213.png±s)10.99±6.2710.25±7.040.310移植物重量(g,images/BZ_37_1351_1170_1373_1213.png±s)1317.32±208.56 1346.85±230.48 0.205供者血Na(mmol/L, images/BZ_37_1351_1170_1373_1213.png±s)148.49±11.92147.68±12.76 0.281受者MELD 评分 (分,images/BZ_37_1351_1170_1373_1213.png±s)26.53±9.6025.15±10.390.452受者CHILD 评分 (分,images/BZ_37_1351_1170_1373_1213.png±s)9.42±2.609.02±2.430.642原发病(例)0.841 乙型肝炎合并肝癌3940 乙型肝炎肝硬化2123 自身免疫性肝硬化54 酒精性肝硬化43 丙型肝炎合并肝癌21 急性肝衰竭23 胆汁淤积性肝硬化10供受者血型(例)0.826 相合6261 不相合1213随访时间(月,images/BZ_37_1351_1170_1373_1213.png±s)21.68±3.2221.53±3.760.720
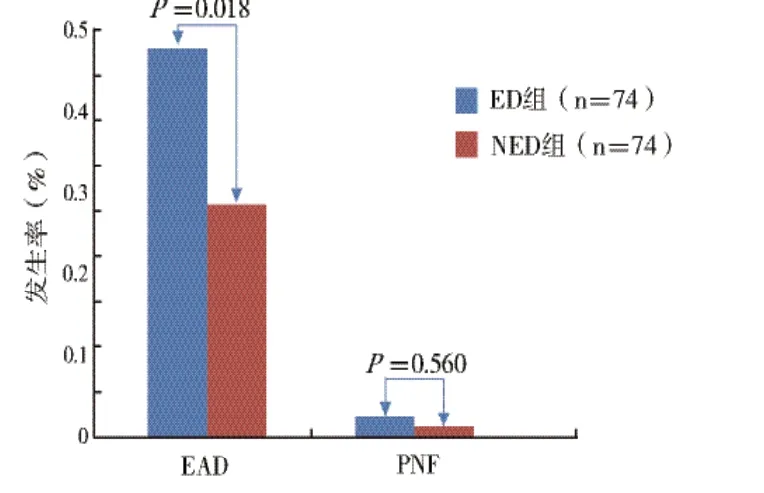
图1 ED/NED 组术后移植物功能恢复并发症比较
2.3 术后并发症情况:ED 组胆道并发症发生率为21.6%(16/74),显著高于NED 组。ED 组中胆漏共发生10 例,胆道吻合口狭窄6 例。NED 组胆道并发症发生率为9.5% (7/74),其中胆漏共发生4例,胆道吻合口狭窄3 例。两组间胆漏和胆道狭窄发生率均无明显统计学差异(P >0.05),见图2。
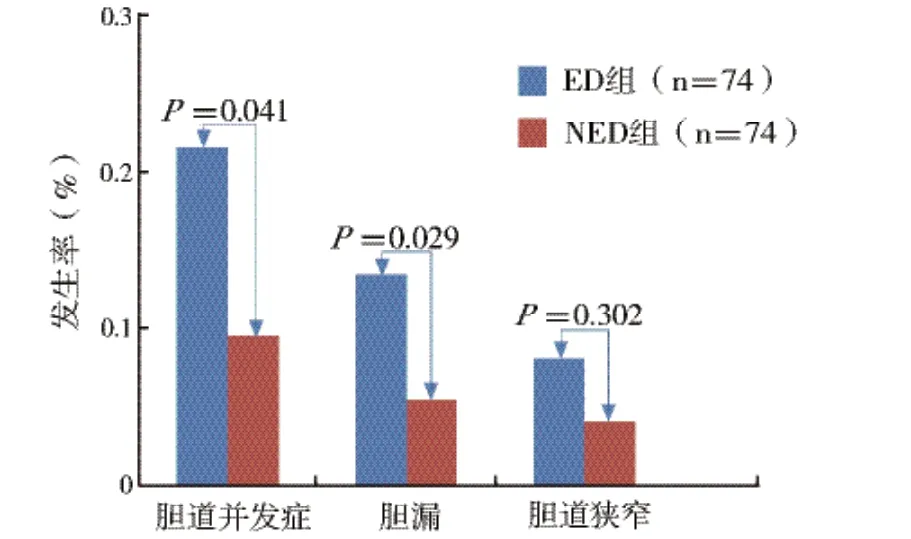
图2 ED/NED 组术后胆道并发症比较
2.4 移植物与受者生存分析:Kaplan-Meier 生存曲线分析显示两组移植物1 年生存率差异具有统计学意义(P =0.023),但ED 组受者1 年生存率与NED 组相比,结果无统计学差异(图3)。
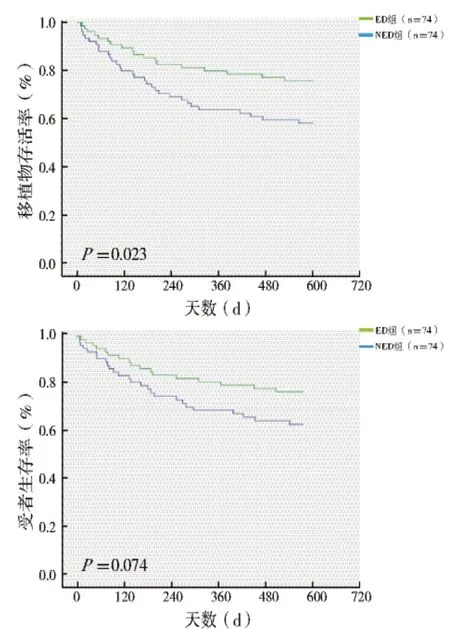
图3 移植物、受者1 年生存曲线分析图
2.5 危险因素亚组分析:ED 组CIT >12 h 受者EAD 发生率为70.6%,显著高于CIT <12 h 的受者40.4% (P =0.003)。NED 组中CIT >12 h 与<12 h 受者术后并发症发生率无统计学差异。ED 组中CIT <8 h 的受者共16 例,其中4 例出现EAD,发生 率为25.0%,与NED 组中CIT <8 h 的受者EAD 发生率23.5% (4/17) 相似。ED 组MELD 评分>20 分 受者术后1 年生存率及移植物1 年存活率均低于MELD 评分≤20 分受者,但其差异并不显著。移植 物重量>1 300 g 与<1 300 g 及原发病良、恶性在两组中对移植物及患者预后的影响无显著差异。
3 讨 论
供肝短缺是限制肝移植发展的瓶颈难题, 高龄边缘供肝的合理应用是增加供肝来源的重要途径,但是目前对于高龄供肝的使用标准及安全性仍无明确结论[6]。Sass 等[7]将扩展标准捐助者(extended-criteria donors, ECD)的年龄限制在 60 岁,并认为高龄供肝由冷缺血导致的肝细胞及内皮细胞损伤发生更早,增加了移植术后动脉血栓、T 细胞介导排斥反应的发生率[8]。
高龄供肝最主要的病理变化是肝细胞老化、 数量减少、再生能力受损,细胞内细胞器随着年龄增长其所占比重逐渐下降,细胞核出现空泡,溶酶体体积和数量增加,多种水解酶活性增强[9]。此外,衰老肝细胞内线粒体体积增大、数量减少,对应激的耐受性降低,这些因素都会增加EAD、PNF 发生率[10]。肝动脉粥样硬化在高龄供肝中也较为常见,增加了移植术后肝动脉血栓形成和缺血性胆道狭窄的发生风险[11]。
本研究发现,ED 组EAD 发生率显著高于NED组。在移植物生存率及受者生存率方面,分析发现ED 组移植物1 年生存率显著低于NED 组,而受者1 年生存率在两组间无明显统计学差异,表明高龄是移植物丢失的重要危险因素,而及时进行再次肝移植手术可以提升受者生存率。上述结果与Lee 等[12]进行的大样本单中心队列研究结果一致,其多变量分析显示EAD 发生与供者年龄密切相关, EAD 受者移植物存活率显著低于非EAD 受者。一项基于美国器官资源共享网络2 351 例肝移植数据的回顾性研究表明,供者年龄>50 岁被认为是与移植物功能衰竭最相关的因素之一[13]。西班牙康普顿斯大学一项对351 例肝移植受者回顾性研究发现,供者年龄<60 岁和年龄≥60 岁的移植术后EAD 发生率分别为0.9%和9.3%,高龄供者术后EAD 发生率显著增加,但移植物和受者存活率不受供者年龄影响[14]。既往回顾性病例对照研究在按年龄分组时往往忽略其他影响受者预后的危险因素,易造成选择偏倚。此外,本研究发现ED组CIT >12 h 会进一步增加EAD 的发生率,但在CIT <8 h 的16 例患者中,EAD 发生率仅为25%,这表示在高龄供肝的使用中,缩短CIT 可以明显减轻肝细胞的损伤,这与Chapman 等[15]、Wang 等[16]结论相同,缩短CIT 是改善使用高龄供肝受者预后的关键策略。
本研究还发现,ED 组胆道并发症总发生率显著高于NED 组。这与德国的一项研究结论相同,高龄供肝与受者胆道并发症发生率呈正相关, 且移植术后胆道供血不足是造成胆管吻合口狭窄和胆漏的主要原因[17]。本研究中两组患者胆道并发症发生率分别为21.6%和7.5%,此数据略高于其他肝移植中心,可能与两组样本病例中ABO 血型不合的比例相对较高有关(16.2%, 17.6%)。Kishida 等[18]的研究认为ABO 血型不合显著增加了微血管栓塞的发生率,并可引起缺血性胆道损伤(ischemia-type biliary lesions, ITBL),最终形成弥漫性肝内胆道狭窄[19-20]。
术前MELD 评分是影响肝移植预后的重要因素之一。Kim 等[21]对使用高龄供肝的受者进行严格挑选,发现MELD 评分>20 分的受者使用供者年龄>65 岁的供肝,其术后5 年生存率会显著降低,而MELD 评分<20 分的受者使用高龄供肝,其生存率不会受到影响。Westerkamp 等[22]通过多中心回顾性研究比较分析高龄供肝(>65 岁)对受者移植后并发症的影响,发现CIT 短、MELD 评分低的受者使用高龄供肝与使用非高龄供肝相比,术后并发症发生风险并未显著增加。因此为了更好匹配供受体,降低移植术后风险,供者年龄-MELD等评分系统相继被提出。这些评分系统有助于平衡供者-受者危险因素,将老年供肝分配给低MELD 评分受者,从而改善移植物和患者存活 率[23]。Wang 等[16]认为重量>1 600g 的移植物常伴随着相对较低的血液灌注,会导致EAD 发生率升高,但移植物与受者重量比(graft and recipient weight ratio, GRWR)并不是EAD 发生的独立危险因素。一些临床预测模型均将移植物重量列为EAD 发生的风险因素,认为大重量的移植物更容易使受者发生EAD[24-25]。然而我们的研究并没有发现移植物重量对受者术后并发症的发生有显著影响。
高龄供肝通常被认为纤维化程度较高,术后会更快进展为肝硬化,从而降低移植肝存活率。但一些学者认为供者年龄≥50 岁甚至≥80 岁的老年供肝再生能力虽然受损,但移植物仍可以安全使 用[26-28]。在日本,50 岁以上和60 岁以上捐赠者的比例分别为18.1%和4%,且由于捐赠者持续短缺,预计今后老年捐赠者的人数会增加[29-30]。供者年龄本身不应作为器官捐献的排除指标,应在捐献前对供者进行综合评估,特别是应尽量缩短CIT以减轻对肝脏的损伤[31]。
Dronacharya 等[32]将理想供体规定如下:年龄<40 岁,死亡原因为外伤所致,脑死亡后捐献,获取时血流动力学稳定,供肝无脂肪变性或任何其他慢性肝损伤,无传染性疾病等。理想供肝固然会降低移植受者术后并发症的发生,改善患者预后,但是对于绝大多数需进行肝移植手术的终末期肝病患者来讲,尽早进行手术更能保证他们的生存率。因此,如何更加优化高龄供肝的使用是解决供肝资源短缺这一瓶颈难题的有效手段。

