器官移植术后乙型肝炎病毒感染诊疗规范(2019 版)
中华医学会器官移植学分会
乙型肝炎病毒(hepatitis B virus, HBV)是嗜肝双链环状DNA 病毒,完整的乙肝病毒颗粒为直径约42 nm 的球形,由包膜和核心颗粒组成。包膜含乙型肝炎表面抗原(hepatitis B surface antigen,HBsAg)、糖蛋白和膜脂质,核心颗粒内含双链环状HBV DNA、HBV DNA 聚合酶和乙型肝炎核心抗原(hepatitis B core antigen,HBcAg)。完整形态的HBV 对肝细胞具有强力的感染性,又称Dane 颗粒。
1 流行病学
人体对HBV 普遍易感,非移植患者HBV 主要的传播途径包括血液传播(输血和血制品)、 母婴传播(分娩和哺乳)、性接触传播、密切接触传播、吸毒者或医源性传播。目前已证实唾液、汗液、 精液、阴道分泌物、乳汁等体液中均含有HBV。此外,不容忽视的是,对于器官移植受者,供者来源的HBV 感染以及受者既往有HBV 感染的情况 〔乙型肝炎核心抗体(hepatitis B core antibody,抗-HBc)阳性〕,术后HBV 再激活的风险高。
据世界卫生组织统计,2015 年全球约有 2.57 亿人感染HBV,占全球总人口的3.5%,其中68%的感染者集中在亚洲和非洲[1]。中国在 1979 年、1992 年 和2006 年 分 别 对HBV 感 染 标志物进行大规模抽样调查[2],虽然由于时代的进步采用的检验方法不尽相同,但是可以发现中国人群的HBsAg 阳性率呈逐渐下降的趋势,似与近年来大规模新生儿乙型病毒性肝炎(乙肝)疫苗接种有关。据中国疾病预防控制中心(Chinese Center for Disease Control and Prevention,CDC)的报告,HBsAg 阳性率和抗-HBc 阳性率已经分别从 1992 年 的9.8% 和45.8% 降 至2006 年 的7.2% 和34.1%[3-4],尤其是年龄<5 岁儿童的HBsAg 流行率仅为1.0%,比1992 年(9.8%)降低了近 90%[5],至2014 年,已 降至0.32%[6]。最 新报道的疾病推算模型表明,我国仍有HBV 携带者 8 600 万人[7],其中绝大多数与HBV 感染相关。据中国肝移植注册系统(China Liver Transplantation Registry, CLTR)2015 年的统计数据,肝移植受者中病毒性肝炎占74.79%,其中乙肝占71.25%[8]。 因此,HBV 相关肝移植术后面临的重要问题就是HBV 的再感染,如不加以干预,再感染率 超过90%[9]。
实体器官移植(solid organ transplant,SOT)受者是HBV 的易感人群。在我国,肾移植受者HBV 多为术前感染,终末期肾病患者规律血液透析是HBV 感染的重要原因。在早期的报道中, 我国肾移植受者HBV 感染率可高达77.5%[10]。
2 SOT 术后HBV 再感染或新发感染的危险因素
SOT 术后HBV 再感染或新发感染的危险因素主要包括供、受者的HBV 感染状态和围术期的处理。肝移植受者HBV 再感染主要与以下因素有关:① 受者体内残余病毒导致的再感染;② 供肝携带HBV;③ 输血或血液制品存在病毒污染;④ 术后与感染人群接触导致的再次感染;⑤ 术后应用免疫抑制剂增加HBV 再感染的风险。此外,HBV 基因突变导致耐药会影响抗病毒药物的治疗效果, 以及受者对预防性抗病毒治疗的依从性不佳亦可增加再感染的风险。
随着我国公民逝世后器官捐献的迅速发展,对于肝脏以外的肾脏、心脏、胰腺等其他器官移植受者来说,供体来源的HBV 感染也是十分重要的问题。我国移植肾供者中既往HBV 感染率较高是导致肾移植受者感染HBV 的危险因素。肝移植术后HBV 再感染或新发感染会影响肝移植受者的长期存活已经得到公认,但是肾移植术后HBV 感染是否显著降低肾移植受者的长期存活率还存在 争议[11]。
3 SOT 术后HBV 再感染或新发感染的诊断
SOT 术后HBV 再感染或新发感染的诊断有赖于实验室检查,这些指标是判断HBV 感染状态和肝脏损伤的依据,主要包括:HBV 病毒学标志物 (包括HBsAg 等,表1)、HBV DNA、丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、γ-谷氨酰转移酶(γ-glutamyl transferase,γ-GT)、总胆红素(total bilirubin,TB)、白蛋白、血细胞计数和血浆凝血酶原时间。
3.1 HBV 病毒学标志物
3.1.1 HBsAg 与乙型肝炎表面抗体:HBsAg 阳性是HBV 感染的标志,但其不能反映病毒的复制、传染性及预后。乙型肝炎表面抗体(hepatitis B surface antibody,抗-HBs)是一种保护性抗体,有清除HBV 并防止再感染的作用。接种乙肝疫苗者需长期保持抗-HBs 滴度≥10 U/L。
3.1.2 乙型肝炎e 抗原与乙型肝炎e 抗体:乙型肝炎e 抗原(hepatitis B e antigen,HBeAg)是HBV复制和具有传染性的标志,也是HBV 急性感染的早期标志。乙型肝炎e 抗体(hepatitis B e antibody,抗-HBe)是HBeAg 的特异性抗体,由HBeAg 阳性转为抗-HBe 阳性,意味着HBV 复制减弱或停止,以及传染性降低。
3.1.3 HBcAg 与抗-HBc:HBcAg 主要存在于受感染的肝细胞的细胞核内。抗-HBc 是HBcAg 的特异性抗体,既往有HBV 的感染史的患者,抗-HBc往往终身阳性。抗-HBc IgM 是HBV 感染后最早出现的抗体,是急性HBV 感染的重要血清学标志。由于HBcAg 很难检测到,且与抗-HBc 具有高度的一致性,因此HBcAg 在临床上往往不作重复 检测。
以上血清学指标多采用酶联免疫吸附试验(enzyme-linked immune absorbent assay,ELISA) 检测。
3.1.4 HBV DNA:HBV DNA 位于HBV 内部,与HBeAg 几乎同时出现于血清中,是HBV 感染最直接、最特异性的指标。采用实时定量聚合酶链反应法检测HBV DNA,不仅能够诊断是否存在HBV 感染,还能够评估抗病毒治疗效果。必要时,可行肝组织病理活组织检查(活检)及免疫组化检查进一步明确诊断。
3.1.5 血清HBV 耐药突变基因:血清HBV 耐药突变基因检测是肝移植手术前后选择核苷酸类似物(nucleotide analogs,NAs)抗病毒药物的依据。以往主要检测YMDD 基因(rtM204 位点)变异以针对拉米夫定(lamivudine, LAM)耐药。目前临床一线的抗病毒药物为恩替卡韦(entecavir,ETV)或富马酸替诺福韦酯(tenofovir disoproxil fumarate, TDF),HBV 耐药基因的检测均为多基因位点的联合检测,包括rtL80、rtV173、rtL180、rtA181、rtM204 和rtN236 位点等。
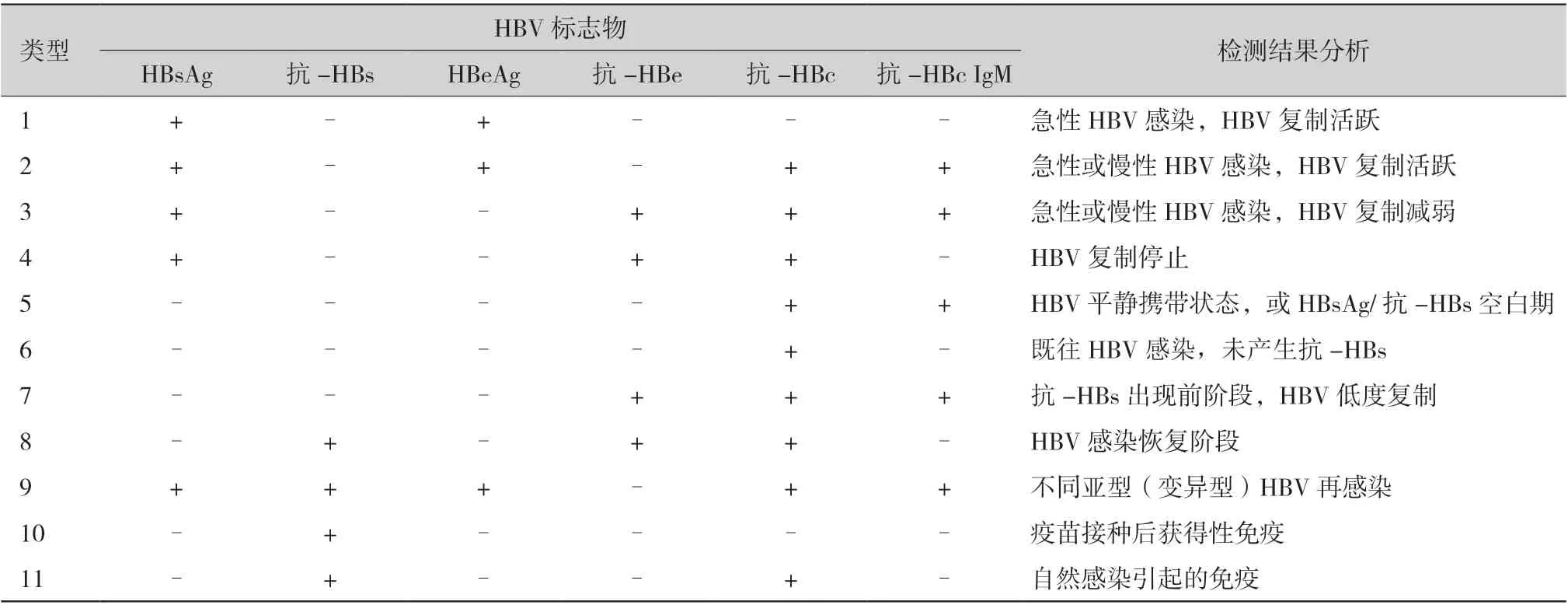
表1 HBV 标志物检测与结果分析
3.2 器官移植术后HBV 的再感染或新发感染:有下列任何一项阳性即可诊断:① 血清HBsAg 和 (或)HBeAg 阳性;② 血清HBV DNA 阳性;③ 肝组织HBsAg 和(或)HBeAg 阳性;④ 肝组织HBV DNA 阳性。
3.3 乙型肝炎复发或新发:符合HBV 再感染或新发感染诊断,合并以下情况之一的可以诊断乙肝复发或新发:① 肝功能异常,并排除其他可能的原因;② 有病毒性肝炎的症状和体征;③ 肝活检组织病理符合病毒性肝炎改变。
3.4 HBV 感染引起的临床病程:HBV 感染引起的临床病程多样,可为无症状HBsAg 携带状态,也可以引起急、慢性肝炎,肝硬化,或诱发肝细胞癌(肝癌)。病情严重者可因暴发性肝炎迅速死亡。肝移植术后乙肝的临床表现可分为两种:① 暴发型,起病急,肝功能迅速恶化;主要表现为黄疸进行性加重,AST 和ALT 先升后降,胆红素升高,且以直接胆红素为主,而后呈现胆酶分离;乙肝标志物(HBsAg 及HBeAg)阳性,HBV DNA 阳性,从肝功能恶化到死亡一般不超过1 个月。② 迁延型,多在肝移植6 个月后复发,临床症状轻,肝功能恶化缓慢,不易与排斥反应和药物不良反应鉴别,若不及时治疗可转为暴发型。
4 SOT 术后HBV 再感染或新发感染的预防和治疗
4.1 药物选择:为了预防和治疗肝移植术后HBV的再感染,过去临床上多采用LAM 联合小剂量乙型肝炎人免疫球蛋白(hepatitis B immune globulin,HBIG)为基础的治疗方案,成功使肝移植术后HBV 再 感 染 率 由90% 降 至10% 以 下[12-13]。虽然LAM 的疗效稳定,但是其最大的缺点是可以诱导HBV 基因变异,其中YMDD 基因的变异最为常见。有文献报道,在慢性乙肝患者中持续服用LAM 6 个月,即可出现YMDD 变异,用药1 年耐药率为15%,用药2 年耐药率可达38%[14]。近年来,多种NAs 如ETV、TDF、替比夫定(telbivudine,LDT)、阿德福韦酯(adefovir,ADV)的出现,为防治肝移植术后HBV 再感染提供了更多选择。
4.2 评估供者HBV 感染状况避免HBV 通过供体器官传播:在移植术前明确供者的HBV 感染史并进行HBV 病毒学检测,为器官的利用提供HBV评估依据。HBV 血清标志物(HBsAg、抗-HBs、HBeAg、抗-HBe、抗-HBc)和HBV DNA 是 判断供体器官HBV 感染状态的最主要指标。供者上述指标均阴性或仅抗-HBs 阳性时,供体器官携带HBV 的风险低。
除抗-HBs 外的其他标志物阳性时,供者器官不同程度地存在传播HBV 感染的风险。供者血清HBsAg 阴性而抗-HBc 阳性时,供肝或供肾携带潜在HBV 的风险增加[15]。接受此类器官移植的受者,均应在术后及时采用抗HBV 药物(NAs 联合HBIG)预防HBV 感染[16],只要处理及时得当,此类供体是十分安全的,并不会引发受者HBV 的感染[17]。然而,最安全的做法仍是将此类供体器官优先分配给存在HBV 感染的受者[18],其次分配给抗-HBs 阳性的受者,最后为HBV 血清标志物阴性的受者。
过去,HBsAg 阳性的供者器官对于HBsAg 阴性受者的择期移植是绝对禁用的,除非在紧急情况下作为一种抢救并延长生命的有效手段,如急性肝衰竭的危重患者或预期生存期较短的肝脏恶性肿瘤晚期患者。但近年来有报道显示,在有效抗病毒治疗的情况下,HBsAg 阳性供者可作为安全的供体移植给HBsAg 阴性受者[19-20],其在移植物原发性无功能、排斥反应、胆道并发症等方面与HBsAg阴性供体无显著差别[21]。但是受者术后HBsAg 均转为阳性,并且需要持续抗HBV 治疗[21-22]。接受HBsAg 阳性供肝的受者术后治疗方案采用NAs 联合大剂量HBIG 方案:NAs 选用ETV 或ADV 联合LAM;术中无肝期应用大剂量HBIG 8 000 U,术后1 周内每日HBIG 2 000 U,此后根据抗-HBs 滴度调整剂量及输注方式,逐渐减量直至低剂量HBIG维持或停药[21]。
4.3 HBV 相关移植的HBV 感染预防方案:HBV相关的肝移植术前,对于HBV DNA 阳性的患者,在决定肝移植后应立即开始服用高耐药基因屏障NAs 药物,如ETV 或TDF,疗程在2 周以上,并最好在HBV DNA 转阴后再行肝移植手术;对于HBV DNA 阴性的患者,宜于肝移植术前1 ~2 周开始服用高耐药基因屏障NAs 药物(ETV 或TDF)行预防性治疗。
HBV 相关的肝移植术中,应用HBIG 中和HBsAg 是阻止HBV 再感染的关键措施。HBIG 的推荐方案为:HBV DNA 阳性受者,术中无肝期静脉注射HBIG 不低于4 000 U;HBV DNA 阴性受者,术中无肝期静脉注射HBIG 不低于2 000 U。若术中静脉注射HBIG 后肝移植受者失血量较大,可适当增加剂量。
HBV 相关的肝移植术后,应用NAs 联合小剂量HBIG 方案预防HBV 再感染。宜选用高耐药基因屏障NAs 药物,如ETV 或TDF。荟萃分析显示,采用该联合治疗方案的HBV 再感染率仅为1%[23],显著优于LAM+HBIG 方案。术后HBIG 的推荐使用方案为:术后前3 d,1 000 U,静脉注射,每日1 次;此后400 U,肌肉注射,每日1 次,逐渐减量,并根据抗-HBs 滴度调整HBIG 剂量和频率。肝移植术后抗-HBs 滴度的谷值水平为:1 周内升至 1 000 U/L,3 个月内不低于500 U/L,3 ~6 个月不低于200 U/L,6 个月以上不低于100 U/L。术后随 访密切监测HBsAg、HBV DNA 及抗-HBs 滴度,若 抗-HBs 滴度突然降低或难以维持常预示HBV 再感 染,目前,已有报道表明术后采用高耐药基因屏障的单药预防肝移植术后乙肝复发取得满意的效果[24]。
肾移植等其他器官移植术后HBV 感染的预防需根据患者HBV 血清学情况制定。如果患者既往无HBV 感染的血清学证据,且未接种疫苗,术前应接种HBV 疫苗;已接种过疫苗者应定期监测抗-HBs 滴度。若肾移植受者HBsAg 或HBV DNA阳性,在决定肾移植后应立即开始服用高耐药基因屏障NAs 药物(ETV 或TDF),提倡在移植前进行肝活检,并在组织学正常后行移植手术。
4.4 器官移植术后HBV再感染或新发感染的治疗:抗HBV 治疗的目的是最大限度地长期抑制HBV 复制,减轻肝细胞炎性坏死和肝纤维化,延缓和减少肝衰竭、肝硬化、肝癌以及其他并发症的发生,从而改善生活质量和延长生存时间[6]。
对于诊断明确的肝移植术后HBV 再感染或新发感染,首先常规予以护肝及营养支持等治疗。除HBV 再感染导致的暴发型肝炎考虑再次肝移植外,多数患者可停用HBIG,并选用高耐药基因屏障NAs 药物继续治疗,如ETV 或TDF 等。肝移植受者HBV 再感染或新发感染的抗HBV 治疗需持续终生,尚无停药指征。
肾移植等其他器官移植术后HBV 再感染的治疗与肝移植类似。当肾移植等其他器官移植术后发现HBV DNA 阳性时,多采用NAs 进行抗病毒治疗,直至HBV DNA 转阴。如合并肝功能异常还需进一步行护肝等对症治疗。同时,应密切监测HBV 耐药基因突变,一旦发现耐药需及时调整用药。
执笔作者:李钢(中国人民解放军总医院第八医学中心);药晨(中国人民解放军总医院第八医学中心)主审专家:石炳毅(中国人民解放军总医院第八医学中心);孙丽莹(首都医科大学附属北京友谊医院)审稿专家:敖建华(中国人民解放军总医院第一医学中心);蔡明(中国人民解放军总医院第八医学中心);陈刚(华中科技大学附属同济医院); 陈 正(广州医科大学附属第二医院);陈静瑜 (无锡市人民医院);陈忠华(华中科技大学附属同济医院);丰贵文(郑州大学第一附属医院);付绍杰(南方医科大学南方医院);傅耀文(吉林大学第一医院);宫念樵(华中科技大学附属同济医院);郭 晖(华中科技大学附属同济医院);黄洁(中国医学科学院阜外医院);黄赤兵(陆军军医大学新桥医院);霍枫(中国人民解放军南部战区总医院);鞠卫强(中山大学附属第一医院);巨春蓉(广州医科大学附属第一医院);李钢(中国人民解放军总医院第八医学中心);李宁(山西省第二人民医院);李新长(江西省人民医院);林涛(四川大学华西医院);刘龙(中国人民解放军北部战区总医院);马麟麟(首都医科大学附属北京友谊医院);门同义(山东大学附属千佛山医院);明长生 (华中科技大学附属同济医院);彭龙开(中南大学湘雅二医院);齐海智(中南大学湘雅二医院);曲青山(郑州人民医院);石炳毅(中国人民解放军总医院第八医学中心);眭维国(中国人民解放军联勤保障部队第九二四医院);孙丽莹(首都医科大学附属北京友谊医院);孙启全(中山大学附属第三医院);孙煦勇(中国人民解放军联勤保障部队第九二三医院);田普训(西安交通大学第一附属医院);王钢(吉林大学第一医院);王莉(四川大学华西医院);王毅(南华大学附属第二医院);王洪伟(山东大学第二医院);王彦峰(武汉大学中南医院);王长希(中山大学附属第一医院); 吴建永(浙江大学医学院附属第一医院);武小桐 (山西省第二人民医院);薛武军(西安交通大学第一附属医院);张伟杰(华中科技大学附属同济医院); 药晨(中国人民解放军总医院第八医学中心); 张小东(首都医科大学附属北京朝阳医院);赵明(南方医科大学珠江医院);郑瑾(西安交通大学第一附属医院);周江桥(武汉大学人民医院)。

