直接抗病毒药物在肾移植丙型肝炎病毒患者中的应用
冯成,杨洪吉,,3,侯一夫,冉清,狄文佳,钟山,王筱啸(.西南医科大学临床医学院,四川 泸州 646000;.电子科技大学附属医院,四川省人民医院器官移植中心,四川 成都 6007;3.四川省医学科学院,四川省人民医院临床免疫转化医学四川省重点实验室,四川 成都 673)
目前全球约有2 亿人感染丙型肝炎病毒 (hepatitis C virus,HCV),我国约有1 000 万人[1],并且这个数量还在持续增长。在直接抗病毒药物(direct antiviral drugs,DAAs)时代之前,改善全球肾脏病预后组织推荐在肾移植前治疗HCV[2],但是由于既往干扰素的使用常伴随较低的有效性、较差的耐受以及较高的排斥反应,因此较少在肾移植术后人群中使用[3]。随着DAAs 在终末期肾病(end-stage renal disease,ESRD)患者中的疗效证明,HCV 在这类人群中的管理治疗在过去10 年中发生了巨大变化,目前指南推荐采用泛基因型DAAs 方案治疗所有HCV RNA 阳性患者,但是对于是否适用于HCV 感染供肾有待进一步研究[4]。既往我国丙肝患者购买抗病毒药物十分不便,但是近年来随着我国DAAs 的上市,HCV 管理在我国可能会快速发展,因此本文通过回顾性分析本中心肾移植术后丙肝患者接受DAAs 治疗的过程,对其安全性及有效性进行评估,同时对接受HCV 感染供肾的安全性进行报道。
1 资料与方法
1.1 一般资料:2010—2017 年期间,四川省人民医院器官移植中心共收治12 例ESRD 患者, 其中9 例HCV 感染,1 例接受HCV IgG(+)供肾,2 例接受6 a 型HCV 感染供肾,所有术前均告知手术相关风险及并发症,签署相关同意书。患者的纳入标准:① 按照2015 年颁布的《丙型肝炎防治指南(2015 更新版)》[5]中的标准来判定HCV 感染:HCV RNA 为阳性;② 术前诊断明确,且于本中心行中国公民逝世后器官捐献肾移植手术;③ 肾移植术后估计肾小球滤过率(estimate glomerular filtration rate,eGFR)>30 ml/(min·1.73 m2);④ 无口服DAAs 禁忌证;⑤ 随访数据完整等。
纳入研究观察的12 例患者中,男性9 例、 女性3 例,中位年龄为46(24 ~52)岁,所有患者均为首次肾移植,肾移植术后约2 ~50 个月(中位时间为33 个月)口服药物,治疗前病毒载量为4.74×105~3.20×107U/ml(正常结果为< 15 U/ml),免疫抑制剂方案为环孢素(cyclosporin,CsA)+吗替麦考酚酯(mycophenolate mofetil,MMF)+ 强的松(prednisone,Pred)三联(7 例),他克莫司(tacrolimus,Tac)+ MMF+ Pred 三联(5 例)。
所有患者自行购得DAAs,在抗病毒治疗前均告知相关风险并签署知情同意书。5 例患者为单口服索非布韦(sofosbuvir,SOF)400 mg/d,4 例为复合制剂SOF 400 mg/d +韦帕他韦(velpatasive,VEL)100 mg/d,2 例为SOF 400 mg/d +利巴韦林(ribavirin,RIB)1 000 mg/d,1 例为SOF 400 mg/d +雷迪帕韦(ledipavir,LED)90 mg/d,所有患者疗程均为12 周。具体基本情况见表1。
1.2 随访及观察指标:所有的患者在治疗期间,每周复查 1 次血常规、肾功能、肝功能、抗排斥反应药物的血药谷浓度,每4 周复查血清HCV RNA定量,接受HCV 感染及HCV IgG(+)供肾患者每4 周复查一次HCV IgG。治疗有效性观察指标为血清HCV RNA 定量水平,以血清丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶 (aspartate aminotransferase,AST)、血清肌酐(serum creatinine,Scr)及排斥药物谷浓度的水平作为安全性指标。记录如感染、头痛、胃肠道反应等不良反应的发生情况。
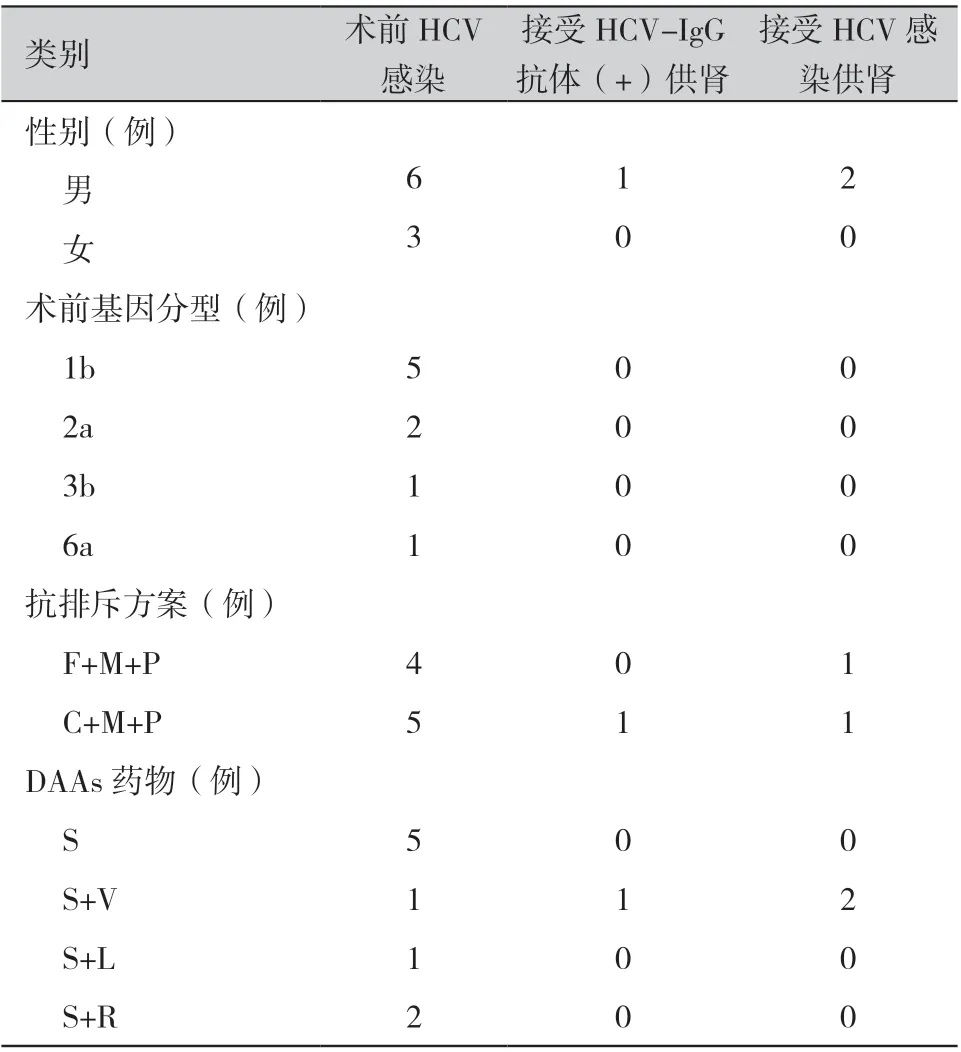
接受HCV 感染供肾性别(例) 男612 女300术前基因分型(例) 1b500 2a200 3b100 6a100抗排斥方案(例) F+M+P401 C+M+P511 DAAs 药物(例) S500 S+V112 S+L100 S+R200类别 术前HCV感染接受HCV-IgG抗体(+)供肾
1.3 伦理学:本研究符合医学伦理学标准,得到医 院伦理委员会审批〔伦审(研)2019 年第310 号〕。
1.4 统计学分析:采用SPSS 22.0 软件进行统计分析。正态分布的计量资料以均数±标准差(±s)表示,非正态分布的计量资料以四分位数表示,治疗前后差异的比较采用自身配对Wilcoxon 秩和检验。以P < 0.05 为差异有统计学意义。
2 结 果
2.1 治疗过程及效果:所有患者均完成12 周的口服DAAs 疗程,HCV 感染的终末期肾病肾移植患者接受DAAs 治疗后其中8 例获得快速病毒学应答(sustained virological response,SVR),1 例获得完全早期病毒学应答;对于接受HCV IgG(+)供肾患者,术后规律复查未出现HCV RNA 及HCV IgG阳性;2 例接受HCV RNA 阳性供肾术后口服DAAs药物术后随访期间均未出现HCV RNA 阳性,术后 第4 周出现HCV IgG 阳性,具体随访数据见表2。 所有患者继续随访至24 周,均获得持续SVR。
2.2 治疗期间对移植肾功能、肝功能及药物浓度的影响:9 例HCV 患者、1 例接受HCV IgG 抗体 (+)供肾及2 例接受HCV 感染供肾患者的术后治疗 12 周后ALT 和AST 较治疗前有所下降,差异有统计学意义(z =-1.96,P =0.045;z =-2.74, P =0.006);SCr 与治疗前相比无明显变化,差异无统计学意义(z =-0.118,P =0.906),见图1。
对药物浓度的研究中,除了接受IgG 阳性供肾及HCV 感染供肾的2 例患者术后早期开始使用DAAs 药物,抗排斥反应药物浓度尚不稳定,未予以纳入统计外,其余患者口服药物期间药物浓度未见明显变化。术后早期复查观察到接受HCV 感染肾脏的患者术后转氨酶及胆红素较术前未见明显变化。
2.3 治疗期间的不良反应:在随访观察期间有1 例(8.3%)患者出现头晕,在排除其他因素引起后对症处理后好转,1 例(8.3%)患者治疗期间出现肺部感染,移植肾功能受损,在抗感染治疗好转后移植肾功能恢复到之前水平,未影响DAAs 使用。
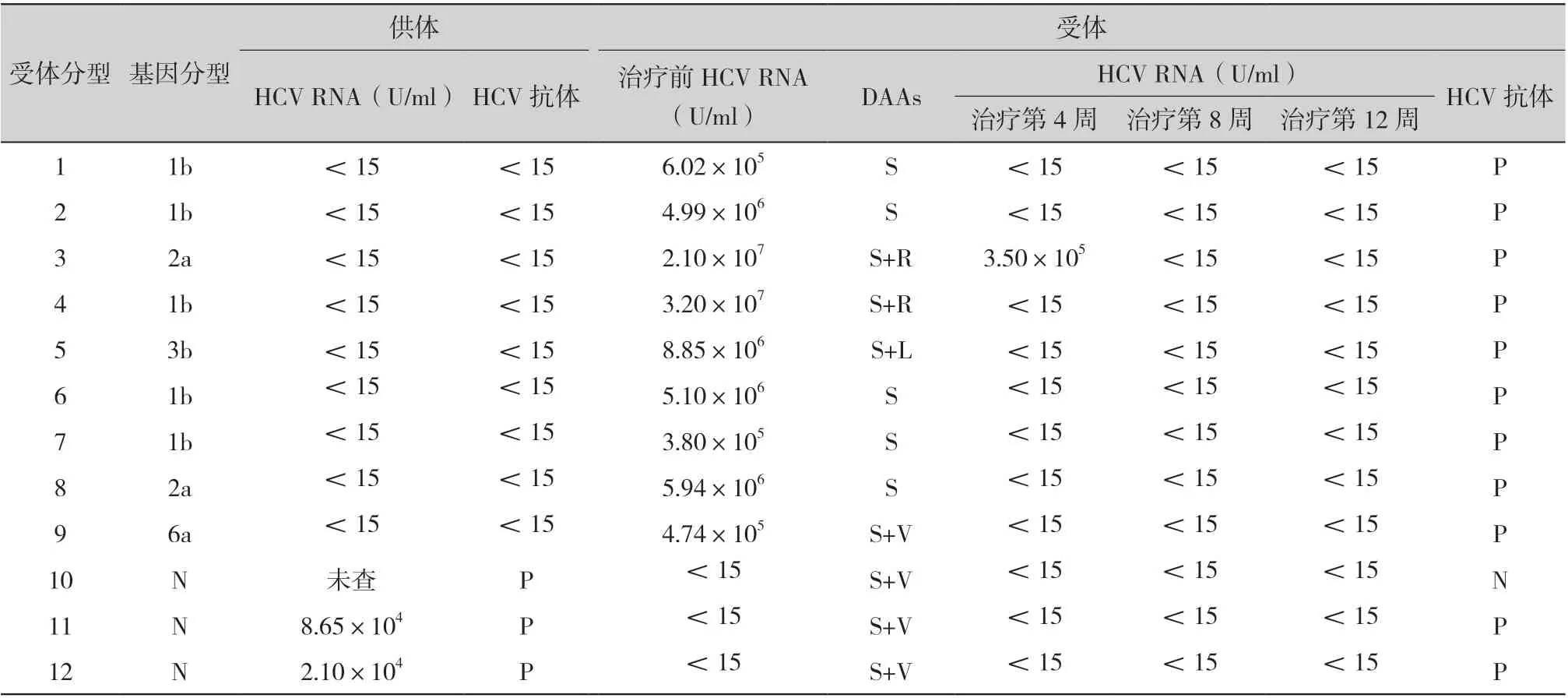
供体 受体HCV RNA(U/ml) HCV 抗体 治疗前HCV RNA 受体分型 基因分型(U/ml)DAAsHCV RNA(U/ml)HCV 抗体治疗第4 周 治疗第8 周 治疗第12 周11b<15<156.02×105S<15<15<15P 21b<15<154.99×106S<15<15<15P 32a<15<152.10×107S+R3.50×105<15<15P 41b<15<153.20×107S+R<15<15<15P 53b<15<158.85×106S+L<15<15<15P 61b<15<155.10×106S<15<15<15P 71b<15<153.80×105S<15<15<15P 82a<15<155.94×106S<15<15<15P 96a<15<154.74×105S+V<15<15<15P 10N未查P<15S+V<15<15<15N 11N8.65×104P<15S+V<15<15<15P 12N2.10×104P<15S+V<15<15<15P

3 讨 论
由于终末期肾脏病患者频繁血液透析,故其暴露于HCV 感染的风险较正常人更大,即使随着透析过程控制感染的方法改进和血液制品的常规检查使得透析室HCV 感染的患病率和发病率下降,但是仍然高于一般人群[6]。HCV 感染的ESRD 患者行肾移植术后处于免疫抑制状态,部分人群易发展为肝硬化甚至肝癌[3],对患者的健康及生命威胁极大。并且HCV 是影响肾移植术后人、肾存活率的独立危险因素[7],所以对于肾移植术后丙肝的治疗一直是全世界面对的难题。在泛基因型抗病毒药物出现之前,HCV 感染的基因分型对 DAAs 的选择至关重要,不同的抗病毒药物对应不同的基因[8]。虽然我国以1 b 及2 a 为主要基因型,但是目前指南推荐采用泛基因行DAAs 方案治疗所有HCV RNA 阳性患者。在本研究中所有的基因型均可通过使用含SOF 的抗病毒药物治愈, 且所有患者的均获得持续SVR。
目前对于DAAs 药物的具体选择目前尚无统一标准,国内外上市的新型抗病毒药物大多为含有索非布韦的复合制剂。但是需要注意索非布韦主要由肾脏排出,所以并不推荐用于包括eGFR < 30 ml/(min·1.73m2)或接受血液透析的慢性肾脏病患者[9],并且既往研究显示在单用SOF 方案治疗的HCV 患者中有1%~15%会发生急性肾损伤 (acute kidney injury,AKI)[10]。在本文的研究中,所有方案均包含SOF,除了1 例患者服药期间出现了肺部感染导致血肌酐升高外,其余患者移植肾功能没有明显改变,这个结果与大多数部分中心的随访结果一致。但是也有中心报道在使用SOF 联合LED抗病毒治疗1年后随访出现eGFR显著下降[11],所以建议DAAs 在临床的使用过程中需严格监测移植肾功能。随着临床上对不同DAAs 的使用,不良事件如恶心、头晕、贫血、链球菌菌血症和肺炎等逐渐被报道出来[12],本研究中,其中1 例患者在口服DAAs 后约2 周出现头晕,在排除血压升高及抗排斥反应药物不良反应后,给予对症治疗后症状有所好转。但是Bodro 等[13]的研究显示,HCV 是肾移植受者机会性感染的危险因素,并且认为移植后细菌感染是HCV 受者死亡的主要原因之一,所以对于如肺部感染等感染事件的发生是否与DAAs相关目前仍然需要进一步研究。因此我们建议对接受DAAs 治疗的肾移植患者需要定期进行如机会感染等不良反应的监测,且当出现移植肾功能障碍时需明确是否为DAAs 导致,必要时更换抗病毒方案。
目前对于DAAs 是否会影响抗排斥反应药物浓度尚不明确,基础研究显示Tac 和CsA 都是肝细胞色素P450(cytochrome P450,CYP450)亚型3a4 的底物,且索非布韦对CYP450 酶系统的参与及转运体蛋白没有明确的抑制作用,所以与其他DAAs 相比SOF 具有最低的药物相互作用潜力[12]。但是在临床使用过程中部分中心报道对于含有SOF的新型DAAs 药物在肝移植及肾移植治疗过程中,尤其是在第1 个月,Tac 水平显著下降[14-15]。在本中心长期门诊随访过程中,排除了移植术后早期药物浓度不稳定的3 个病例,其余9 例在DAAs 治疗4 周前后Tac 和CsA 谷浓度水平没有任何剂量调整。出现的这个差异是否与人群种类差异或不同人对抗排斥反应药物代谢速率不同等原因有待进一步分析,在临床中推荐在DAAs 治疗期间仍建议频繁监测Tac 和CsA 谷浓度,防治移植术后因排斥药物剂量不足而发生排斥反应。
既往HCV 感染肾脏是不能作为供肾使用的,并且对于HCV 感染患者是否行肾移植手术目前尚存在争议,虽然部分移植中心的随访显示HCV 感染的慢性肾脏疾病患者行肾移植手术后存活时间高于继续血液透析或腹膜透析患者[16]。但是考虑到这类患者行肾移植手术后移植物丢失、移植后并发症甚至死亡风险的增加,部分移植临床医生建议这类患者在移植前对HCV 治疗[17]。随着DAAs 的出现以及在临床上的使用,在移植术后长期随访中,术后抗病毒治疗效果良好,受试者治疗结束后 12 周SVR 从91.3%到100%不等[18],这些结果削弱了移植前治疗的必要性和优越性,甚至在供体短缺的地方,部分中心认为抗病毒治疗应该推迟,可以选择接受HCV 感染的供体,减少等候时间[19-20]。 在使用HCV 感染肾脏的探索中,国外的一项临床试验中将HCV 感染供肾移植到未感染受体后,所 有 的 患 者 经 过DAAs 治 疗 后 均 获 得SVR[21]。 基于国外中心经验,本中心完成了接受6 a 型HCV感染供肾的2 例患者,术后随访至12 周HCV RNA均未阳性,仅在术后第4 周检查发现HCV IgG 抗体阳性表达,长期随访中移植肾及肝功能稳定。随着各个移植中心的报道,以后有可能不再拒绝HCV 感染肾移植给未感染受者,增加供体库。
本文研究仍然有局限性,这是一个小样本的回顾性研究,所有患者DAAs 方案仅限于SOF 及包含SOF 的药物,其结果不具有普遍性。此外,由于基因型也较局限,所以这个结果是否适用于其他基因型患者,仍然需要通过更大规模的前瞻性研究来确定。

