模型认知在原电池复习中的实践应用
张泉

【摘 要】模型认知是化学学科核心素养的一个重要方面,教师在引导学生复习电化学时,可以采用模型思想,对原电池和电解池进行解析,总结出一般模型,应用于各种复杂的化学电源和新型的电解设备的解题教学中。
【关键词】模型认知;电化学;氧化还原反应
【中图分类号】G633.8 【文献标识码】A 【文章编号】1671-8437(2020)34-0089-02
“模型认知”是教育部颁布的《普通高中化学课程标准(2017年版)》中提出的化学学科核心素养的一个方面,在高三化学复习方面具有指导性意义。电化学考题中的对象往往形式多变,这会给学生的解题增加难度,原因在于教材中呈现的电化学装置过于基础,对理解工作原理有帮助,但直接应用于解决包含各种复杂电化学装置的题型又有一定的局限性。因此,教师在引导学生复习这部分内容时,可以采用模型思想,对装置进行剖析,总结出一般规律,应用于各种复杂的化学电源和新型的电解设备的解题教学中。
1 “模型认知”的概念
模型既是对原型的抽象化,也是对理论的具体化,是将复杂的研究对象和抽象的科学理论联系在一起的纽带。通过将对象模型化,总结出一般规律,能达到突破难点的目的。模型认知是指利用模型认识事物,通过构建模型促进问题解决的能力。在高中化学教学中,利用模型认知的例子随处可见。除了物质模型,人们也常用思维模型认知很多微观且晦涩难懂的内容,如用元素符号、结构式、电子式、热化学方程式表征物质及其变化的规律。模型认知作为高中化学学科核心素养的重要组成部分,对于解决化学学习中的难点有着不可替代的作用。
2 模型在原电池复习中的建立与应用
2.1 模型的建立
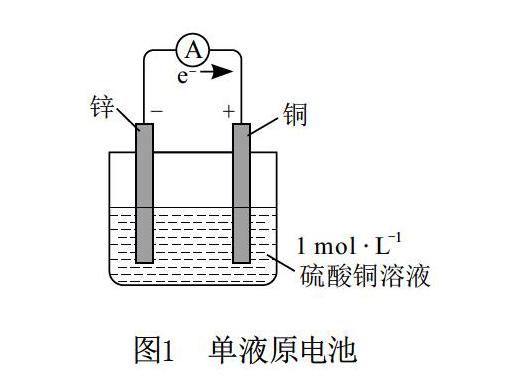
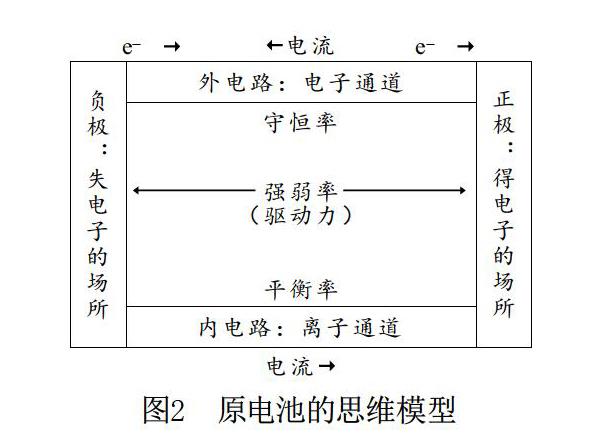
复习原电池要把握好本质,构建正确的模型。苏教版《化学 必修2》(2014年第5版)和《化学反应原理》(2014年第5版)分别采用了图1和图2(已简化)两种模型。
图1中,该模型简洁直观,适用于一些简单金属电极单液原电池。该模型的缺点:表述还不够清晰,易使学生产生诸多误解。如对电流方向和特点(既可通过导线又可通过溶液)、电子流动方向和特点(只可通过导线不可通过溶液)、离子迁移方向和特点(只可通过溶液不可通过导线)、电极与电极上的反应无法合理区别。产生这些问题的最根本原因在于学生并不能根据原模型真正理解原电池的本质内涵。
虽然后续版本的教材在图1模型的基础上加设了盐桥,但学生对于原电池的认知大体相同。笔者认为原电池的复习中可以将自发的氧化还原反应具体化为还原性最强的微粒和氧化性最强的微粒之间的反应,从而为学生铺设一条寻找反应对象的道路,且与氧化还原反应的规律结合得更加密切。如图2的思维模型所示,电极是电子交换场所,突破不同电极材料的原电池;外电路是电子通道,突破外电路材料的变化不影响原电池的氧化还原本质;内电路是离子通道,突破不同电解质组合或混合的本质;强弱律突破自发的氧化还原反应和多装置组合的判断;守恒律突破计算;平衡律突破电解质离子移动的本质,解决各类盐桥或膜型原电池。
2.2 模型在有关原电池解题中的应用
例1(2018年浙江4月选考,17):锂(Li)—空气电池的工作原理如图3所示。下列说法不正确的是( )。
A.金属锂作负极,发生氧化反应
B.Li+通过有机电解质向水溶液处移动
C.正极的电极反应:O2+4e-=2O2-
D.电池总反应:4Li+O2+2H2O=4LiOH
[分析]将这个锂—空气电池与总结的模型结合起来,该自发的氧化还原反应是4Li+O2+2H2O=4LiOH。金属锂作负极,通氧气的一极是正极,外电路电子由负极到正极,形成电流,内电路Li+由负极到正极,也就是通过有机电解质向水溶液处移动。电子和离子的定向移动,使两极的电荷保持平衡。
例2(2018年浙江11月选考,17):最近,科学家研发了“全氢电池”,其工作原理如图4所示。下列说法不正确的是( )。
A.右边吸附层中发生了还原反应
B.负极的电极反应式是H2-2e-+2OH-=2H2O
C.电池的总反应是2H2+O2=2H2O
D.电解质溶液中Na+向右移动,ClO4-向左移动
[分析]全氢电池不同于常见电池,其本质是电池中两极存在的电势差促使两极得失电子。本例题若套用上述研究模式可以轻松解决。根据电子移动方向判断正负极和离子移动方向,电极反应式书写的部分,按照列物质、标得失、选离子和水配电荷守恒和原子守恒这几步来解决。
例3:某原电池装置如图5所示,电池总反应为2Ag
+Cl2=2AgCl。下列说法正确的是( )。
A.正极反应AgCl+e-=Ag+Cl-
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用NaCl溶液代替盐酸,则电池总反应随之改变
D.当电路中转移0.01??mole-时,交换膜左侧溶液中约减少0.02??mol离子
[分析]该题中,根据总反应式和两极电极材料,可判断AgCl/Ag为负极,Ag-e-+Cl-=AgCl;Pt为正极,Cl2+2e-=2Cl-。阳离子通过交换膜H+使两极室保持电中性,当电路中转移0.01??mole-时,负极室减少了0.02??mol负电荷(失去了0.01??mole-和0.01??molCl-)。为了保持电中性,需要减少0.02??mol正电荷,因此就有0.02??molH+转移到正极室。再看正极室,生成了0.02??molCl-,即增加了0.02??mol负电荷,加上从负极迁移来的0.02??molH+,也就使正极保持了电中性。
3 教学启示与反思
对原电池和电解池进行解析,总结出一般模型,能使学生以后遇到原电池问题时,积极利用模型,分解与概括复杂的问题,并在知识建构与模型认知中培养化学核心素养。这样,学生在解决化学问题中形成的建模能力是建立在正确表征化学问题的基础上的,有助于他们运用数理方法或逻辑方法将化学实际问题抽象成用化学语言表述的模型,并将之運用于对模型进行检验,提升解决相关化学实际问题的能力[1]。
【参考文献】
[1]袁野.什么是高中生化学问题解决中的建模能力[J].化学教与学,2010(3).

