代谢组学方法研究橙黄决明素对高脂血症大鼠血浆游离脂肪酸的影响
伍洋科, 李 莎, 蒋菲娅, 颜 笑, 刘 文*
(1.湖南师范大学医学院药学系,湖南长沙 410013;2.湖南师范大学第一附属医院(湖南省人民医院),湖南长沙 410005)
高脂血症(Hyperlipidemia)是指血浆中的脂蛋白谱异常,一般特指总胆固醇(TC)、甘油三酯(TG)升高,或高密度脂蛋白(HDL-C)降低和低密度脂蛋白(LDL-C)升高[1,2]。目前高脂血症患病率逐年上升,患者粥样硬化性心脑血管疾病的患病风险也增大,但其发病机制并不完全清楚,因此,实现高脂血症早发现、早诊断并有效治疗是现阶段研究的重点[3,4]。脂肪酸是人体内重要的生物活性物质,它参与多种生理功能,代谢活性高且易受脂肪代谢影响。血浆中脂肪酸组成能反映某些疾病特点,饱和脂肪酸能够促进血小板聚集,诱发冠状动脉急性阻塞最后导致心肌梗塞[5]。
决明子是一种常见的中药材,已被证实具有较好的降血脂、抗动脉粥样硬化作用;而橙黄决明素是从决明子抗血脂有效部位中分离得到的蒽醌类单体化合物[6]。在此基础上测定橙黄决明素对高脂血症大鼠血浆脂肪酸含量的影响,对了解疾病、预防疾病、治疗疾病有重大意义。本研究旨在运用气相色谱-质谱(GC-MS)联用技术测定四组大鼠血浆脂肪酸的差异,探讨橙黄决明素对高脂血症大鼠血浆脂肪酸的调控机制,为其进一步深入研究提供参考。
1 实验部分
1.1 仪器与试剂
Beckman AU2700全自动生化分析仪(美国,贝克曼公司);安捷伦7890气-质联用仪(安捷伦公司);安捷伦DB-23熔融石英毛细管柱(30 m×0.25 mm×0.25 μm);TDZ4A-WS台式低速离心机(长沙湘仪离心机仪器有限公司);MX-F漩涡混合器(美国,SCILOGEX公司);CP225D电子天平(德国,Sartorius公司);KL512J型氮吹仪(北京康体科技有限责任公司);微量移液枪(德国,Eppendorf公司);-80 ℃超低温冰箱(海尔集团);真空干燥箱(上海一恒科学仪器有限公司)。
37种脂肪酸甲酯混合标准品(上海安普实验科技股份有限公司);十七烷酸标准品(上海安普实验科技股份有限公司);5%H2SO4-甲醇溶液用甲醇稀释浓H2SO4临用新制:甲醇、正己烷(色谱纯,美国Tedia公司);总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白-胆固醇(LDL-c)、高密度脂蛋白-胆固醇(HDL-c)测定试剂盒,均由上海科华生物工程股份有限公司提供。水为超纯水(湖南省人民医院制剂室自制)。
1.2 实验动物
SD雄性大鼠41只,体重200~250 g,购于湖南省斯莱克实验动物有限公司(许可证号:SCXK(湘)2016-0002),饲养于湖南省人民医院实验动物中心动物实验室。
1.3 溶液配制
内标溶液:取十七烷酸标准品约10.0 mg,精密称定,置于10 mL容量瓶中,加甲醇溶解并稀释至刻度,作为内标溶液,置4 ℃冰箱冷藏备用。对照品溶液:取37种脂肪酸甲酯混合标准品约25.0 mg,精密称定,置于25 mL容量瓶中,加甲醇液溶解并稀释至刻度,作为对照品溶液,置4 ℃冰箱冷藏备用。质控溶液:在40个样品中每个取100 μL血浆样本,涡旋30 s,充分混匀后,分装成20个每个有200 μL血浆的样本,作为质控溶液,置-80 ℃冰箱冷藏备用。
1.4 高血脂症大鼠造模及取样
采用湖南省实验动物中心提供的高脂饲料造模方式,将大鼠随机分成2组,正常对照组(10只):普通饲料喂养;高脂血症模型组(31只):高脂饲料(酪蛋白3.5%、猪油5%、胆固醇1.2%、胆酸钠0.2%、磷酸氢钙0.6%、基础饲料89.5%)喂养。两组均于10 d后尾静脉取血检测其生化指标,确认造模效果。之后将31只高脂血症模型大鼠随机分成3组,分别为模型组(10只)、橙黄决明素组(11只)和阿托伐他汀组(10只)。橙黄决明素组灌胃橙黄决明素3.6 mg/(kg·d),阿托伐他汀组灌胃阿托伐他汀10 mg/(kg·d),正常对照组和模型组灌胃等量的水[7]。饲养过程中模型组死亡1只,连续治疗30 d后腹主动脉取血,3 500 r/min离心6 min,取血浆于-80 ℃下保存,用于GC-MS检测。
1.5 生化指标检测
取100 μL血浆样本,利用Beckman AU2700全自动生化分析仪,分别逐次测出每个样本的LDL-c、TG、TC、HDL-C值等参数,并获取进行自动分析后的数据值。
1.6 样品预处理与GC-MS分析
准确移取200 μL血浆样本,置于1.5 mL离心管中,加入25 μL十七烷酸内标(1.01 mg/mL),加入少量无水Na2SO4,涡旋10 s,除去血浆中的水分,再加入2 mL 5%H2SO4-甲醇,涡旋30 s,在70 ℃水浴中反应30 min。然后用2 mL正己烷分别萃取两次,合并正己烷相,得到游离脂肪酸甲酯。样本放在真空干燥箱中挥干。分析时,用正己烷稀释到100 μL后进样。
GC-MS分析条件:进样口温度270 ℃,初始柱温60 ℃,保持2 min,以10 ℃/min速度升温至70 ℃,保持2 min;以20 ℃/min速度升温至150 ℃,保持5 min;以4 ℃/min速度升温至180 ℃,保持3 min;以5 ℃/min速度升温至220 ℃,保持5 min;以5 ℃/min速度升温至270 ℃,保持0 min。电离方式:标准EI源;电子能量:70 eV;离子源温度200 ℃;接口温度270 ℃;氦气作为载气,进样量1 μL,流速1 mL/min,分流比10∶1,全扫描m/z35~850;溶剂切除时间1.8 min。
1.7 数据处理
2 结果与讨论
2.1 造模效果
2.1.1 体重变化情况饲养期间,高脂饮食大鼠出现腹泻厌食的情况,各组大鼠体重也发生一定变化。正常对照组大鼠体重随时间呈缓慢上升的趋势,模型组大鼠体重10 d内增长快,随着高脂血症程度加深,体重缓慢下降。橙黄决明素组和阿托伐他汀组大鼠体重10 d内增长快,之后体重缓慢增长。发生此变化可能跟饲料成分有关,高脂饲料更易产生饱腹感,延缓胃排空,从而影响大鼠的高脂摄食量,出现体重下降的趋势[8]。模型组大鼠在饲养的最后一周内,死亡一只,可能的原因是高脂饮食导致大鼠体内肠道菌群结构发生改变,出现腹泻厌食的情况,加上大鼠有脂肪肝的倾向,导致大鼠出现猝死的现象[9,10]。
2.1.2 生化指标结果表1列出了对照组和模型组的生化指标值。模型组的总胆固醇(TC)、低密度脂蛋白(LDL-C)值相比较于对照组显著升高(P<0.01),表明造模成功。

表1 大鼠血脂指标
*P<0.01 compared with the control group.
2.2 GC-MS数据分析
2.2.1 GC-MS分析条件取37种脂肪酸混标对照品溶液1 μL,调整仪器参数,然后进样分析,最终确定GC-MS参数,共检测到34种脂肪酸对照物质。如图1所示。

图1 34种脂肪酸甲酯混合标准品的总离子流(TIC)色谱图Fig.1 TIC chromatogram of 34 fatly acid estersC4∶0.Butanoic acid;C6∶0.Hexanoic acid;C8∶0.Octanoic acid;C10∶0.Decanoic acid;C11∶0.Undecanoic acid;C12∶0.Dodecanoic acid;C13∶0.Tridecanoic acid;C14∶1.cis-9-Tetradecanoic acid;C14∶0.Tetradecanoic acid;C15∶0.Pentadecanoic acid;C16∶1.cis-9-Hexadecenoic acid;C16∶0.Hexadecanoic acid;C17∶1.cis-10-Heptadecenoic acid;C17∶0.Heptadecanoic acid;C18∶3.all cis-6,9,12-Octadecadienoic acid;C18∶2.all cis-9,12-Octadecadienoic acid;C18∶1.cis-9-Octadecenoic acid;C18∶1 .T trans-9-Octadecenoic acid;C18∶0.Octadecenoic acid;C20∶4.all cis-5,8,11,14-Eicosatetraenoic acid;C20∶5.all cis-5,8,11,14,17-Eicosapentaenoic acid;C20∶3.all cis-8,11,14-Eicosatrienoic acid;C20∶2.all cis-11,14-Eicosadienoic acid;C20∶1.cis-11-Eicosenoic acid;C20∶3n3.cis-11,14,17-Eicosenoic acid;C20∶0.Eicosanoic acid;C21∶0.Heneicosanoic acid;C22∶6.all cis-4,7,10,13,16,19-Docosahexaenoic acid;C22∶2.cis-13,16-Docasadienoic acid;C22∶1.cis-13-Docosenoic acid;C22∶0.Docosanoic acid;C23∶0.Tricosanoic acid;C24∶1.cis-15-Tetracosenoic acid;C24∶0.Lignoceric acid.
2.2.2 精密度和方法稳定性考察取质控溶液200 μL,连续进样6次。按1.6方法处理后,进样分析,计算仪器精密度,结果见表2。取质控溶液200 μL,平行准备6份,按1.6方法处理后,计算方法稳定性,结果见表2。
2.2.3 GC-MS图谱解析经GC-MS法测定,大鼠血浆脂肪酸的总离子流色谱图,如图2所示。在图2中能找到16种脂肪酸,表明大鼠血浆中有16种脂肪酸(去除内标),结果见表2。
2.3 多元统计分析
2.3.1 模型建立结果分析运用SIMCA-P14.1软件对大鼠模型建立进行多元统计分析,结果如图3所示。从主成分分析(PCA)得分图和OPLS -DA得分图中可以看出,对照组和模型组能达到完全分离,表明两组大鼠之间的脂肪酸存在差异,可以在一定程度上说明高脂血症大鼠会影响体内脂肪酸的代谢。
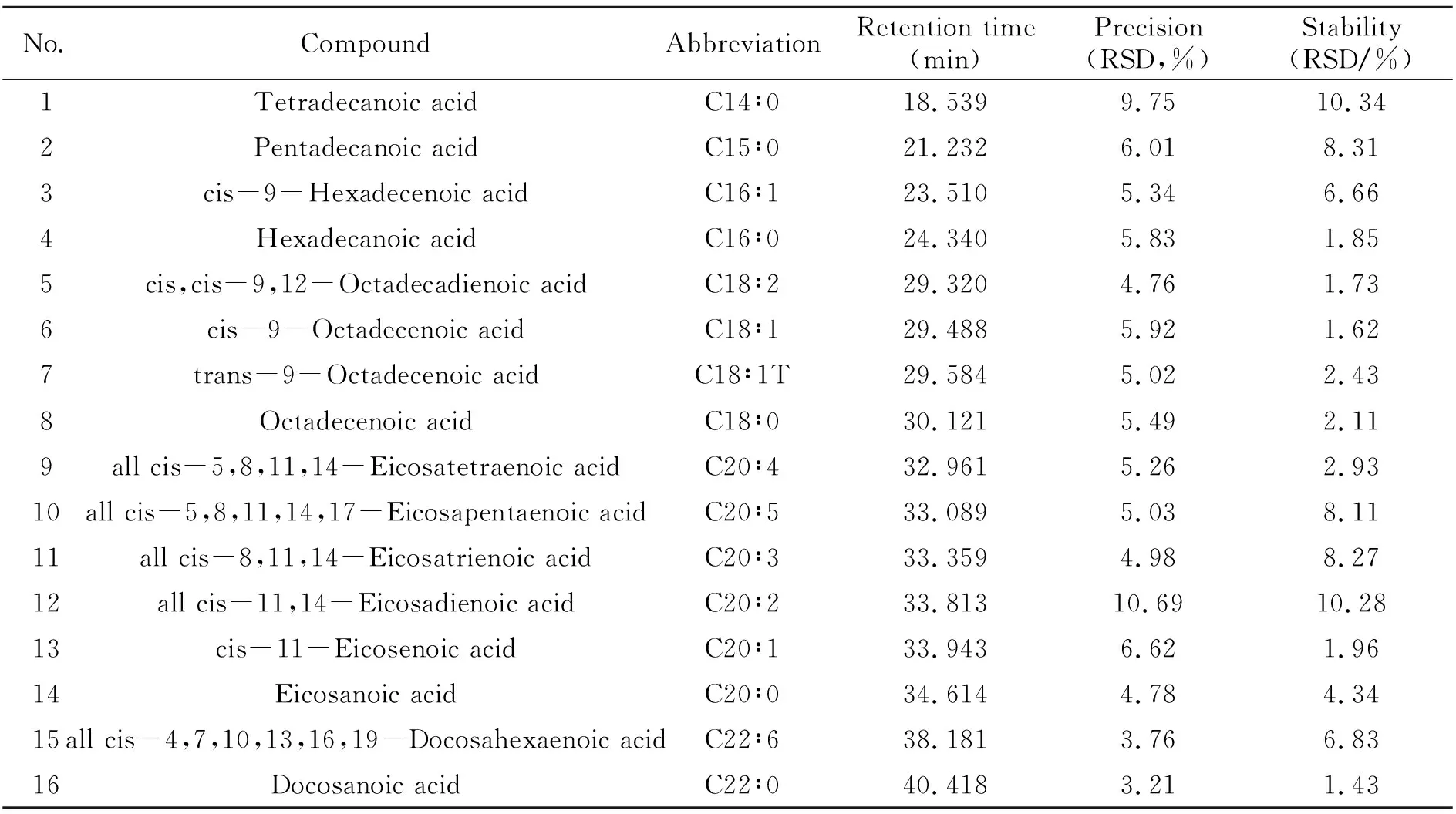
表2 GC-MS精密度和方法稳定性的实验结果
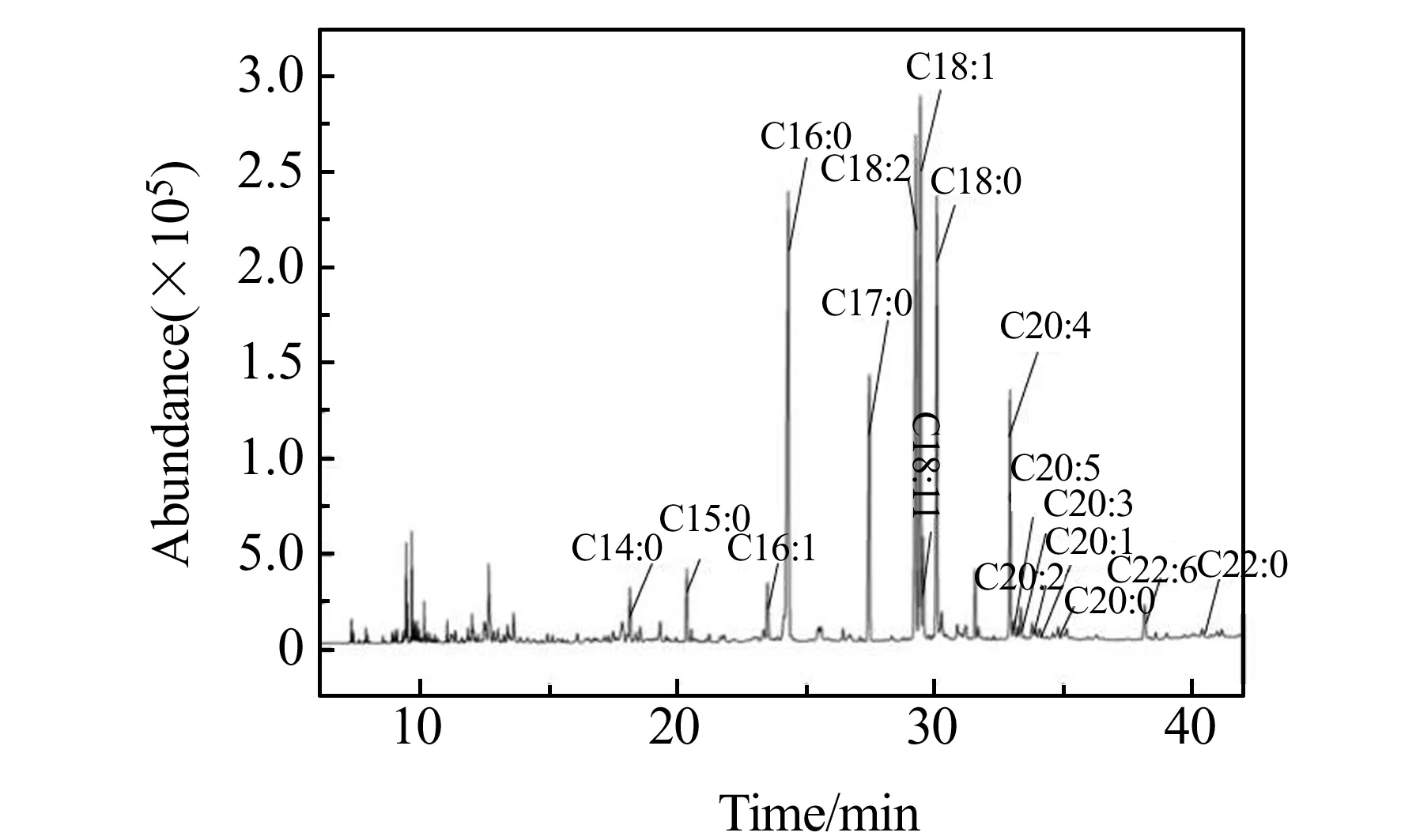
图2 大鼠血浆的总离子流(TIC)色谱图Fig.2 TIC chromatogram of rat plasma
2.3.2 药物干预结果分析为了探讨橙黄决明素对高脂血症大鼠的脂肪酸代谢的影响,我们进一步对三组不同大鼠数据进行多元统计分析,结果如图4所示。从PCA图中可以看出,模型组和橙黄决明素组并未完全分离,因为PCA对离群点较为敏感。为了能得到较为显著的组间差异,我们尝试选用更高要求的化学计量学模式识别方法。正交偏最小二乘判别分析(OPLS -DA)是一种更为强调组间差异的模式识别方法,可以筛选出与反应没有直接关系的变化,使得结果更可靠,更容易理解,判别能力明显优于PCA[11]。根据OPLS -DA图显示,对照组、模型组和橙黄决明素组能完全分离,经过药物干预的橙黄决明素组相比于模型组更接近于对照组,表明橙黄决明素可以部分调节高脂血脂大鼠中的脂肪酸代谢。
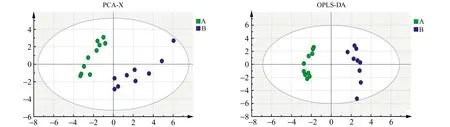
图3 大鼠模型建立的多元统计分析图Fig.3 Multivariate statistical analysis map established in rat model A.Normal control group;B.Model group.
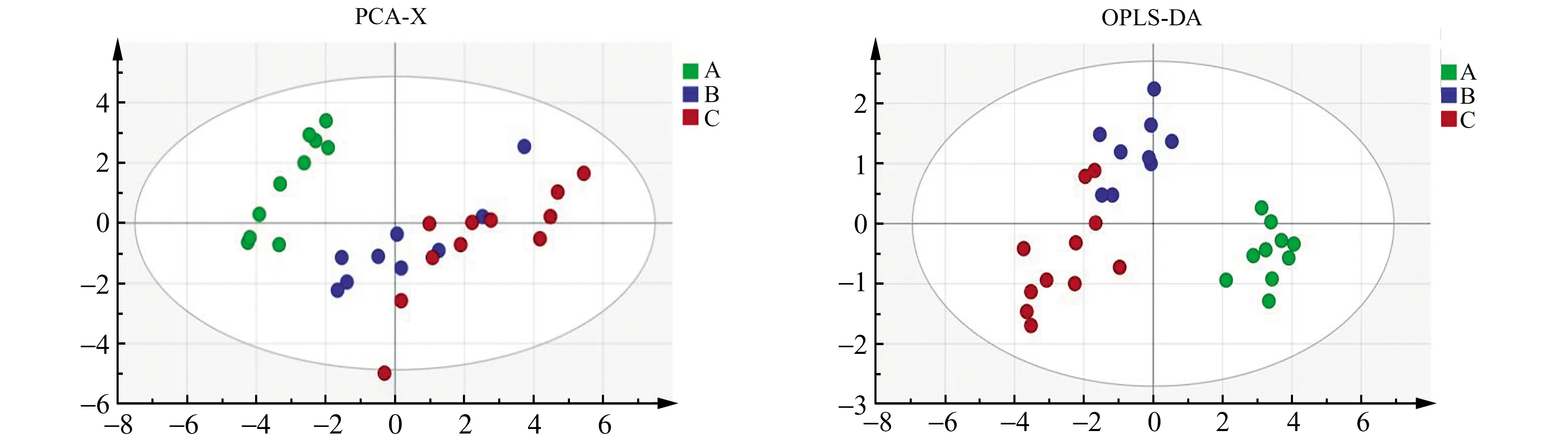
图4 大鼠药物干预的多元统计分析图Fig.4 Multivariate statistical analysis of drug intervention in rats A.Normal control group;B.Model group;C.Aurantio-obtusin group.
2.3.3 阳性药物对比分析此外,为了进一步研究橙黄决明素的治疗效果,我们另外以阿托伐他汀作为阳性对照药物,从而更为直观地比较两种药物对高脂血症大鼠脂肪酸的影响,其结果如图5所示。PCA得分图显示各组分较为分散,聚集不够集中,可能是由于大鼠的自身差异以及实验过程的误差影响。为了突出组间的差异,我们对数据进一步采用OPLS-DA分析,从图中可以看出橙黄决明素组和阿托伐他汀组可以和正常对照组以及模型组分离,表明橙黄决明素和阿托伐他汀对高脂血症大鼠的脂肪酸代谢有一定调节作用,但橙黄决明素对脂肪酸的影响稍弱于阿托伐他汀组。同时随行质量控制(QC)组也与其他各组分开,并聚集在一起,表明在实验过程的误差在可控范围内,实验数据具有可靠性。之后得到VIP值大于1的有C20∶0、C20∶2、C18∶2、C14∶0、C16∶1、C22∶6、C22∶0、C20∶1、C18∶1、C18∶1T共10种脂肪酸。
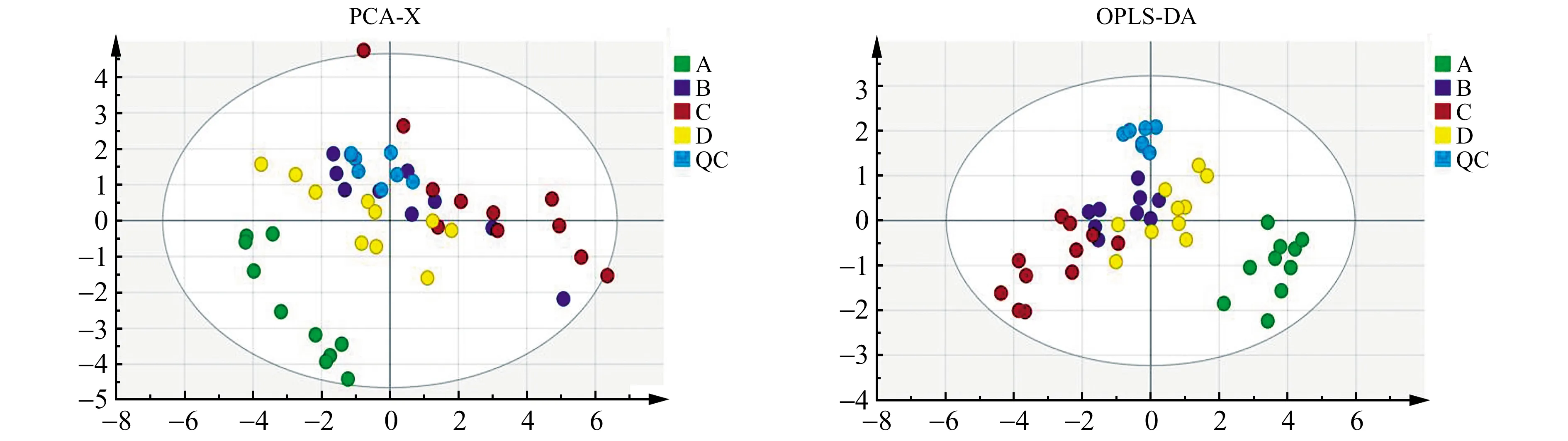
图5 四组大鼠血浆脂肪酸的多元统计分析图Fig.5 Multivariate statistical analysis of plasma fatty acids in four groups of rats A.Normal control group;B.Model group;C.Aurantio-obtusin group;D.Atorvastatin group.
2.4 单因素统计分析
使用内标十七烷酸进行半定量,计算出各组小鼠血浆脂肪酸相对百分含量,见表3。从表3可知,正常对照组大鼠血浆中找到15种脂肪酸,没有发现C20∶0,其他三组都有16种脂肪酸。(1)模型组和正常对照组相比较C16∶1、C18∶1、C20∶0、C22∶0、C22∶6有极显著性差异(P<0.01),C14∶0、C20∶1有显著性差异(P<0.05)。其他脂肪酸都有不同程度差异,但差异不显著(P>0.05)。由此可知模型组相对于正常对照组而言C16∶1、C18∶1、C20∶0、C22∶0、C22∶6、C14∶0、C20∶1 7种脂肪酸变化显著。已有研究表明C14∶0、C16∶1、C18∶1、C22∶6四种脂肪酸在模型组和正常对照组之间变化显著,与高脂血症代谢异常有关,血浆不饱和脂肪酸比例与高脂血症关系密切[12 - 13]。与本文研究得出的结果类似,有一定的参考价值。(2)橙黄决明素组和模型组相比较C14∶0、C18∶2、C20∶2、C20∶1、C22∶0有显著性差异(P<0.05)。由此可知橙黄决明素组相对于模型组而言C14∶0、C18∶2、C20∶2、C20∶1、C22∶0五种脂肪酸变化显著。橙黄决明素组中C14∶0、C20∶4、C20∶5、C20∶0、C22∶6的含量对比阿托伐他汀组和模型组要更接近正常对照组。

表3 大鼠血浆脂肪酸相对含量的变化
(续表3)

CompoundControl groupModel groupAtorvastatin groupAurantio-obtusin groupC16∶10.115±0.0240.304±0.055▲▲0.322±0.0650.196±0.047◆◆C16∶02.586±0.6082.810±0.6883.063±0.7282.479±0.521C18∶22.378±0.4392.742±0.6123.542±0.521◆2.428±0.510C18∶11.284±0.2432.538±0.613▲▲3.114±0.6291.990±0.431C18∶1T0.341±0.0630.429±0.0940.415±0.0870.322±0.054◆C18∶01.496±0.2481.757±0.2981.783±0.4071.507±0.193C20∶41.197±0.2600.981±0.1641.050±0.2031.014±0.156C20∶50.150±0.0180.120±0.0340.144±0.0360.138±0.031C20∶30.103±0.0280.153±0.0300.199±0.0520.154±0.034C20∶20.068±0.0120.076±0.0140.105±0.021◆0.078±0.017C20∶10.031±0.0050.053±0.014▲0.074±0.015◆0.054±0.012C20∶00.318±0.0810.041±0.015▲▲0.144±0.010◆0.036±0.007C22∶60.084±0.0190.202±0.049▲▲0.182±0.0660.251±0.044C22∶000.071±0.015▲▲0.095±0.018◆0.055±0.010
(1)▲▲P<0.01;▲P<0.05 compared with the control group;(2)◆◆P<0.01;◆P<0.05 compared with the model group.
从以上分析中可知,C14∶0、C20∶0、C22∶6 3种脂肪酸含量变化与高脂血症代谢异常有关,且橙黄决明素在一定程度上可以调节高脂血症的脂肪酸代谢。
3 结论
本研究中,模型组C14∶0、C16∶1、C18∶1、C20∶1、C20∶0、C22∶6、C22∶0相对于正常对照组差异显著,橙黄决明素组C14∶0、C18∶2、C20∶2、C20∶1、C22∶0相对于模型组差异显著,而橙黄决明素组中C14∶0、C20∶4、C20∶5、C20∶0、C22∶6的含量对比模型组要更接近正常对照组;可得出C14∶0、C20∶0、C22∶6与高脂血症脂质代谢异常有密切关系,而橙黄决明素能一定程度上调节高脂血症大鼠的脂肪酸代谢。
综上所述,本研究采用GC-MS联用技术比较了正常对照组、模型组、橙黄决明素组、阿托伐他汀组大鼠血浆脂肪酸的差异,并研究了橙黄决明素对高脂血症大鼠血浆脂肪酸含量的影响。根据多元统计方法证实了高脂血症大鼠血脂中脂肪酸代谢通路出现了紊乱,且橙黄决明素可以通过调节脂肪酸的代谢达到较好的调脂作用,可以为临床治疗高脂血症人群提供参考。

