磁性Fe3O4@TpBD复合材料用于磁固相萃取食品中的赭曲霉毒素A
马甜甜, 庞月红, 钱海龙, 严秀平
(江南大学食品学院, 江苏无锡 214122)
赭曲霉毒素A(OTA)是一种常见的霉菌毒素,属2B类潜在致癌物[1],主要污染谷物如玉米、小麦[2 - 4]以及谷物的酿造制品如啤酒、白酒[6,7]和醋等。欧盟委员会(EC No.123/2005)限定在谷物和酒类中赭曲霉毒素A的最高含量分别为5 μg·kg-1和2 μg·kg-1[8]。目前测定赭曲霉毒素A通常采用免疫亲和柱进行净化和富集,其选择性好、回收率高,但价格昂贵、抗体不易保存[9]。因此,开发稳定耐用、操作简便的预富集方法具有重要的意义。
磁固相萃取(MSPE)可在外部磁场下实现快速分离,操作简便,且目标物与吸附剂充分接触,缩短富集时间。而在磁性粒子表面进行不同的功能化修饰,可制备满足不同需要的吸附剂。共价有机骨架材料(COFs)是一类由轻质元素通过共价键连接的多孔材料,其比表面积大、化学稳定性和热稳定性高、孔径可修饰[10]等特点使其在样品预处理[11,12]领域具有很好的应用潜力。本研究合成了Fe3O4@TpBD,建立了基于Fe3O4@TpBD的MSPE方法,并应用于高效液相色谱(HPLC)测定啤酒、白酒和醋中赭曲霉毒素A。
1 实验部分
1.1 仪器
JEM-2100透射电镜(TEM)(日本,电子株式会社);D2 PHASER X射线衍射仪(XRD)(德国,BRUKER AXS GMBH);IS10 FT-IR傅里叶变换红外(FT-IR)光谱仪(美国,Nicolet);MPMS3振动样品磁强计(VSM)(美国,Quantum Design);Nano-ZES Zeta电位分析仪(英国,Malvern);Autosorb-iQ全自动比表面和孔径分布分析仪(美国,Quantachrome)。配备2475荧光检测器的Waters e2695高效液相色谱仪,色谱柱为XBridge®C18柱(250 mm×4.6 mm,5 μm)(美国,Waters)。分离条件:流动相:A:乙腈,B:2%乙酸水溶液;A∶B=50∶50(V/V),等度洗脱,流速1 mL·min-1,进样体积10 μL。荧光检测器条件:激发波长333 nm,发射波长460 nm。
1.2 试剂与材料
赭曲霉毒素A标准品(青岛普瑞邦生物工程有限公司)。100 μg·mL-1的赭曲霉毒素A储备溶液由甲醇配制并储存于-20 ℃。250 μg·L-1的赭曲霉毒素A标准溶液由储备溶液使用甲醇逐级稀释制备。5 μg·L-1的工作溶液采用超纯水定容制备。1,3,5-三甲基间苯三酚(Tp)(成都同创源医药科技有限公司);联苯胺(BD)、均三甲苯、硅酸四乙酯(TEOS)、聚苯乙烯磺酸钠-马来酸共聚物(PSSMA 3∶1,Mw 20 000)和3-氨基丙基三乙氧基硅烷(APTES)(中国上海阿拉丁生化科技有限公司);甲酸、冰乙酸、乙二醇、氢氧化铵、FeCl3·6H2O、1,4-二氧六环、乙醇和N,N-二甲基甲酰胺(中国上海国药集团化学试剂有限公司);甲醇和乙腈均为色谱纯(中国赛默飞世尔科技有限公司);超纯水(杭州娃哈哈集团有限公司)。
1.3 Fe3O4@TpBD的制备
Fe3O4纳米粒子参考文献方法[13]合成。对Fe3O4纳米粒子进行氨基化:将150 mg Fe3O4纳米粒子分散在100 mL乙醇中并超声处理30 min,在机械搅拌下加入25 mL水和1.2 mL氢氧化铵溶液,然后将含100 μL TEOS的5 mL乙醇溶液加入体系中反应9 h。用磁铁收集深色产物,并用乙醇和水各洗涤3次。将得到的产物分散在120 mL N,N-二甲基甲酰胺中,加入0.5 mL APTES,在80 ℃水浴条件下搅拌9 h,分离产物并用乙醇和水洗涤,在真空干燥箱中干燥过夜。TpBD包裹Fe3O4纳米粒子参考Li等[14]的方法合成。其制备流程如图1所示。

图1 (A)Fe3O4@TpBD的制备流程图;(B)磁固相萃取流程图Fig.1 (A) Schematic illustration for fabricating Fe3O4@TpBD;(B) Schematic illustration for magnetic solid-phase extraction
1.4 样品采集与制备
样品白酒和醋购买于当地超市,啤酒样品购买于超市和烧烤摊。啤酒样品使用前超声30 min以除去CO2。醋样品直接用于磁固相萃取。白酒样品萃取时在4 mL白酒中加入1 mL超纯水进行实验。
1.5 磁固相萃取过程
准确称取5 mg Fe3O4@TpBD复合材料,置于5 mL 5 μg·L-1的赭曲霉毒素A溶液中5 min进行萃取,使用磁铁分离复合材料与溶液,之后弃去上清液,复合材料使用甲醇∶乙腈∶甲酸∶水(40∶50∶5∶5,V/V/V/V)的洗脱剂500 μL,超声处理3 min进行洗脱,并重复一次洗脱步骤,合并两次洗脱液(1 mL),使用0.22 μm的尼龙滤膜过滤后,用于高效液相色谱进行定量分析。
2 结果与讨论
2.1 Fe3O4@TpBD表征
对所合成的Fe3O4纳米粒子、TpBD以及Fe3O4@TpBD进行XRD以及FT-IR光谱表征,结果与文献一致[14],表明TpBD在Fe3O4纳米粒子上成功生长。VSM证明复合材料Fe3O4@TpBD的磁化饱和度值为37.4 emu·g-1,能够在外加磁场下快速与溶液分离。
对所合成Fe3O4纳米粒子和Fe3O4@TpBD的形貌进行表征。如图2(a)和2(b),与裸Fe3O4纳米粒子相比,Fe3O4@TpBD表面明显包覆一层材料,形成核-壳结构,包裹材料厚度约为40 nm。Fe3O4、TpBD和Fe3O4@TpBD的N2吸附-解吸等温线如图2(c)所示,其BET比表面积分别为56.7 m2·g-1、888.4 m2·g-1和447.8 m2·g-1,表明Fe3O4经与TpBD材料复合后,比表面积明显增加。
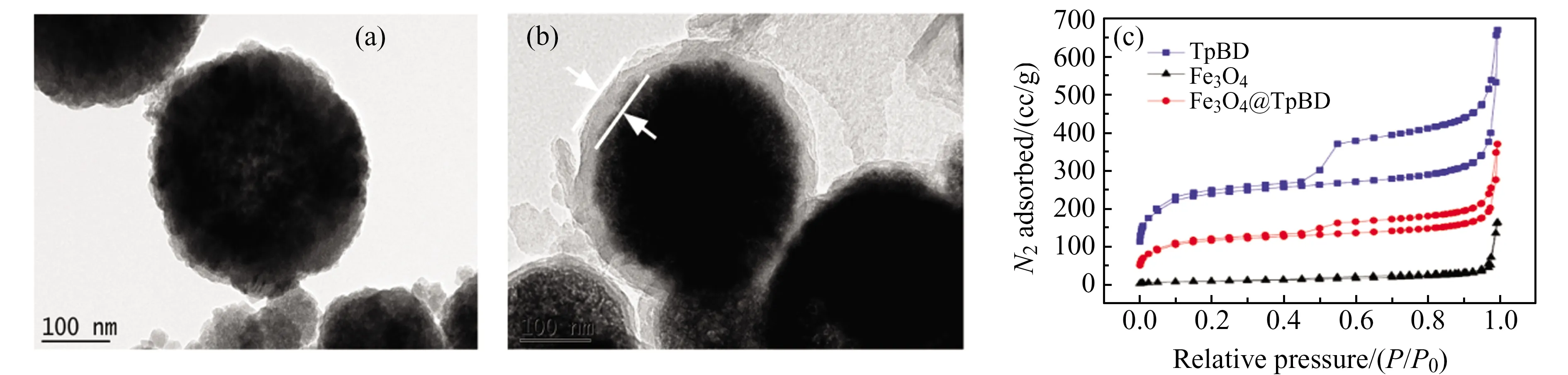
图2 (a)Fe3O4和(b)Fe3O4@TpBD的透射电镜图;(c)Fe3O4、TpBD和Fe3O4@TpBD的N2吸附-解吸等温线Fig.2 TEM images:(a) Fe3O4;(b) Fe3O4@TpBD.(c) Nitrogen adsorption-desorption isotherms of Fe3O4,TpBD and Fe3O4@TpBD
2.2 富集条件优化
2.2.1 吸附剂用量实验表明(图3(a)),2 mg吸附剂即可满足要求,但考虑到2 mg测定实际样品时可能存在杂质与目标物竞争吸附,实验选择5 mg吸附剂。
2.2.2 萃取时间在2~20 min范围内考察萃取时间(图3(b))。在考察范围内,赭曲霉毒素A峰面积无明显变化,表明Fe3O4@TpBD可在较短的时间完成对目标物的富集,故萃取时间选择5 min。
2.2.3 盐浓度盐浓度的增加对萃取效率并无明显影响(图3(c))。实验选用不添加盐。
2.2.4 溶液pH在pH=3~10的范围内考察溶液pH对萃取效率的影响(图3(d))。随着pH值的升高,萃取效率有微弱的增加趋势。可能是因为赭曲霉毒素A在酸性条件下易与H+形成分子间氢键,从而导致萃取效率较低。在实验中考虑操作的简便性,选择pH为6。
2.2.5 解吸溶剂考察不同溶剂对赭曲霉毒素A的洗脱性能(图3(e))。实验选用洗脱效果最好的甲醇∶乙腈∶甲酸∶水(40∶50∶5∶5,V/V/V/V)混合溶剂作为解吸溶剂。
2.2.6 解吸溶剂体积考察不同解吸溶剂体积的洗脱效果(图3(f))。当洗脱体积较小时易造成误差,以及少量多次更有利于充分洗脱,实验选择0.5 mL解吸溶剂,洗脱2次用于后续实验。

图3 萃取和洗脱条件的优化Fig.3 Optimization of extraction and elution conditions

图4 Fe3O4@TpBD复合材料的循环使用次数Fig.4 Cycles times used of Fe3O4@TpBD
2.3 Fe3O4@TpBD复合材料的重复使用性
为评价Fe3O4@TpBD的重复使用性,在MSPE后,将Fe3O4@TpBD用1 mL甲醇∶乙腈∶甲酸∶水(40∶50∶5∶5,V/V/V/V)超声洗脱3 min,重复3次,干燥后用于下次实验。在优化条件下使用5 mg Fe3O4@TpBD对5 mL 5 μg·L-1的赭曲霉毒素A标准溶液进行富集,经过7次吸附-解吸后Fe3O4@TpBD复合材料的萃取效率仍可保持在85.5%以上(图4)。
2.4 方法分析特性
所建立方法的分析特性见表1,线性范围为0.2~50.0 μg·L-1,相关系数为0.9999,检出限(S/N=3)为0.05 μg·L-1,定量限(S/N=10)为0.17 μg·L-1。

表1 Fe3O4@TpBD萃取赭曲霉毒素A的分析特性
2.5 实际样品分析
将所建立方法应用于2种啤酒、2种白酒和2种醋样品中赭曲霉毒素A的分析。啤酒样品1、白酒样品和醋样品中均未检测到赭曲霉毒素A,啤酒样品2中赭曲霉毒素A含量为0.46 μg·L-1,加标回收率为82.2%~106.1%,标准偏差小于7.2%(表2)。方法可应用于实际样品中赭曲霉毒素A的测定。

表2 实际样品以及加标样品中赭曲霉毒素A的分析结果(平均值±标准偏差,n=6)
aND:not detected.
2.6 方法比较
如表3所示,与其它文献方法比较,所建立的方法具有较低的检出限,且能够在实际加标样品测定中实现定量回收。

表3 赭曲霉毒素A的富集检测方法比较
aSWCNHs:single-walled carbon nanohorns.
3 结论
采用共价键合的方法将共价有机骨架材料TpBD修饰到Fe3O4纳米粒子表面,制备了Fe3O4@TpBD复合材料。该复合材料具有比表面积大、稳定性高以及重复性好的优点。将Fe3O4@TpBD复合材料作为磁性吸附剂,并与高效液相色谱联用,建立了赭曲霉毒素A的分析新方法。该方法检出限低、重复性好,并成功应用于食品样品中的赭曲霉毒素A的测定。

